从巩固到提高 高考化学二轮微专题15 铜及其化合物
试卷更新日期:2023-01-23 类型:二轮复习
一、单选题
-
1. 下列实验的相关叙述正确的是( )
 A、步骤①反应:Cu2++2OH-=Cu(OH)2↓ B、步骤②生成的[Cu(NH3)4]2+中含有离子键 C、溶液Y呈深蓝色是因为c(Cu2+)增大 D、在X中滴加Na2S溶液会生成CuS黑色沉淀2. “价-类”二维图可以表示元素化合价与物质类别之间的关系,下图中的a、b、c、d、e代表几种常见的含铜物质.
A、步骤①反应:Cu2++2OH-=Cu(OH)2↓ B、步骤②生成的[Cu(NH3)4]2+中含有离子键 C、溶液Y呈深蓝色是因为c(Cu2+)增大 D、在X中滴加Na2S溶液会生成CuS黑色沉淀2. “价-类”二维图可以表示元素化合价与物质类别之间的关系,下图中的a、b、c、d、e代表几种常见的含铜物质.
下列说法错误的是( )
A、a、b、c、d均难溶于水 B、a和氧气加热反应生成c C、d在一定条件下可转化为b D、e点代表的物质均显蓝色3. 湿法炼铜用稀硫酸溶解孔雀石(主要成分为Cu2(OH)2CO3],再向其中加入铁屑可得铜。下列有关说法错误的是( )A、Cu2(OH)2CO3属于盐类物质 B、FeSO4溶液呈酸性 C、Cu2(OH)2CO3和稀硫酸发生氧化还原反应 D、CuSO4溶液可使蛋白质变性4. 部分含铜物质的分类与相应化合价关系如图所示。下列推断不合理的是( ) A、新制d的悬浊液可用于检验病人是否患有糖尿病 B、a与溶液反应的离子方程式为 C、若e为无水 , 熔点: D、若e为 , e的水溶液中、、、可以大量共存5. 实验室中利用洁净的铜片和浓硫酸进行如图实验,经检测,所得固体中含有Cu2S和白色物质X,下列说法错误的是( )
A、新制d的悬浊液可用于检验病人是否患有糖尿病 B、a与溶液反应的离子方程式为 C、若e为无水 , 熔点: D、若e为 , e的水溶液中、、、可以大量共存5. 实验室中利用洁净的铜片和浓硫酸进行如图实验,经检测,所得固体中含有Cu2S和白色物质X,下列说法错误的是( ) A、白色物质X为CuSO4 B、微热5min待Cu反应结束后,转移电子的物质的量为0.48mol C、放出的NO在标准状况下的体积为0.896L D、向Y溶液中逐滴加入过量的氨水,先产生蓝色沉淀,后沉淀溶解6. 部分含铜物质的分类与相应化合价的关系如图所示。下列叙述错误的是( )
A、白色物质X为CuSO4 B、微热5min待Cu反应结束后,转移电子的物质的量为0.48mol C、放出的NO在标准状况下的体积为0.896L D、向Y溶液中逐滴加入过量的氨水,先产生蓝色沉淀,后沉淀溶解6. 部分含铜物质的分类与相应化合价的关系如图所示。下列叙述错误的是( ) A、d的代表物质具有强氧化性 B、将c的溶液与氢氧化钠溶液混合可制得不溶性碱 C、将b投入稀硫酸中,溶液变蓝 D、铜生锈的条件是铜和氧气、水同时发生接触7. 碱式氯化铜[CuaClb(OH)c·xH2O]是一种重要的无机杀虫剂,它的制备流程如下,下列有关说法正确的是( )
A、d的代表物质具有强氧化性 B、将c的溶液与氢氧化钠溶液混合可制得不溶性碱 C、将b投入稀硫酸中,溶液变蓝 D、铜生锈的条件是铜和氧气、水同时发生接触7. 碱式氯化铜[CuaClb(OH)c·xH2O]是一种重要的无机杀虫剂,它的制备流程如下,下列有关说法正确的是( ) A、FeCl3的作用是增强盐酸的氧化性 B、加入少量CuO目的是为了除去Fe3+ C、石灰乳可用纯碱代替 D、若制备1mol的CuCl2 , 理论上消耗11.2L空气8. Cu2O溶于硫酸生成Cu和CuSO4 , CuSO4溶液中加入强碱产生蓝色絮状沉淀,继续加入强碱沉淀溶解生成蓝色[Cu(OH)4]2-。CuSO4·5H2O的晶体结构如图,关于铜的化合物说法错误的是( )
A、FeCl3的作用是增强盐酸的氧化性 B、加入少量CuO目的是为了除去Fe3+ C、石灰乳可用纯碱代替 D、若制备1mol的CuCl2 , 理论上消耗11.2L空气8. Cu2O溶于硫酸生成Cu和CuSO4 , CuSO4溶液中加入强碱产生蓝色絮状沉淀,继续加入强碱沉淀溶解生成蓝色[Cu(OH)4]2-。CuSO4·5H2O的晶体结构如图,关于铜的化合物说法错误的是( ) A、蛋白质溶液中加入CuSO4发生变性 B、Cu2O溶于硫酸的离子方程式Cu2O+2H+=Cu2++Cu+H2O C、Cu(OH)2为两性氢氧化物,无法鉴别葡萄糖和蔗糖 D、CuSO4·5H2O晶体中SO 与水分子之间存在氢键9. 某同学通过实验研究铜盐溶液颜色的变化。下列说法错误的是( )
A、蛋白质溶液中加入CuSO4发生变性 B、Cu2O溶于硫酸的离子方程式Cu2O+2H+=Cu2++Cu+H2O C、Cu(OH)2为两性氢氧化物,无法鉴别葡萄糖和蔗糖 D、CuSO4·5H2O晶体中SO 与水分子之间存在氢键9. 某同学通过实验研究铜盐溶液颜色的变化。下列说法错误的是( ) A、由①②可知,②中溶液呈蓝色是Cu2+与水分子作用的结果 B、由④可知,Cu2+与Cl−可能会结合产生黄色物质 C、由③④可知,Cl−的浓度对铜盐溶液的颜色有影响 D、由②③④可知,CuCl2溶液一定为绿色10. CuSO4是一种重要的化工原料,其有关制备途径及性质如下图所示。下列说法正确的是( )
A、由①②可知,②中溶液呈蓝色是Cu2+与水分子作用的结果 B、由④可知,Cu2+与Cl−可能会结合产生黄色物质 C、由③④可知,Cl−的浓度对铜盐溶液的颜色有影响 D、由②③④可知,CuCl2溶液一定为绿色10. CuSO4是一种重要的化工原料,其有关制备途径及性质如下图所示。下列说法正确的是( ) A、相对于途径②,途径①更好地体现了绿色化学思想 B、Y可以是葡萄糖溶液 C、X可能是SO2和SO3的混合气体 D、将CuSO4溶液蒸发,利用余热蒸干,可制得胆矾晶体11. 将Fe粉、Cu粉、FeCl3溶液、FeCl2溶液和CuCl2溶液,混合于某容器中充分反应(假定容器不参与反应),下列情况下正确的是( )A、若Fe粉有剩余,则容器中不可能有Fe2+ B、若FeCl3有剩余,则容器中还含有Cu C、若CuCl2有剩余,则容器中不可能有Fe D、若Cu粉有剩余,则容器中不可能有Cu2+12. 已知酸性条件下有如下反应:2Cu+=Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
A、相对于途径②,途径①更好地体现了绿色化学思想 B、Y可以是葡萄糖溶液 C、X可能是SO2和SO3的混合气体 D、将CuSO4溶液蒸发,利用余热蒸干,可制得胆矾晶体11. 将Fe粉、Cu粉、FeCl3溶液、FeCl2溶液和CuCl2溶液,混合于某容器中充分反应(假定容器不参与反应),下列情况下正确的是( )A、若Fe粉有剩余,则容器中不可能有Fe2+ B、若FeCl3有剩余,则容器中还含有Cu C、若CuCl2有剩余,则容器中不可能有Fe D、若Cu粉有剩余,则容器中不可能有Cu2+12. 已知酸性条件下有如下反应:2Cu+=Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:加入
试剂
稀硫酸
浓硫酸、
加热
稀硝酸
浓硝酸
实验
现象
红色固体和蓝色溶液
无色气体和蓝色溶液
无色气体和蓝色溶液
红棕色气体和蓝色溶液
由此推出本次氢气还原氧化铜实验的产物是( )
A、Cu B、Cu2O C、一定有Cu,可能有Cu2O D、一定有Cu2O,可能有Cu13. 下表中对陈述Ⅰ、Ⅱ的符合题意性及其有无因果关系的判断都正确的是( )选项
陈述Ⅰ
陈述Ⅱ
判断
A
铜绿的主要成分是碱式碳酸铜
可用稀盐酸除去铜器表面的铜绿
Ⅰ对、Ⅱ对;有
B
铜表面易形成致密的氧化膜
铜容器可以盛放浓硫酸
Ⅰ对、Ⅱ错;无
C
银的导电性比铜的好,但导线一般用铜制而不用银制
铜比银的熔点高、密度小
Ⅰ对、Ⅱ对;有
D
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化
硫酸铜溶液可用作游泳池的消毒剂
Ⅰ对、Ⅱ对;无
A、A B、B C、C D、D14. 使用单质铜制硝酸铜,耗用原料最经济,而且对环境几乎没有污染的是( )A、Cu Cu(NO3)2 B、Cu CuO Cu(NO3)2 C、Cu Cu(NO3)2 D、Cu CuCl2 Cu(NO3)2二、综合题
-
15. 氯化亚铜(CuCl)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产CuCl的工艺如下:

已知CuCl难溶于醇和水,溶于c(Cl-)较大的体系[CuCl(s)+Cl- CuCl2-],潮湿空气中易水解氧化。
(1)、步骤1开始前需要对硫化铜精矿进行粉碎,目的是;(2)、步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是;(3)、步骤2是溶解过程,溶解时反应的离子方程式;(4)、步骤3为主反应,Cu+的沉淀率与加入的NH4Cl的量关系如图所示。
①反应的氧化产物是;
②比较c(Cu+)相对大小:A点C点(填“>”、“<”或“=”);
③提高C点状态混合物中Cu+沉淀率的措施是;
(5)、步骤4进行的实验操作是;(6)、洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是。16. 铜是生活中常见的金属,请回答下列问题:(1)、Cu不活泼,通常情况下不与稀硫酸反应,但向Cu和稀硫酸的混合物中滴入H2O2溶液后,溶液很快变蓝色,试写出该反应的离子方程式。(2)、将硫酸铜溶液和碳酸钠溶液混合,会析出Cu2(OH)2CO3绿色固体,试写出该反应的离子方程式。(3)、火法炼铜的原理:Cu2S+O2 2Cu+SO2 , 在该反应中每生成1 mol Cu,转移 mol e-。(4)、据报道,有一种细菌在有氧气存在的酸性溶液中,可将黄铜矿CuFeS2氧化成硫酸盐:4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O。利用反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
①检验溶液B中Fe3+是否被除尽的实验方法。
②在实验室中,设计方案,从溶液B中提炼金属铜(要求:方案只用一个反应来完成)。写出方案中的化学方程式:。
③从溶液B中获取胆矾的操作b是 , , 过滤,洗涤,干燥。
17. 辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示: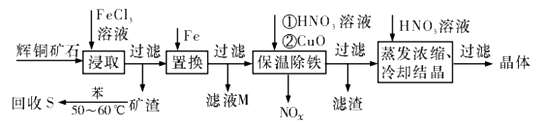 (1)、写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:(2)、“矿渣”中除了S以外,还有(填化学式);“回收S”过程中温度控制在50~60℃之间,不宜过高或过低的原因是(3)、“保温除铁”过程中,加入CuO的目的是;“蒸发浓缩、冷却结品”过程中,要用HNO3溶液调节溶液的pH,其理由是(4)、气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为;向“滤液M”中加入(或通入) (填母代号),可得到另一种流程中可循坏利用的物质。
(1)、写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:(2)、“矿渣”中除了S以外,还有(填化学式);“回收S”过程中温度控制在50~60℃之间,不宜过高或过低的原因是(3)、“保温除铁”过程中,加入CuO的目的是;“蒸发浓缩、冷却结品”过程中,要用HNO3溶液调节溶液的pH,其理由是(4)、气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为;向“滤液M”中加入(或通入) (填母代号),可得到另一种流程中可循坏利用的物质。a.铁
b.氯气
c.高锰酸钾
18. 硫酸铜是一种重要的化工产品。某工厂用刻蚀印刷电路板产生的碱性废液[含较多[Cu(NH3)4]2+及少量Cu2+、NH4+、NH3和Cl-]制备硫酸铜晶体,流程如下: (1)、通过“中和、沉淀和过滤”可得碱式氯化铜[Cu(OH)Cl]固体,请将生成该固体的反应的离子方程式补充完整:[Cu(NH3)4]2+ +。(2)、制备Cu(OH)Cl沉淀时,溶液的pH对铜元素含量的影响如下图所示:
(1)、通过“中和、沉淀和过滤”可得碱式氯化铜[Cu(OH)Cl]固体,请将生成该固体的反应的离子方程式补充完整:[Cu(NH3)4]2+ +。(2)、制备Cu(OH)Cl沉淀时,溶液的pH对铜元素含量的影响如下图所示:
①若要提高Cu(OH)Cl沉淀的量,应将溶液的pH控制在(填字母序号)。
A. <5.2 B. 5.2~5.8 C. >5.8
②pH< 5.2 时,随pH减小,溶液中铜元素含量增大,其原因用反应的离子方程式可表示为。
(3)、“化浆、酸化"过程可得到硫酸铜粗品,发生的反应为Cu(OH)Cl+ 4H2O+ H2SO4= CuSO4·5H2O+ HCl。则硫酸铜粗品中,含铜元素的杂质为 , 检验样品中含有该杂质的方法是:取少量硫酸铜粗品,加入适量水使其充分溶解,。(4)、硫酸铜粗品还需要通过重结晶法进行提纯,具体操作是:将粗晶体溶解于热水中形成饱和溶液,然后加入适量乙醇,搅拌,冷却,过滤并洗涤,得到高纯度的硫酸铜晶体。加入乙醇能够提高硫酸铜的产率,从溶解性角度解释其可能的原因是。19. 氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂.实验室拟以下列方法制取CuCl:在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl.试回答以下问题:(1)、CuCl制备过程中需配制物质的量浓度为2.0mol/L的CuSO4溶液.①配制950mL 2.0mol/L的CuSO4溶液应称取胆矾的质量为g.
②某学生实际配制CuSO4溶液的浓度为1.8mol/L,原因可能是 .
A.托盘天平的砝码生锈 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水定容时仰视刻度
(2)、写出用上述方法制备CuCl的离子方程式 .(3)、在上述制取过程中,经过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品.其中“于70℃真空干燥”的目的是; . (回答两点)(4)、据世界卫生组织统计,最常用的避孕环含金属铜,避孕过程中生成了CuCl.其原因是铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2=CuCl+HO2 , HO2(超氧酸) 不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示正确的是 .A、氧化产物是HO2 B、HO2在碱中能稳定存在 C、HO2 的电离方程式是HO2⇌H++O2﹣ D、1mol Cu 参加反应有2mol电子发生转移.20. 铜及其化合物在生产生活中有广泛应用,铜在化合物中的常见化合价有+l、+2.已知Cu2O与稀硫酸反应,溶液呈蓝色.(1)、工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 .(2)、将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2 , 反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃﹣60℃的两个原因除了加快反应速率外,还有 . 在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式 .(3)、某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成.①甲同学猜想:黑色固体是未来得及溶解于酸的CuO,其猜想可用化学方程式表示为:Cu+H2SO4
②乙同学认为:黑色固体除CuO外还可能含有Cu2S和CuS.其理由可能是(填字母)
a Cu2S和CuS都是黑色的
b 铜与浓硫酸在加热条件下反应,还可能放出O2
c 浓硫酸是氧化剂,铜是还原剂,Cu的化合价上升与S的化合价下降有多种可能
(4)、现向Cu、Cu2O和CuO组成的混合物中,加入1L 0.6mol/L HNO3溶液恰好使混合物溶解,同时收集到2240mL NO气体(标准状况).Cu2O跟稀硝酸反应的离子方程式 . 若将上述混合物用足量的H2加热还原,所得到固体的质量为 g.若混合物中含0.1mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 .三、实验探究题
-
21. 已知:①氮的氧化物能与红热的铜反应;②Cu2O在酸性条件下能迅速发生反应:Cu2O+2H+=Cu+Cu2++H2O。某小组设计实验探究NO和Cu反应的氧化产物(设Cu全部被氧化),装置如图所示(部分夹持装置未画出):

请回答下列问题:
(1)、装置E中倒置在水槽中的仪器名称为;装置B中试剂为。(2)、装置A中a的作用是;写出A中反应的离子方程式。(3)、实验开始时,先打开A中分液漏斗活塞,过一会儿,点燃D处酒精灯,这样操作的目的是。若观察到D中红色粉末变为黑色,说明D中有 (填化学式)生成。(4)、对D中氧化产物提出如下假设:假设1:氧化产物是CuO;
假设2:氧化产物是CuO和Cu2O的混合物。
为了探究氧化产物是否含有Cu2O,设计如下方案:
(甲)取少量完全反应后的产物,加入足量的稀硝酸,观察是否溶解
(乙)取少量完全反应后的产物,加入足量的稀硫酸,观察是否溶解
(丙)取少量完全反应后的产物,加入足量的浓硝酸,观察是否溶解
(丁)取少量完全反应后的产物,在加热条件下通入乙醇蒸气,观察是否变为红色其中,能达到实验目的的是 (填代号)。
(5)、若氧化产物为CuO和Cu2O的混合物,为测定其组成,取混合物5.92g与足量稀硝酸反应,测得生成448mL标准状况下NO气体,则混合物中CuO和Cu2O的物质的量之比为。22. 绿色植物标本用醋酸铜[(CH3COO)2Cu]处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。(1)、Ⅰ.醋酸铜晶体的制备
①中,用离子方程式表示产物里OH-的来源是。
(2)、②中,化学方程式是。(3)、③中采用的实验方法依据醋酸铜的性质是。(4)、Ⅱ.测定产品中铜的含量ⅰ.取a g醋酸铜产品于具塞锥形瓶中,用稀醋酸溶解,加入过量KI溶液,产生CuI沉淀,溶液呈棕黄色;
ⅱ.用b mol·L-1 Na2S2O3标准溶液滴定ⅰ中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用Na2S2O3标准溶液滴定至蓝色近于消失;
ⅲ.向ⅱ所得浊液中加入KSCN溶液,充分摇动,溶液蓝色加深;
ⅳ.继续用Na2S2O3 标准溶液滴定ⅲ中浊液至终点,消耗标准溶液v mL。
已知:① ,Na2S2O3溶液和Na2S4O6溶液颜色均为无色;
②CuI易吸附I2 , CuSCN难溶于水且不吸附I2。被吸附的I2不与淀粉显色。
ⅰ中发生反应的离子方程式是。
(5)、结合离子方程式说明,ⅲ中加入KSCN的目的是。(6)、醋酸铜产品中铜元素的质量分数是。23. CuSO4溶液与Na2CO3溶液混合时产生蓝绿色沉淀,某实验小组进行实验,探究蓝绿色沉淀的组成。【查阅资料】
i.氢氧化铜是一种蓝色絮状沉淀,难溶于水,溶于酸、氨水等,受热会分解。
ii.碳酸铜是蓝绿色粉末状固体,受热易分解,遇水转化为氢氧化铜和碱式碳酸铜的混合物。
iii.碱式碳酸铜呈孔雀绿颜色,又叫孔雀石,难溶于水,溶于酸、氨水等,在空气中加热会分解。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为CuCO3
假设3:沉淀为碱式碳酸铜[化学式可表示为xCuCO3•yCu(OH)2]
(1)、假设1中产生沉淀Cu(OH)2的离子方程式是。(2)、甲同学认为假设2不成立,理由是。(3)、【定性实验】实验小组同学将沉淀从溶液中分离并净化,取少量净化后的固体于试管中,滴加稀硫酸,观察到 , 证明假设3成立。
(4)、【定量实验】为了确定碱式碳酸铜化学式中x与y的关系,实验小组称取净化后的蓝绿色固体m1 g,使用下列装置(夹持仪器未画出)进行实验。
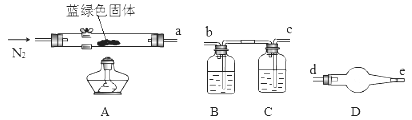
B,C,D中的试剂依次为(填标号)。
a.澄清石灰水
b.碱石灰
c.氯化钙溶液
d.浓硫酸
(5)、各装置接口的连接顺序:a→(填字母序号)。(6)、装置D的作用是。(7)、加热到固体完全分解,硬质玻璃管中得到黑色固体,其余产物被相应装置完全吸收。实验结束后,测得装置B的质量增加m2 g,则xCuCO3•yCu(OH)2中 =(列式表示)。若无D装置,则 的值(填“偏大”或“偏小”或“无影响”)。24. 某化学学习小组在学习了Al、Fe的性质后,设计如下实验,探究Cu的常见化合物的性质。[实验1]探究Cu(OH)2是否具有两性
药品:CuSO4溶液、浓NaOH溶液、稀H2SO4。
实验步骤:
①取少量CuSO4溶液于试管中,逐滴加入浓NaOH溶液至产生较多蓝色沉淀,静置后过滤。
②结论:Cu(OH)2具有两性。
(1)、实验步骤②的内容为(2)、能证明Cu(OH)2具有两性的实验现象为(3)、[实验2]探究Cu(I)和Cu(Ⅱ)的稳定性实验步骤:
①取98gCu(OH)2固体,加热至80~100℃时,得到80g黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。
②冷却后称量,A的质量为72g。
③向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。
通过计算判断A的化学式为(不需要书写计算过程)
(4)、步骤③中发生反应的离子方程式为(5)、根据上述实验现象得出Cu(I)和Cu(Ⅱ)的稳定性大小的结论为:固态时 , 酸性溶液中。(6)、[实验3]探究CuO被NH3还原的产物该学习小组同学设计了如图所示的实验装置(夹持及尾气处理装置未面出)。实验中观察到CuO变为红色物质。查资料可知,同时生成一种无污染的气体。

反应产生的无污染气体的化学式为
(7)、有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计个简单的实验方案验证红色物质中是否含有A:。25.I.回答下列问题:
(1)、欲量取20.00 mL KMnO4酸性溶液,应选用的仪器是。(2)、中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、、。(3)、在测定硫酸铜晶体中结晶水含量的实验中,称量操作至少要进行次。(4)、II.氢氧化铜是一种常用试剂。例如,利用新制氢氧化铜验证醛类物质的还原性。新制氢氧化铜悬浊液的配制。实验室制取氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2 mL,滴入2%的硫酸铜溶液4~6滴,振荡即成。这样操作的目的是。
(5)、下面是三个研究性学习小组分别从不同层面开展的研究性学习活动:研究性学习小组甲:对教材实验结论“乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O”提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究,提出猜想:。
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应,生成+2价的铜离子和单质铜;③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:
方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化。
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣。
方案3:称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称量,反复多次至固体恒重,称得质量为b g,比较a、b关系。
方案4:取该红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出。
你认为合理的方案是。
(6)、研究性学习小组乙针对甲的质疑,设计新的探究方案,装置如下图所示。
你认为要测定上述红色沉淀成分必须测定下列哪些物理量(只填序号):。
①通入氢气体积;②反应前,红色沉淀 + 硬质玻璃管的总质量;③完全反应后红色固体 + 硬质玻璃管的总质量;④实验前,干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管质量。
(7)、研究性学习小组丙上网查阅新闻得知:“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”。绿色化学强调对环境友好,实现零排放。“变废为宝”符合绿色化学要求。他们收集上述红色沉淀制备化学试剂:蓝矾。请你帮助他们设计一个简单且符合绿色化学要求的实验方案:。