从巩固到提高 高考化学二轮微专题14 铁及其相关化合物
试卷更新日期:2023-01-23 类型:二轮复习
一、单选题
-
1. 已知:M、N、P、Q是化学中常见的物质,它们之间有如图反应关系。下列说法正确的是( )
 A、若M是具有磁性的黑色金属氧化物,则P、Q不可相互转化 B、若N是石灰乳,则工业上可以上述物质转化关系为原理处理尾气中的氯气 C、若M、N分别为NH4Cl固体和NaOH固体,则上述物质转化关系为实验室制备氨气的原理 D、若M、N、P、Q均含同一种元素,且常温下P为黄色固体单质,则M、N均能与Q反应2. 下列实验的现象与对应结论均正确的是( )
A、若M是具有磁性的黑色金属氧化物,则P、Q不可相互转化 B、若N是石灰乳,则工业上可以上述物质转化关系为原理处理尾气中的氯气 C、若M、N分别为NH4Cl固体和NaOH固体,则上述物质转化关系为实验室制备氨气的原理 D、若M、N、P、Q均含同一种元素,且常温下P为黄色固体单质,则M、N均能与Q反应2. 下列实验的现象与对应结论均正确的是( )选项
操作
现象
结论
A
向NaHCO溶液中加入Na[Al(OH)4]溶液
有白色沉淀生成
[Al(OH)4]-结合H+的能力比CO 弱
B
用pH试纸测定NaCl和NaF溶液的pH
pH(NaCl)<pH(NaF)
F元素的非金属性强于Cl
C
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液
溶液显红色
Fe(NO3)2晶体已氧化变质
D
向久置的Na2SO3溶液中加入足量BaCl2溶液,再加入足量稀盐酸
先出现白色沉淀后部分溶解
部分Na2SO3氧化变质
A、A B、B C、C D、D3. 宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书写正确的是( )A、 放入水中: B、 通过灼热铁粉: C、铜丝插入热的浓硫酸中: D、 通入酸性 溶液中:4. 下列实验操作对应的现象和根据现象得出的结论均正确的是( )实验操作
现象
结论
A
向FeCl3溶液中滴加稀氨水
溶液由黄色变为红棕色
生成了氢氧化铁胶体
B
碳和浓硫酸加热所得气体产物依次通过品红溶液和澄淸石灰水
品红溶液褪色,澄清石灰水变浑浊
气体产物中含有CO2和SO2
C
向某溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
溶液中存在亚铁离子
D
裂化汽油与碘水混合振荡并静置分层
有机层显紫色,水层变为无色
裂化汽油将碘萃取到有机层中
A、A B、B C、C D、D5. 铁粉具有平肝镇心,消痈解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。某兴趣小组探究用氢气和碳酸亚铁制取铁粉并检验反应产物,实验装置如图。下列说法错误的是( ) A、通过调节分液漏斗的活塞以控制①中气泡产生快慢 B、装置①的作用是干燥氢气 C、装置②、③中的药品可分别是无水硫酸铜、无水氯化钙 D、无需加③装置6. 向稀硫酸和稀硝酸的混合溶液200 mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列分析错误的是( )
A、通过调节分液漏斗的活塞以控制①中气泡产生快慢 B、装置①的作用是干燥氢气 C、装置②、③中的药品可分别是无水硫酸铜、无水氯化钙 D、无需加③装置6. 向稀硫酸和稀硝酸的混合溶液200 mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列分析错误的是( )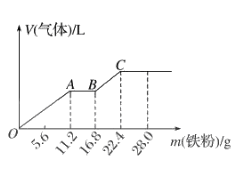 A、OA段产生的是NO,AB段的反应为Fe+ 2Fe3+=3Fe2+ , BC 段产生H2 B、A点溶液中的溶质为Fe(NO3)3和H2SO4 C、原混合酸中NO3- 物质的量为0.2 mol D、原混合酸中H2SO4的物质的量浓度为2 mol·L-17. 将一定量的铁粉加入到一定浓度的稀硝酸中,金属恰好完全溶解,反应后溶液中存在:c(Fe2+):c(Fe3+)=3:2,则参加反应的Fe和HNO3的物质的量之比为( )
A、OA段产生的是NO,AB段的反应为Fe+ 2Fe3+=3Fe2+ , BC 段产生H2 B、A点溶液中的溶质为Fe(NO3)3和H2SO4 C、原混合酸中NO3- 物质的量为0.2 mol D、原混合酸中H2SO4的物质的量浓度为2 mol·L-17. 将一定量的铁粉加入到一定浓度的稀硝酸中,金属恰好完全溶解,反应后溶液中存在:c(Fe2+):c(Fe3+)=3:2,则参加反应的Fe和HNO3的物质的量之比为( )
A、5:12 B、5:16 C、2:3 D、3:28. 下列各组实验中,根据实验现象所得到的结论正确的是( )选项
实验操作和实验现象
结论
A
向FeCl2和KSCN的混合溶液中滴入酸化的AgNO3溶液,溶液变红
Ag+的氧化性比Fe3+的强
B
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明
生成的1,2-二溴乙烷无色,能溶于四氯化碳
C
向硫酸铜溶液中逐滴加入氨水至过量,先生成蓝色沉淀,后沉淀溶解,得到深蓝色透明溶液
Cu(OH)2沉淀溶于氨水生成[Cu(OH)4] 2-
D
用pH试纸测得:CH3COON a溶液的pH约为9, NaNO2溶液的pH约为8
HNO2电离出H+的能力比CH3COOH的强
A、A B、B C、C D、D9. 由下列实验及现象推出的相应结论正确的是( )实验
现象
结论
A.某溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
原溶液中有Fe2+ , 无Fe3+
B.向C6H5ONa溶液中通入CO2
溶液变浑浊
酸性:H2CO3>C6H5OH
C.向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液
生成黑色沉淀
Ksp(CuS)<Ksp(ZnS)
D.①某溶液中加入Ba(NO3)2溶液
②再加足量盐酸
①产生白色沉淀
②仍有白色沉淀
原溶液中有SO42-
A、A B、B C、C D、D10. 实验室测定氧化物X(FexO)的组成实验如下:
下列有关说法正确的是( )
A、样品X中氧元素的质量分数约为26.3% B、溶液Y中c(Fe2+):c(Fe3+)=2:1 C、用酸性高锰酸钾溶液检验溶液Z中是否含有Fe2+ D、根据步骤I、Ⅱ可以判断X的组成为Fe0.75O11. 铁元素的“类—价”二维图如下图所示。下列有关说法正确的是( ) A、高温下a与水蒸气反应可得到e B、在空气中加热c,可实现c→b的转化 C、向d的硝酸盐溶液中加入稀盐酸,可实现d→g的转化 D、在水中g易水解,在水处理过程中常加入g的硫酸盐杀菌消毒12. 检验菠菜中是否含有铁元素,依次进行灼烧、溶解、过滤、检验四个实验步骤,下列图示,装置或原理不合理的是( )
A、高温下a与水蒸气反应可得到e B、在空气中加热c,可实现c→b的转化 C、向d的硝酸盐溶液中加入稀盐酸,可实现d→g的转化 D、在水中g易水解,在水处理过程中常加入g的硫酸盐杀菌消毒12. 检验菠菜中是否含有铁元素,依次进行灼烧、溶解、过滤、检验四个实验步骤,下列图示,装置或原理不合理的是( )



A.用烧杯将菠菜灼烧成灰
B.用浓盐酸溶解灰烬并加水稀释
C.过滤得到含铁元素的滤液
D.检验滤液中是否含离子
A、A B、B C、C D、D13. 某化学小组在实验室中利用进行如下实验。下列说法错误的是( ) A、红色固体是 B、加热过程发生的反应中氧化产物与还原产物的物质的量之比为1∶1 C、在标准状况下,气体Y的体积可能为 D、气体Y通入溶液中可产生白色沉淀14. 化学创造美好生活。下列劳动项目涉及反应的方程式错误的是( )A、工人用溶液制作电路板,利用反应: B、药剂师用作抗胃酸药,利用反应: C、船舶工程师在船体上镶嵌锌块,防止反应: D、工人将模具干燥后再注入熔融钢水,防止反应:15. X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图的转化关系(其他产物已略去).
A、红色固体是 B、加热过程发生的反应中氧化产物与还原产物的物质的量之比为1∶1 C、在标准状况下,气体Y的体积可能为 D、气体Y通入溶液中可产生白色沉淀14. 化学创造美好生活。下列劳动项目涉及反应的方程式错误的是( )A、工人用溶液制作电路板,利用反应: B、药剂师用作抗胃酸药,利用反应: C、船舶工程师在船体上镶嵌锌块,防止反应: D、工人将模具干燥后再注入熔融钢水,防止反应:15. X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图的转化关系(其他产物已略去).
下列选项中的物质不能实现如上图转化的是( )
X
Y
Z
W
A
B
S
C
D
A、A B、B C、C D、D16. 如图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系。下列说法正确的是( ) A、铁与高温水蒸气的反应可实现上述转化① B、FeO是一种黑色粉末,不稳定,在空气中受热,迅速发生转化②生成红棕色粉末 C、加热发生转化⑥,加水溶解可实现转化③ D、由图可预测:高铁酸盐具有强氧化性,可用于消毒;消毒后可生成胶体,故可作净水剂17. FeCl3易潮解、易升华,实验室制备FeCl3的装置如图所示(加热和夹持装置已略去)。下列说法不正确的是( )
A、铁与高温水蒸气的反应可实现上述转化① B、FeO是一种黑色粉末,不稳定,在空气中受热,迅速发生转化②生成红棕色粉末 C、加热发生转化⑥,加水溶解可实现转化③ D、由图可预测:高铁酸盐具有强氧化性,可用于消毒;消毒后可生成胶体,故可作净水剂17. FeCl3易潮解、易升华,实验室制备FeCl3的装置如图所示(加热和夹持装置已略去)。下列说法不正确的是( ) A、导管g的作用是平衡气压,便于液体滴下 B、试剂X和试剂Y分别为饱和食盐水、浓硫酸 C、直接用E接收产物比用导管连接D,E的优点是可防止堵塞 D、出于简化装置的目的,F装置可拆除18. 用废铁屑[主要成分为Fe和铁锈 , 还含有C等难溶于酸的杂质]为原料制备的一种实验流程如下:
A、导管g的作用是平衡气压,便于液体滴下 B、试剂X和试剂Y分别为饱和食盐水、浓硫酸 C、直接用E接收产物比用导管连接D,E的优点是可防止堵塞 D、出于简化装置的目的,F装置可拆除18. 用废铁屑[主要成分为Fe和铁锈 , 还含有C等难溶于酸的杂质]为原料制备的一种实验流程如下:
下列与流程相关的装置或操作正确且能达到实验目的的是( )
 A、可在装置甲中进行“酸浸”操作 B、按图乙所示操作配制“酸浸”所需的溶液 C、用装置丙过滤“酸浸”后所得悬浊液 D、用装置丁灼烧固体制
A、可在装置甲中进行“酸浸”操作 B、按图乙所示操作配制“酸浸”所需的溶液 C、用装置丙过滤“酸浸”后所得悬浊液 D、用装置丁灼烧固体制二、实验探究题
-
19. 无水是有机合成催化剂,还可做作水处理剂等。实验室可用和亚硫酰氯()制备无水 , 装置如图所示(加热及夹持装置略)。已知无水能吸收空气里的水分而潮解;沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
 (1)、仪器B的名称是 , 其加热的合理方式为;F装置中填充的试剂是(填名称);仪器E的作用为。(2)、已知六水合氯化铁在水中的溶解度如下表:
(1)、仪器B的名称是 , 其加热的合理方式为;F装置中填充的试剂是(填名称);仪器E的作用为。(2)、已知六水合氯化铁在水中的溶解度如下表:温度/℃
0
10
20
30
50
80
100
溶解度(g/100g)
74.4
81.9
91.8
106.8
315.1
525.8
535.7
则由溶液制得晶体的方法为:。最后过滤洗涤干燥。常温下,若溶液的pH控制不当会使沉淀,当调节溶液的时,溶液中mol⋅L。(常温下).
(3)、已知:过量,请写出D中在加热时产生的化学方程式:。(4)、为了检验D中最终产品是否含有 , 取少量产品溶于盐酸,(填操作和现象),则产品含不。20. 化学实验社团成员将某器件加工企业的生产废料溶解后取样20mL,进行分离并测定Fe3+浓度的实验实践活动,设计实验方案如下:
已知:①乙醚[(C2H5)2O]低毒,微溶于水,密度比水小,沸点34.5℃,易挥发;
②当盐酸浓度较高时,Fe3+、HCl与乙醚易形成缔合物[(C2H5)2OH][FeCl4]而易溶于乙醚;当盐酸浓度降低时,该缔合物解离。
回答下列问题:
(1)、铬在元素周期表中的位置是。(2)、步骤I中操作a的名称是 , 该操作完成后,简述检验Fe3+已无残留的方法是。(3)、步骤II中加“适量水”的目的是。(4)、步骤III中的还原剂X最好是难溶性还原剂,原因是。(5)、步骤IV滴定反应的离子方程式为。滴定至终点,测得平均消耗0.0500mol∙L-1K2Cr2O7溶液16.00mL,试样中Fe3+的物质的量浓度为;滴定过程中,下列操作可能导致测定结果偏高的是(填标号)。a.锥形瓶内有少量水
b.盛装K2Cr2O7标准液的滴定管未润洗
c.步骤Ⅲ用滴定管移取溶液时终读数俯视
d.滴定结束,滴定管尖嘴处有气泡
21. 铁黄()是重要的化工产品。某学校兴趣小组用如图所示装置,进行铁黄制备研究,具体操作如下:向三颈烧瓶中依次加入硫酸亚铁溶液、铁黄晶种和过量碎铁皮,在水浴加热条件下,持续通入空气并不断搅拌,在晶种上得到铁黄晶体。 (1)、检验反应完成后上层溶液中是否存在的实验方法为。(2)、结合反应原理解释加入过量碎铁皮的作用是。(3)、测定样品中铁黄的质量分数。
(1)、检验反应完成后上层溶液中是否存在的实验方法为。(2)、结合反应原理解释加入过量碎铁皮的作用是。(3)、测定样品中铁黄的质量分数。①配制标准溶液。实验过程可描述为 , 继续加入蒸馏水至离刻度线处,改用胶头滴管加水至溶液凹液面最低处与刻度线相切,塞好瓶塞,颠倒摇匀,装瓶贴上标签。
②称取铁黄样品置于锥形瓶中,加入适量稀盐酸、加热,滴加稍过量的溶液(将还原为)充分反应,再除去过量的。用上述配制的标准溶液滴定至终点(),消耗溶液。计算该样品中铁黄的质量分数(写出计算过程)。
(4)、铁和氨在时可发生置换反应,一种产物的晶胞结构如图所示。
①该产物的化学式为。
②氮原子位于由铁原子构成的正八面体的中心。在答题卡的中用“-”将铁原子构成的正八面体连接起来。
22. 长期放置的FeSO4溶液易被氧化而变质。某兴趣小组分别对新制和久置的两瓶FeSO4溶液进行了如表实验。(1)、I.分别取2mL新制的FeSO4溶液于三支试管中,进行如图实验。
实验
试剂X
实验现象
实验i
1mL1mol/LNaOH溶液
现象a
实验ii
5滴酸性KMnO4溶液
现象b:紫色褪去
实验iii
依次加入5滴KSCN溶液、5滴氯水
现象c
方案i中,现象a是立即产生白色沉淀,白色沉淀逐渐变为灰绿色,最终变为红褐色。白色沉淀的化学式是 , 最终变为红褐色的化学方程式是。
(2)、方案iii的实验现象是 , 写出氯水参与反应的的离子方程式:。(3)、II.久置的FeSO4溶液。实验操作
实验现象
实验结论
实验iv
取少量久置的FeSO4溶液于试管中,向其中滴加5滴KSCN溶液
溶液变红
FeSO4溶液部分变质
实验v
将上述实验v中的实验操作和现象补充完整。
(4)、若要使部分变质的FeSO4复原,发生反应的离子反应方程式是。(5)、小组同学查阅资料得知,“维生素C可将Fe3+转化为Fe2+”。为了验证维生素C的作用,设计了如表实验vi。实验操作
实验现象
实验vi
取一定量Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性KMnO4溶液
紫色褪去
由实验vi能否得出“维生素C可将Fe3+转化为Fe2+”的结论?请说明理由。
三、综合题
-
23. 以废铁屑(含及少量Fe和)为原料制备和晶体的流程如下:

已知:①25℃时, , , ;
②晶体呈翠绿色,可溶于水、难溶于乙醇。
(1)、室温下,若滤液I中为 , 要保证无沉淀产生,则应调节滤液I的pH小于。(2)、向滤液I中加入过量铁粉,使完全转化为。检验是否完全还原的实验操作是。(3)、将滤液II与饱和溶液混合即可制得。①滤液II和饱和溶液的混合方程式为。
②混合过程中放出的气体为(填化学式)。
(4)、甲同学认为流程中,用代替空气与滤液I反应效果更好,乙同学不同意甲的观点,其理由是。(5)、写出加入饱和溶液时发生反应的离子方程式:。(6)、经“一系列操作”获得翠绿色晶体后,用乙醇洗涤晶体的目的是。24. 钒及其化合物在工业上有许多用途。从废钒(主要成分V2O3、V2O5、Fe2O3、FeO、SiO2)中提取五氧化二钒的一种工艺流程如图。
已知:①VOSO4能溶于水,VO2+与Fe不能反应。
②有机溶剂H2R对VO2+及Fe3+萃取率高,但不能萃取Fe2+。
回答下列问题:
(1)、“酸浸、氧化”过程中若用浓盐酸代替硫酸,V2O5转化为VO2+ , 同时生成有毒的一种气体,反应的化学方程式为。同时该步骤中V2O3转化为VO2+ , 反应的离子方程式为。(2)、萃取前用“铁粉”对酸浸后的浸出液进行处理,主要目的是 , 为检验处理后的浸出液中是否含有该杂质离子,可选用的化学试剂是(填试剂名称)。(3)、“溶剂萃取与反萃取”可表示为:VO2++H2RVOR+2H+。为了提高VO2+的产率,反萃取剂可选用。(供选物质:NaCl,NaOH,H2SO4 , 填写相应物质的化学式)(4)、反萃取后的水层中加KClO3 , 使VO2+变为VO , ClO变为Cl-。当反应1.5molVO2+时,至少需要KClO3的物质的量为mol。(5)、已知NH4VO3难溶于水,Kap=3.0×10-8 , 向10mL0.1mol·L-1NaVO3的滤液中加入等体积的NH4Cl溶液忽略混合过程中的体积变化,欲使VO沉淀完全,则NH4Cl溶液的最小浓度为(保留两位有效数字,溶液中某离子浓度≤1×10-6mol·L-1时,认为该离子沉淀完全)