从巩固到提高 高考化学二轮微专题13 镁、铝及相关化合物
试卷更新日期:2023-01-22 类型:二轮复习
一、单选题
-
1. 有关铝及其化合物的说法正确的是( )A、铝片可与冷水剧烈反应 B、铝热反应放出的热量使生成的铁熔化 C、氧化铝是碱性氧化物 D、氢氧化铝能溶于稀氨水2. 依据动力学原理,CaMg(CO3)2分解过程中Mg2+会比Ca2+优先向外扩散,CO随后扩散到表面分解产生CO2和O2- , 而Ca2+与CO的结合能力较强,不易扩散。如图为在一定条件下的热重分析图。

下列说法错误的是( )
A、第一阶段反应的化学方程式为:CaMg(CO3)2CaCO3+MgO+CO2↑ B、图中B点时,碳酸钙的分解率为60% C、图中C点以后剩余固体的成分是CaO、MgO D、第二阶段图像斜率明显加大可能是因为温度较高使反应速率加快3. 工业上用铝土矿(主要成分为Al2O3 , 含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述错误的是( ) A、步骤①中,试剂X一般使用的是氢氧化钠溶液 B、步骤②中,主要的离子反应可能是: C、步骤③中的加热操作常在蒸发皿中完成 D、步骤④中,在电解装置的阴极得到液态金属铝4. 下列有关铝及其化合物的性质与用途具有对应关系的是( )A、铝的导热性强,可用作铝热剂 B、氧化铝的熔点高,可用于电解铝 C、氢氧化铝具有弱酸性,可用于治疗胃酸过多 D、明矾易水解生成胶体,可用作絮凝剂5. 将使用过的废铝热剂(主要成分为 , 含少量)再生制取金属铝的工艺流程如图所示。下列说法中正确的是( )
A、步骤①中,试剂X一般使用的是氢氧化钠溶液 B、步骤②中,主要的离子反应可能是: C、步骤③中的加热操作常在蒸发皿中完成 D、步骤④中,在电解装置的阴极得到液态金属铝4. 下列有关铝及其化合物的性质与用途具有对应关系的是( )A、铝的导热性强,可用作铝热剂 B、氧化铝的熔点高,可用于电解铝 C、氢氧化铝具有弱酸性,可用于治疗胃酸过多 D、明矾易水解生成胶体,可用作絮凝剂5. 将使用过的废铝热剂(主要成分为 , 含少量)再生制取金属铝的工艺流程如图所示。下列说法中正确的是( ) A、“碱浸”时,发生反应的化学方程式为 B、“沉铝”时,可以用足量HCl代替 C、冶炼金属铝的方法为热还原法 D、该流程中各步均不涉及氧化还原反应6. 下列有关钠、铝、铁单质及其化合物的性质的说法中正确的是( )A、钠表面自然形成的氧化层能够保护内层金属不被空气氧化 B、可用氢氧化钙溶液鉴别溶液和溶液 C、、、均能通过化合反应制得 D、Al、、、均能与NaOH溶液发生反应7. 下列“类比”或“对比”合理的是( )A、溶液与过量的氨水反应生成沉淀,则溶液与过量的氨水反应生成沉淀 B、在空气中燃烧生成 , 则在空气中燃烧生成 C、在潮湿的空气中被腐蚀最终生成氧化物,则在潮湿的空气中被腐蚀最终生成氧化物 D、固体与浓加热可制 , 则固体与浓加热可制8. 甲、乙、丙、丁四种物质发生如图所示的转化:
A、“碱浸”时,发生反应的化学方程式为 B、“沉铝”时,可以用足量HCl代替 C、冶炼金属铝的方法为热还原法 D、该流程中各步均不涉及氧化还原反应6. 下列有关钠、铝、铁单质及其化合物的性质的说法中正确的是( )A、钠表面自然形成的氧化层能够保护内层金属不被空气氧化 B、可用氢氧化钙溶液鉴别溶液和溶液 C、、、均能通过化合反应制得 D、Al、、、均能与NaOH溶液发生反应7. 下列“类比”或“对比”合理的是( )A、溶液与过量的氨水反应生成沉淀,则溶液与过量的氨水反应生成沉淀 B、在空气中燃烧生成 , 则在空气中燃烧生成 C、在潮湿的空气中被腐蚀最终生成氧化物,则在潮湿的空气中被腐蚀最终生成氧化物 D、固体与浓加热可制 , 则固体与浓加热可制8. 甲、乙、丙、丁四种物质发生如图所示的转化: (反应条件略去,箭头表示一步转化)。下列不满足转化关系的是( )
(反应条件略去,箭头表示一步转化)。下列不满足转化关系的是( )选项
甲
乙
丙
丁
A
Al
B
HCl
C
Si
D
A、A B、B C、C D、D9. 以低品位粉煤灰(主要成分为 , 还含有少量杂质)为原料制备的工艺流程如下,下列说法错误的是( ) A、“酸浸”时,适当增大盐酸浓度可提高金属离子的浸出速率 B、应选择蒸馏水对得到的粗品进行洗涤 C、“母液”经一系列操作后可重新获得 D、与在HCl气流中蒸发结晶相比,盐析结晶对设备的要求较低10. 下列说法正确的是( )A、石墨转化为金刚石是化学变化 B、常温下,铁、铝与浓硫酸不发生反应 C、标准状况下,2.24LNO2中含有的氧原子的数目为0.2NA D、向硫酸铵溶液中加入氢氧化钡溶液。发生反应的离子方程式为Ba2++=BaSO4↓11. 某矿物含Al2O3、MgO,工业上先用过量烧碱溶液处理该矿物,然后过滤。再往所得滤液中逐滴加入NaHCO3溶液,测得溶液pH和生成Al(OH)3的物质的量与所加入NaHCO3溶液体积变化的曲线见下图。点e的坐标为(40,32)。
A、“酸浸”时,适当增大盐酸浓度可提高金属离子的浸出速率 B、应选择蒸馏水对得到的粗品进行洗涤 C、“母液”经一系列操作后可重新获得 D、与在HCl气流中蒸发结晶相比,盐析结晶对设备的要求较低10. 下列说法正确的是( )A、石墨转化为金刚石是化学变化 B、常温下,铁、铝与浓硫酸不发生反应 C、标准状况下,2.24LNO2中含有的氧原子的数目为0.2NA D、向硫酸铵溶液中加入氢氧化钡溶液。发生反应的离子方程式为Ba2++=BaSO4↓11. 某矿物含Al2O3、MgO,工业上先用过量烧碱溶液处理该矿物,然后过滤。再往所得滤液中逐滴加入NaHCO3溶液,测得溶液pH和生成Al(OH)3的物质的量与所加入NaHCO3溶液体积变化的曲线见下图。点e的坐标为(40,32)。
有关说法错误的是( )
A、生成沉淀时的离子方程式:HCO +AlO +H2O →Al(OH)3↓+CO B、NaHCO3溶液中:c(H2CO3)+c(HCO )+c(CO )=0.8mol/L C、a点溶液存在:c(Na+)+c(H+)=c(AlO )+c(OH-) D、水的电离程度:点a <点b12. 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )选项
实验
现象
结论
A
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为Fe3+
B
将铜粉加入1.0mol·L-1
Fe2(SO4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
C
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
D
将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1
CuSO4溶液
先有白色沉淀生成,后变为浅蓝色沉淀
Cu(OH)2的溶度积比
Mg(OH)2的小
A、A B、B C、C D、D二、综合题
-
13. 可用于制备铬颜料及铬盐,由铬铝矿渣(含57%的 , 其余为和)制备的工艺流程如图所示。回答下列问题:
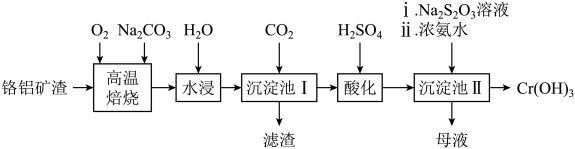
已知:①“高温焙烧”可以使矿渣转化为可溶性盐。
②酸性条件下,能稳定存在。
(1)、“高温焙烧”前需将铬铝矿渣进行球磨粉碎,目的是。(2)、“滤渣”的主要成分为(填化学式)。(3)、“酸化”时,含铬微粒发生反应的离子方程式为。(4)、“沉淀池II”中加入溶液的目的是。(5)、“母液”中溶质的主要成分除外,还有(填化学式)。(6)、某工厂用该铬铝矿渣制备 , 若铬的损耗率为20%,最终可以得到的质量为t。14. 镁及其化合物在现代工业、国防建设中有着广泛的应用。回答下列问题:(1)、单质镁在空气中燃烧的主要产物是白色的 , 还生成少量的(填化学式)。(2)、是一种重要的有机合成剂,其中镁的化合价为 , 水解时除生成甲烷外,还生成一种碱和一种盐。写出该反应的化学方程式:。(3)、现有一块合金,将其置于烧杯中。若加入溶液,恰好完全反应生成。若加入少量盐酸,则生成。计算。(4)、是常用的阻燃材料。以白云石( , 不考虑杂质)为原料制备和工艺流程如下:
①相同条件下,溶解度:(填“>”或“<”)。
②“煅烧”时称取白云石,高温加热到质量不再变化,收集到的为(标准状况下),若工艺中不考虑损失,则和的质量分别为、。
15.(1)、Ⅰ、铝土矿(主要成分为Al2O3 , 含有少量杂质)是提取铝的原料。提取铝的工艺流程如下: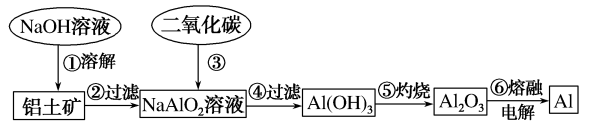
请用离子方程式表示以上工艺流程中第①步反应:。
(2)、写出以上工艺流程中第③步反应的化学方程式:。(3)、若第①步加入的是盐酸,则发生反应的离子方程式为。(4)、Ⅱ、下图为几种物质的转化关系,其中A为金属,B为淡黄色固体粉末,每一物质均含有A元素。
写出下列物质的化学式:
B , C , E , F。
(5)、写出下列各步反应的化学方程式:C→E;
F→C。
16. 酸性蚀刻液的主要成分是H2O2/HCl,腐蚀铜后的废液中主要含有CuCl2、HCl。一种以废铝屑为主要原料回收酸性蚀刻废液中的铜并生产AlCl3的工艺流程如下:
回答下列问题:
(1)、在实验室,“反应a”过程需远离火源,其原因是(用文字叙述)。(2)、“操作b”包括、过滤、洗涤,其中过滤需要用到的玻璃仪器有、烧杯。(3)、实验室可用食盐与浓硫酸在微热条件下反应制取HCl气体。①HCl气体的发生装置应选择装置(填字母,下同),用水吸收多余的HCl气体时,应该选择装置 , 其原因是。

②写出制备HCl反应的化学方程式: , 该反应利用了浓H2SO4的性质是(填“脱水性”“氧化性”或“难挥发性”)
(4)、“灼烧”时,若在无HCl的气氛中反应,最终是否生成给出判断并说明理由:。17. 硼砂的化学式为。利用硼镁矿(主要成分为)制取金属镁及粗硼的工艺流程为:
回答下列有关问题:
(1)、硼镁矿加入NaOH溶液后过滤得到的滤渣的主要成分为。(2)、硼砂中B的化合价为 , 溶于热水后,常用稀H2SO4调pH=2~3得到H3BO3 , 该反应的离子方程式为。(3)、需要在HCl氛围中加热,其目的是。(4)、Mg—H2O2酸性电池的反应机理为。则该电池的正极反应式为:;常温下,当电路中通过的电子的物质的量为0.08mol时,溶液的pH=6,此时(填“有”或“无”)Mg(OH)2沉淀析出。(已知①Ksp[Mg(OH)2]=5.6×10-12;②电解质溶液的体积为1L,忽略电解前后溶液体积的变化)(5)、制得的粗硼在一定条件下生成BI3 , BI3加热分解可以得到纯净的单质硼。现将0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol/LNa2S2O3(强碱弱酸盐)溶液滴定至终点,消耗Na2S2O3溶液16.00mL。盛装Na2S2O3溶液的仪器应为(填“酸式”或“碱式”)滴定管。该粗硼样品的纯度为(提示:)。18. 高纯氮化铝()是一种理想的半导体物质。一种以含铝废料(主要成分为 , 含有少量、、、)为原料制备的工艺流程如下:
回答下列问题:
(1)、“溶浸”过程中发生的基本反应类型为 , 滤渣1的主要成分是(填化学式)。(2)、写出“氧化”时生成的离子方程式:。(3)、常温下,“氧化”后溶液中 , 若“调”,是否有沉淀生成?{写出计算过程,已知常温下,}。(4)、“沉铝”时,加入试剂X的名称是。(5)、“操作”步骤包含。(6)、写出“高温灼烧”时反应的化学方程式:;该步骤反应后期需通入一定量的空气,其目的是(从提高纯度角度考虑)。19. 叶蛇纹石是一种富镁硅酸盐矿物[主要成分为Mg6(Si4O10)(OH)8 , 还含有Al2O3、Fe2O3、FeO等杂质],利用该矿物生产铁红(Fe2O3)和碱式碳酸镁的工艺流程如图所示:
回答下列问题:
(1)、“转化”步骤中,温度不能过高的原因是。(2)、“调pH”时,产生滤渣2的反应离子方程式为。(3)、X通常选用(填化学式)。(4)、“沉镁”步骤中氨水加入的量不能太多,否则MgCO3·H2O的产率会降低,其原因是。(5)、取9.1g碱式碳酸镁[xMgCO3·yMg(OH)2·zH2O],高温分解后,测得生成3.3gCO2、4.0gMgO,化学式中z=写出由MgCO3·H2O生成产品的化学方程式:。(6)、碱式碳酸镁常用作新型阻燃剂,试分析碱式碳酸镁能够阻燃的原因:。(写出一点即可)。20. 铝元素含量居金属首位, 主要存在于铝土矿(主要成分为Al2O3 , 还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。(1)、Ⅰ、工业上用铝土矿制备铝的某种化合物的工艺流程如下:
在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
Fe2++□ClO-+□═□Fe(OH)3↓+□Cl-+□_
②检验滤液B中是否还含有铁元素的方法为:
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、(填操作名称)、过滤、洗涤。
(2)、Ⅱ、明矾(KAl(SO4)2·12H2O)在日常生活、生产中也占有一席之地。明矾曾经是净水明星,用离子方程式表示其净水原理。
(3)、明矾净水时,若不慎过量会有一定程度的副作用。将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,并且过滤,就可以避免,请用离子反方程式描述其过程。21. 已知: Mg能在NO2中燃烧,可能产物为Mg3N2、MgO和N2。Mg3N2容易与水反应。(1)、某实验探究小组探究Mg与NO2反应的固体产物成分,对固体产物提出三种假设:I.假设为: 固体产物为MgO;II.假设为:;III.假设为: 。
(2)、该小组通过如下实验装置来验证Mg在NO2中燃烧反应产物(夹持装置省略,部分仪器可重复使用
①实验装置连接的顺序为(填字母序号);
②装置B中盛装的试剂可以是 (填字母)
a.浓硫酸 b.碱石灰 c.无水CaCl2 d.五氧化二磷
③确定产物中有N2生成的实验现象为。
(3)、设计实验证明: 产物中存在Mg3N2: 。(4)、已知装置C中初始加入Mg粉质量为13.2g,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0g,产生N2的体积为1120mL(标准状况)。写出玻璃管中发生反应的化学方程式:。22. 碱式硫酸铝溶液可用于烟气脱硫。室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为(2−x)Al2(SO4)3+3xCaCO3+3xH2O=2[(1−x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
生成物(1−x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。
(1)、制备碱式硫酸铝溶液时,维持反应温度和反应时间不变,提高x值的方法有。(2)、碱式硫酸铝溶液吸收SO2过程中,溶液的pH(填“增大”、“减小”、“不变”)。(3)、通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.1000 mol·L−1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L−1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1−x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。