从巩固到提高 高考化学二轮微专题12 钠、碱金属
试卷更新日期:2023-01-22 类型:二轮复习
一、单选题
-
1. 超氧化钾与性质相似,是广泛应用航天和潜水的供氧剂,我国研制的一种可连续制备超氧化钾的装置如图所示。下列说法正确的是( )
 A、通入氧气的流速需等于充入液态钾的流速 B、中K元素的化合价为价 C、当与反应时,只作氧化剂 D、当时,将和分别加入足量水生成之比为3∶22. 某化学小组用如图装置模拟呼吸面具中的有关反应,测定样品中的纯度。已知实验中样品的质量为8.0g,实验结束后共收集到1.12L(已折合为标准状况下)气体,下列说法错误的是( )
A、通入氧气的流速需等于充入液态钾的流速 B、中K元素的化合价为价 C、当与反应时,只作氧化剂 D、当时,将和分别加入足量水生成之比为3∶22. 某化学小组用如图装置模拟呼吸面具中的有关反应,测定样品中的纯度。已知实验中样品的质量为8.0g,实验结束后共收集到1.12L(已折合为标准状况下)气体,下列说法错误的是( ) A、装置Ⅰ中的稀盐酸不可用稀硫酸代替 B、装置Ⅰ中a的作用是保持上下压强一致,使液体顺利滴下 C、根据题中数据,可求得样品中的纯度一定为97.5% D、实验结束后,取少量装置Ⅲ中的固体并滴入稀盐酸,若产生能使澄清石灰水变浑浊的气体,说明装置Ⅲ中有盐类生成3. 下列方程式正确的是( )A、往硫酸亚铁铵溶液中加入少量NaOH溶液: B、与水的反应: C、碳酸钙与稀硝酸的反应: D、用溶液吸收少量:4. 下列生活应用或生产活动,没有运用相应化学知识的是( )
A、装置Ⅰ中的稀盐酸不可用稀硫酸代替 B、装置Ⅰ中a的作用是保持上下压强一致,使液体顺利滴下 C、根据题中数据,可求得样品中的纯度一定为97.5% D、实验结束后,取少量装置Ⅲ中的固体并滴入稀盐酸,若产生能使澄清石灰水变浑浊的气体,说明装置Ⅲ中有盐类生成3. 下列方程式正确的是( )A、往硫酸亚铁铵溶液中加入少量NaOH溶液: B、与水的反应: C、碳酸钙与稀硝酸的反应: D、用溶液吸收少量:4. 下列生活应用或生产活动,没有运用相应化学知识的是( )选项
生活应用或生产活动
化学知识
A
用二氧化碳跨临界直接制冰
液态二氧化碳汽化时吸热
B
用小苏打焙制糕点
受热易分解生成气体
C
用溶液蚀刻电路板上的铜
溶液呈酸性
D
丙三醇可用于配制化妆品
丙三醇与水形成氢键,有很强的保湿性
A、A B、B C、C D、D5. 某物质在水溶液中得到了如图所示的结构,虚线表示氢键,其中X、Y、Z和M是原子序数依次增大的短周期元素。下列说法错误的是( )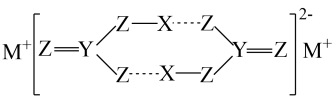 A、非金属性: Z>Y B、该结构中Z均满足8电子稳定结构 C、M的焰色试验呈黄色 D、氢键的存在使该物质在水中的溶解性较大6. 某固体混合物由Na2CO3和NaHCO3两种物质组成,将其分成X、Y两等份。标准状况下,X溶于足量盐酸,生成CO2的体积为V1L;Y充分加热、冷却后再溶于足量盐酸,生成CO2 , 的体积为V2L。下列说法正确的是( )A、加热,蒸干X与足量盐酸反应后的溶液,可得固体g B、Y充分加热,固体质量减少g C、X、Y消耗盐酸的物质的量之比为1:1 D、混合物中Na2CO3和NaHCO3的物质的量之比为7. 以NaCl为原料,可制取Na、Na2O2、NaOH和Na2CO3等。Na2CO3 , 可用侯氏制碱法制取,主要涉及如下反应:
A、非金属性: Z>Y B、该结构中Z均满足8电子稳定结构 C、M的焰色试验呈黄色 D、氢键的存在使该物质在水中的溶解性较大6. 某固体混合物由Na2CO3和NaHCO3两种物质组成,将其分成X、Y两等份。标准状况下,X溶于足量盐酸,生成CO2的体积为V1L;Y充分加热、冷却后再溶于足量盐酸,生成CO2 , 的体积为V2L。下列说法正确的是( )A、加热,蒸干X与足量盐酸反应后的溶液,可得固体g B、Y充分加热,固体质量减少g C、X、Y消耗盐酸的物质的量之比为1:1 D、混合物中Na2CO3和NaHCO3的物质的量之比为7. 以NaCl为原料,可制取Na、Na2O2、NaOH和Na2CO3等。Na2CO3 , 可用侯氏制碱法制取,主要涉及如下反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+CO2↑+H2O
在指定条件下,下列选项所示的物质间转化不能实现的是( )
A、Na(s) Na2O2(s) B、Na2O2(s) Na2CO3(s) C、NaCl(aq) Cl2(g) D、NaOH(aq) Al(OH)3(s)8. 下列“类比”或“对比”不合理的是( )A、Mg在CO2中点燃反应生成MgO和C,则Ca在CO2中点燃反应生成CaO和C B、NaClO溶液与CO2反应生成NaHCO3和HClO,而Ca(ClO)2溶液与少量CO2反应生成CaCO3和HClO C、Na3N与盐酸反应生成NaCl和NH4Cl,则Mg3N2与盐酸反应生成MgCl2和NH4Cl D、NaOH溶液与少量AgNO3溶液反应生成Ag2O和NaNO3 , 则氨水与少量AgNO3溶液反应最终生成Ag2O和NH4NO39. 下列各组物质混合,滴加顺序不同时,发生不同化学反应的是( )A、NaHCO3溶液和NaOH溶液 B、NaHCO3溶液与HCl溶液 C、NaOH溶液和AlCl3溶液 D、氨水与KAl(SO4)2溶液10. 下列类比结果不正确的是( )A、NH3的分子构型为三角锥形,则PCl3的分子构型为三角锥形 B、Na2O2与CO2反应生成Na2CO3和O2 , 则Na2O2与SO3反应生成Na2SO4和O2 C、NaClO会歧化为NaClO3和NaCl,则Na2SO3会歧化为Na2SO4和Na2S D、乙酸不能使酸性KMnO4褪色,则乙二酸也不能使酸性KMnO4褪色11. 用流程图示的方法可以清楚反映物质之间的转化关系。如: → → → ,则在常温下,上述转化关系
→ → ,则在常温下,上述转化关系  内的物质是( ) A、 B、 C、 D、NaHCO312. 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
内的物质是( ) A、 B、 C、 D、NaHCO312. 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( ) A、a点对应的溶液中:Na+、OH-、SO 、NO B、b点对应的溶液中:K+、Ca2+、AlO 、Cl- C、c点对应的溶液中:Na+、Ca2+、NO 、Cl- D、d点对应的溶液中:F-、NO 、Fe2+、Ag+13. 下列对于Na2O、Na2O2的比较正确的一项是( )A、Na2O2、Na2O都是钠的氧化物,都是碱性氧化物 B、Na2O、Na2O2都是易溶于水(与水反应)的白色固体 C、Na2O2在和CO2的反应中既是氧化剂又是还原剂 D、Na2O2与水反应时,1 mol Na2O2转移2 mol电子14. 下列各组物质相互混合反应,既有气体生成最终又有沉淀生成的是( )
A、a点对应的溶液中:Na+、OH-、SO 、NO B、b点对应的溶液中:K+、Ca2+、AlO 、Cl- C、c点对应的溶液中:Na+、Ca2+、NO 、Cl- D、d点对应的溶液中:F-、NO 、Fe2+、Ag+13. 下列对于Na2O、Na2O2的比较正确的一项是( )A、Na2O2、Na2O都是钠的氧化物,都是碱性氧化物 B、Na2O、Na2O2都是易溶于水(与水反应)的白色固体 C、Na2O2在和CO2的反应中既是氧化剂又是还原剂 D、Na2O2与水反应时,1 mol Na2O2转移2 mol电子14. 下列各组物质相互混合反应,既有气体生成最终又有沉淀生成的是( )①金属钠投入MgCl2溶液中
②过量的NaOH溶液和FeCl3溶液
③过量的Na2O2投入FeCl2溶液中
④过量NaOH和Ca(HCO3)2溶液混合
A、①④ B、②③ C、①③ D、③④15. 向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体,再向所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl的物质的量关系如图所示(忽略CO2的溶解和HCl的挥发),则下列分析正确的是( ) A、I图对应溶液中溶质为Na2CO3 B、II图对应溶液中溶质为NaHCO3 C、III图对应溶液中溶质为Na2CO3和NaHCO3 , 且n(Na2CO3):n(NaHCO3)=1:1 D、IV图对应溶液中溶质为NaOH和Na2CO3 , 且n(NaOH):n(Na2CO3)=2:116. 下列关于钠及其化合物的说法中正确的是( )A、钠着火后可用泡沫灭火器灭火 B、相同条件下NaHCO3的碱性强于Na2CO3 C、少量的钠可以保存在煤油中 D、把一块金属Na投入NH4Cl溶液中,有无色无味的气体逸出17. 下列物质的用途与其性质对应关系正确的是( )A、Al(OH)3能与酸反应,在医药上用作胃酸中和剂 B、Na、K均是活泼金属,可作原子反应堆的导热剂 C、 能与酸反应,可用于脱除纸浆中多余的Cl2 D、金刚石是最稳定的物质之一,可用作切割玻璃18. 由下列实验操作及现象能得出相应结论的是( )
A、I图对应溶液中溶质为Na2CO3 B、II图对应溶液中溶质为NaHCO3 C、III图对应溶液中溶质为Na2CO3和NaHCO3 , 且n(Na2CO3):n(NaHCO3)=1:1 D、IV图对应溶液中溶质为NaOH和Na2CO3 , 且n(NaOH):n(Na2CO3)=2:116. 下列关于钠及其化合物的说法中正确的是( )A、钠着火后可用泡沫灭火器灭火 B、相同条件下NaHCO3的碱性强于Na2CO3 C、少量的钠可以保存在煤油中 D、把一块金属Na投入NH4Cl溶液中,有无色无味的气体逸出17. 下列物质的用途与其性质对应关系正确的是( )A、Al(OH)3能与酸反应,在医药上用作胃酸中和剂 B、Na、K均是活泼金属,可作原子反应堆的导热剂 C、 能与酸反应,可用于脱除纸浆中多余的Cl2 D、金刚石是最稳定的物质之一,可用作切割玻璃18. 由下列实验操作及现象能得出相应结论的是( )实验操作
现象
结论
A
向KBr、KI混合溶液中依次加入少量氯水和CCl4 , 振荡,静置
溶液分层,下层呈紫红色
氧化性:
B
在火焰上灼烧搅拌过某无色溶液的玻璃棒
火焰出现黄色
溶液中含Na元素
C
用pH计测定pH:①NaHCO3溶液②CH3COONa溶液
pH:①>②
H2CO3酸性弱于CH3COOH
D
把水滴入盛有少量Na2O2的试管中,立即把带火星木条放在试管口
木条复燃
反应生成了O2
A、A B、B C、C D、D19. Li电池使用过程中会产生LiH,对电池的性能和安全性带来影响。可用D2O与LiH进行反应测定LiH含量,由产物中的n(D2)/n(HD)比例可推算n(Li)/n(LiH)。已知:①2LiH⇌2Li+H2 △H>0
②LiH+H2O=LiOH+H2↑
下列说法错误的是( )
A、H2O、D2O的化学性质基本相同 B、Li与D2O反应的方程式是2Li+2D2O=2LiOD+D2↑ C、n(D2)/n(HD)比例小说明n(Li)/n(LiH)比例大 D、80℃下的n(D2)/n(HD)大于25℃下的n(D2)/n(HD)二、实验探究题
-
20. 某化学兴趣小组在实验室通过如下图所示装置制备 。

回答下列问题:
(1)、装置a中盛装浓 的仪器名称是。(2)、装置b的作用是。(3)、实验结束后,装置d中的溶质有NaOH、 ,还可能有(填化学式)。(4)、装置c中反应的化学方程式为。(5)、实验结束后,装置c的溶液中溶质主要是 ,还含有 、 等成分。为了证明 的存在,设计如下实验。供选试剂:A.品红溶液:B.酸性高锰酸钾溶液;C. 溶液;D.澄清石灰水;E.稀硫酸
①取c中溶液少许,滴加足量(填试剂标号)
②将①产生的气体依次通过(填试剂标号),实验现象和结论为。
三、推断题
-
21. 固体化合物X由3种短周期元素组成,某学习小组开展如下探究实验。
 已知:非金属氧化物A的相对分子质量为44;气体C能使湿润的红色石蕊试纸变蓝色;气体G是空气中含量最多的单质。请问答:(1)、组成D的非金属元素是(填元素符号),写出C的电子式。(2)、步骤Ⅱ,发生反应的化学方程式是。(3)、工业上制备X是将金属单质与液态C反应得到,写出该反应的化学方程式为。(4)、某同学将擦亮的单质F投入装有足量浓硫酸的大试管中,微热,有黑色和白色的固体析出,但无气体产生(已知,黑色固体由2种元素组成,金属元素质量分数为80%,难溶于水和稀硫酸,可溶于硝酸)。请设计实验验证黑色固体的组成元素。
已知:非金属氧化物A的相对分子质量为44;气体C能使湿润的红色石蕊试纸变蓝色;气体G是空气中含量最多的单质。请问答:(1)、组成D的非金属元素是(填元素符号),写出C的电子式。(2)、步骤Ⅱ,发生反应的化学方程式是。(3)、工业上制备X是将金属单质与液态C反应得到,写出该反应的化学方程式为。(4)、某同学将擦亮的单质F投入装有足量浓硫酸的大试管中,微热,有黑色和白色的固体析出,但无气体产生(已知,黑色固体由2种元素组成,金属元素质量分数为80%,难溶于水和稀硫酸,可溶于硝酸)。请设计实验验证黑色固体的组成元素。四、综合题
-
22. 氢、钠、铝等元素是中学化学中常见的元素,其单质或化合物在生活和生产中有多种用途。回答下列问题:(1)、是一种重要的供氧剂,其与水反应的化学方程式为。(2)、下列有关的叙述正确的是(填字母)。
a.常用于自来水杀菌消毒
b.久置于空气中,最终变为
c.与反应是置换反应
d.投入到溶液中,将会有红褐色沉淀生成
(3)、金属钠投入溶液中的现象是。(4)、铝氢化钠(NaAlH4)是有机合成的重要还原剂。它的制备方法是将氢化钠和氯化铝在乙醚中反应制备铝氢化钠。①中H元素的化合价为。
②写出制备铝氢化钠的化学方程式:。
③铝氢化钠遇水反应能生成氢气,其反应的化学方程式为。
④在化学上,含氢还原剂的还原能力用“有效氢”表示,“有效氢”含义是单位质量的含氢还原剂的还原能力相当于多少克氢气。的“有效氢”之比为。
23. 现有一定量含有Na2O杂质的Na2O2试样,用如图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、稀盐酸、稀硫酸和蒸馏水)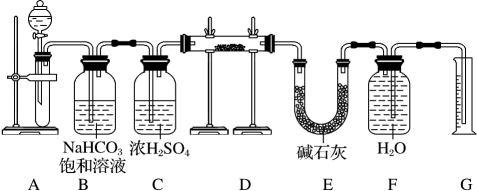
回答下列问题:
(1)、装置A中液体试剂选用稀盐酸而不选用稀硫酸,理由是。(2)、装置C的作用是 , 装置E中碱石灰的作用是。(3)、装置D中发生反应的化学方程式是。(4)、若开始时测得样品的质量为2.0g,反应结束后测得气体体积为250mL,该条件下此气体密度为0.00128g/mL。则Na2O2试样的纯度为。(5)、现有7.8Na2O2 , 试计算完全与CO2反应转移的电子数目。24. 锂电池是目前应用广泛的新型电池,一种回收钴酸锂废旧电池(主要成分为LiCoO2 , 同时含有少量Fe、Al、C单质)的流程如下图所示。
请回答下列问题:
(1)、LiCoO2中Co元素的化合价为。(2)、请写出“碱浸”过程中所发生反应的化学方程式。(3)、加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+。请写出该反应的离子方程式: , 过滤后所得滤渣的主要成分为(写化学式)。(4)、已知Fe3+能与C2O结合成[Fe(C2O4)3]3- , [Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+ , 该过程中(填“有”或“没有”)发生元素化合价的变化;从FeCl3溶液中得到FeCl3·6H2O晶体的操作是:往溶液中加入适量盐酸后,蒸发浓缩、冷却结晶、、洗涤、干燥。(5)、已知Ksp(Li2CO3)=8×10-4 , 滤液B中c(Li+)=0.2mol/L。要生成Li2CO3沉淀,则加入的等体积的Na2CO3溶液中,c(CO)不低于mol/L(忽略溶液混合引起的体积变化),检验滤液中含有Na+的实验方法为。
-
-