从巩固到提高 高考化学二轮微专题10 氧族元素
试卷更新日期:2023-01-21 类型:二轮复习
一、单选题
-
1. 下列说法正确的是( )A、H2、D2、T2互为同素异形体 B、晶体硅、无定形硅互为同位素 C、核糖和脱氧核糖互为同系物 D、果糖和葡萄糖互为同分异构体2. 由下列实验操作及现象能得出相应结论的是( )
选项
实验操作
现象
结论
A
把水滴入盛有少量的试管中,立即把带火星的木条放在试管口
木条复燃
水中的氧元素被氧化
B
将6mL溶液和10mLKI溶液混合,充分反应后分成两等份,向其中一份中加入2滴KSCN溶液,另一份中加入2滴淀粉溶液
加KSCN溶液后溶液显红色;加淀粉溶液后溶液显蓝色
和KI的反应是可逆反应
C
用玻璃棒蘸取某无色溶液在火焰上灼烧
火焰出现黄色
溶液中含钠元素
D
将通入盛有酚酞的NaOH溶液中
溶液红色褪去
具有漂白性
A、A B、B C、C D、D3. 下列关于硫的化合物的说法正确的是( )A、在燃煤中加入石灰石可减少排放,发生的反应: B、把通入酸性高锰酸钾溶液中可验证的漂白性 C、浓硫酸能使纸张变黑,这是因为纸张中的纤维素是碳水化合物,浓硫酸吸收了其中的水分,体现了吸水性 D、具有较强的还原性,浓硫酸有强氧化性,所以不能用浓硫酸干燥4. 化学与生产、生活、科技和环境等密切相关。下列有关说法错误的是( )A、侯氏制碱过程中应向饱和食盐水中先通NH3 , 后通CO2 B、84消毒液与洁厕灵不能混用,若混用能产生有毒气体 C、卫星探测器上的太阳能电池帆板主要成分是晶体硅 D、“汽车尾气处理”有助于改善城市空气质量,有利于实现“碳达峰、碳中和”5. 下列实验装置能达到相应实验目的的是( ) A、装置甲稀释浓硫酸 B、装置乙制备并检验SO2气体的性质 C、装置丙检查装置的气密性 D、装置丁收集NO6. 实验室探究与溶液反应的原理,装置如图,实验中Y装置产生白色沉淀。下列说法错误的是( )
A、装置甲稀释浓硫酸 B、装置乙制备并检验SO2气体的性质 C、装置丙检查装置的气密性 D、装置丁收集NO6. 实验室探究与溶液反应的原理,装置如图,实验中Y装置产生白色沉淀。下列说法错误的是( ) A、滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间 B、Y中产生的白色沉淀是 C、在X装置中浓硫酸不体现氧化性 D、若将换成氨水,Y中不能产生白色沉淀7. Na2SO4和焦炭可发生化学反应,某兴趣小组对该反应及其产物进行如图所示实验探究。下列说法错误的是( )
A、滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间 B、Y中产生的白色沉淀是 C、在X装置中浓硫酸不体现氧化性 D、若将换成氨水,Y中不能产生白色沉淀7. Na2SO4和焦炭可发生化学反应,某兴趣小组对该反应及其产物进行如图所示实验探究。下列说法错误的是( ) A、c装置的主要作用是防倒吸 B、实验时,应先通入N2再加热 C、实验后a装置中固体可能会与稀硫酸反应产生淡黄色固体 D、b处连接的装置中依次盛放澄清石灰水、品红溶液、NaOH溶液8. 周期表中VIA族元素及其化合物应用广泛。用硫磺熏蒸中药材的传统由来已久;是一种易燃的有毒气体(燃烧热为),可制取各种硫化物:硫酸、硫酸盐是重要化工原料;硫酰氯()是重要的化工试剂,常作氯化剂或氯磺化剂。硒()和碲()的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含)为原料回收 , 以电解强碱性 , 溶液制备。下列物质性质与用途具有对应关系的是( )A、S的沸点低,可用于杀菌消毒 B、有氧化性,可用于漂白纸张 C、浓硫酸具有强酸性,可用于制备气体 D、不溶于盐酸且不被X射线透过,可用作钡餐9. 实验室以铜和浓硫酸为原料,按照制备、检验所有气体产物及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是( )
A、c装置的主要作用是防倒吸 B、实验时,应先通入N2再加热 C、实验后a装置中固体可能会与稀硫酸反应产生淡黄色固体 D、b处连接的装置中依次盛放澄清石灰水、品红溶液、NaOH溶液8. 周期表中VIA族元素及其化合物应用广泛。用硫磺熏蒸中药材的传统由来已久;是一种易燃的有毒气体(燃烧热为),可制取各种硫化物:硫酸、硫酸盐是重要化工原料;硫酰氯()是重要的化工试剂,常作氯化剂或氯磺化剂。硒()和碲()的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含)为原料回收 , 以电解强碱性 , 溶液制备。下列物质性质与用途具有对应关系的是( )A、S的沸点低,可用于杀菌消毒 B、有氧化性,可用于漂白纸张 C、浓硫酸具有强酸性,可用于制备气体 D、不溶于盐酸且不被X射线透过,可用作钡餐9. 实验室以铜和浓硫酸为原料,按照制备、检验所有气体产物及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是( )装置




选项
A
B
C
D
A、A B、B C、C D、D10. 化学与生产、生活、环境等密切相关。下列说法正确的是( )A、医用双氧水和酒精均可用于伤口清洗,两者消毒原理相同 B、燃煤中加入生石灰可以减少酸雨的形成及温室气体的排放 C、被称为“黑金”的新型纳米材料石墨烯属于有机化合物 D、中国天眼使用的防腐蚀材料磷酸钡属于强电解质11. 下图为碳与浓硫酸反应产物的探究实验,下列分析正确的是( ) A、碳与浓硫酸的反应体现了浓硫酸的酸性、强氧化性、脱水性 B、Ⅰ、Ⅱ中溶液褪色体现了的还原性 C、Ⅲ中溶液会产生白色沉淀 D、浓硫酸氧化性强,不可干燥还原性气体12. 劳动开创未来,下列劳动项目与所述化学知识没有关联的是( )
A、碳与浓硫酸的反应体现了浓硫酸的酸性、强氧化性、脱水性 B、Ⅰ、Ⅱ中溶液褪色体现了的还原性 C、Ⅲ中溶液会产生白色沉淀 D、浓硫酸氧化性强,不可干燥还原性气体12. 劳动开创未来,下列劳动项目与所述化学知识没有关联的是( )选项
劳动项目
化学知识
A
用二氧化硫漂白草帽
二氧化硫具有漂白性
B
把石灰浆喷涂在树皮上,消灭过冬虫卵
碱性环境使虫卵蛋白质变性而死亡
C
用热的纯碱溶液洗涤餐具
纯碱能使油脂硬化
D
用白醋去除铁栏杆上的锈迹
乙酸可与铁锈反应
A、A B、B C、C D、D13. 向盛有溶液的试管中通入过量 , 立即产生白色沉淀;放置一段时间后,白色沉淀变为灰色。对两种沉淀进行检验,可以确定白色沉淀含 , 灰色沉淀中含有。下列说法正确的是( )A、生成白色沉淀时体现了还原性 B、可以用盐酸确定白色沉淀一定为 C、该实验条件下,的还原性强于 D、白色沉淀变为灰色的离子方程式为14. 下列有关实验操作、现象和结论正确的是( )选项
实 验 操 作
实 验 现 象
实 验 结 论
A
把SO2和气体X一起通入到BaCl2溶液中
有白色沉淀产生
X气体具有强氧化性
B
向某溶液中加入稀盐酸酸化,再加入BaCl2溶液
加入BaCl2溶液后有白色沉淀生成
该溶液中存在
C
用洁净的铂丝蘸取某溶液进行焰色试验
焰色呈黄色
该溶液为钠盐溶液
D
向KMnO4溶液中通SO2
溶液褪色
SO2具有漂白性
A、A B、B C、C D、D15. 压缩天然气汽车以天然气代替汽车用油,具有价格低、污染少、安全等优点。未经处理的天然气含有H2S,直接使用会造成大气污染,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是( )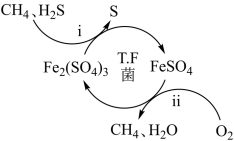 A、Fe2(SO4)3可以视为该脱硫过程中的催化剂 B、该脱硫过程的总反应为:2H2S+O2=2S↓+2H2O C、该脱硫过程不能在高温下进行 D、该脱硫过程是将H2S转化为FeSO416. 《物理小识·金石类》提到:“青矾厂气熏人,衣服当之易烂,栽木不茂,惟乌柏树不畏其气”。强热“青矾”得红色固体,“青矾厂气”,气体冷凝得“矾油”。利用矾油可以制备盐酸,涉及微型化工流程如图所示:
A、Fe2(SO4)3可以视为该脱硫过程中的催化剂 B、该脱硫过程的总反应为:2H2S+O2=2S↓+2H2O C、该脱硫过程不能在高温下进行 D、该脱硫过程是将H2S转化为FeSO416. 《物理小识·金石类》提到:“青矾厂气熏人,衣服当之易烂,栽木不茂,惟乌柏树不畏其气”。强热“青矾”得红色固体,“青矾厂气”,气体冷凝得“矾油”。利用矾油可以制备盐酸,涉及微型化工流程如图所示:
下列说法正确的是( )
A、X是 , 可用作红色颜料 B、气体W不能使品红溶液褪色 C、矾油的沸点高于 D、上述流程中只涉及氧化还原反应二、实验探究题
-
17. 某学生对的还原性进行实验探究,回答下列问题:
实验一:与漂白粉(已在空气中露置了一小段时间)反应的实验探究
步骤①:取4g漂白粉固体,加入100mL水,固体有少量不溶解,溶液略有颜色,过滤,pH计测得漂白粉溶液的pH约为12。
步骤②:将持续通入漂白粉溶液中,液面上方出现白雾,稍后出现浑浊,溶液变为黄绿色,最后产生大量白色沉淀,黄绿色褪去。
(1)、写出由和制取漂白粉的化学方程式:。(2)、若向水中持续通入 , 未观察到白雾。推测步骤②中的白雾是由HCl小液滴形成的,进行如下实验:a.用湿润的淀粉碘化钾试纸检验白雾,无变化;
b.用硝酸酸化的溶液检验白雾,产生白色沉淀A。
实验a的目的是;白色沉淀A为(填化学式)。
(3)、步骤②中溶液变为黄绿色的可能原因是随着溶液酸性的增强,漂白粉的有效成分和发生反应,该反应的离子方程式为。(4)、向步骤①中过滤后得到的固体中加入稀盐酸,可能观察到的实验现象为。(5)、实验二:与溶液反应的实验探究
实验步骤:将一定量的通入溶液中,有白色沉淀生成。
经分析,与溶液反应可能有两种情况:
c.若通入少量 , 则反应为
d.若通入过量 , 则反应为
为了探究发生了哪一种情况,取上述反应后过滤所得的溶液,分别装入A、B、C、D四支试管中,进行如下实验:

试管A中有气体生成,则该气体可能为(填化学式)。(6)、下列实验现象能说明发生的是情况c的是(填标号,下同),能说明发生了情况d的是。A.试管Ⅰ中有气体生成 B.试管Ⅱ中溶液颜色发生了变化
C.试管Ⅲ中有气体生成 D.试管Ⅳ中有白色沉淀生成
18. 二氧化硫是中学化学的重要物质。某化学兴趣小组设计如图实验探究SO2的性质。 (1)、仪器b的名称是 , 已知b中放入的是纯铜片,写出装置A中的化学方程式。(2)、同学甲认为该套装置存在一个明显缺陷,其理由是。(3)、关于该探究实验,下列说法错误的是。
(1)、仪器b的名称是 , 已知b中放入的是纯铜片,写出装置A中的化学方程式。(2)、同学甲认为该套装置存在一个明显缺陷,其理由是。(3)、关于该探究实验,下列说法错误的是。①装置A中,橡皮管a的作用是使分液漏斗中的液体能顺利流下
②装置B中,紫色溶液变红,证明二氧化硫是酸性氧化物
③装置C中,品红溶液褪色;证明二氧化硫具有漂白性
④装置D中溶液变浑浊,生成了硫单质,证明SO2具有还原性
(4)、装置E中溶液褪色,发生的反应离子方程式是。(5)、实验过程中,同学乙观察到E中溶液在完全褪色后开始逐渐变浑浊。查阅资料后得知,在催化剂的作用下,SO2在水中会发生歧化反应。于是又设计以下实验进行探究(实验中溶液的体积及溶质的物质的量浓度均相同)。【实验装置】

【实验现象】一段时间后,F、H中无明显现象,I中比G中的溶液先变浑浊。
【实验结论】在水中,SO2歧化的离子方程式为。该反应中的催化剂是 (填写序号)。
①H⁺ ②I⁻ ③H⁺、I⁻ ④K⁺、H⁺ ⑤K⁺、I⁻
19. 我国早期科技丛书《物理小识·金石类》记载:“青矾厂气熏人,衣服当之易烂,载木不盛”“青矾强热,得赤色固体,气凝即得矾油”。“青矾”是指FeSO4•7H2O,“青矾厂气”是指SO2和SO3 , “矾油”是指H2SO4。某实验小组利用如图装置模拟古法制硫酸并进行SO2性质探究。
已知:SO2熔点-75.5℃,沸点-10℃;SO3熔点16.8℃,沸点44.8℃。
请回答下列问题:
(1)、I.制取硫酸实验开始前打开活塞K1、K2 , 关闭活塞K3 , 通入一段时间N2后,关闭活塞K1、K2 , 打开活塞K3 , 用酒精喷灯高温加热绿矾。
A装置中发生反应的化学方程式为。
(2)、B装置的作用是。(3)、该装置存在的不足之处为。(4)、II.探究SO2的性质在装置中先后四次加入同浓度同体积不同情况的钡盐溶液,控制食用油油层厚度一致、通入SO2流速一致。四次实验分别得到如表pH-t图:
①
②
③
④
已煮沸的BaCl2(aq)
未煮沸的BaCl2(aq)
已煮沸的Ba(NO3)2(aq)
未煮沸的Ba(NO3)2(aq)




C装置中覆盖食用油的目的是。
(5)、pH-t图中,②的曲线出现骤降,这是因为(用化学方程式表示);对比分析上述四组数据,可得出的结论是、。(任写两条)(6)、SO2属于大气污染物,可用H2与其高温反应消除SO2带来的污染,其反应原理如图所示:
①X为(填化学式)。
②实验室检验X所需试剂及实验现象。
20. 亚硝基硫酸()是染料工艺中重要的原料。回答下列问题:(1)、Ⅰ.实验室将通入浓硝酸和浓硫酸的混酸中可制备亚硝基硫酸,装置如图。C中主要发生反应:;。
装置A中发生反应的化学方程式为。
(2)、装置D的主要作用是吸收尾气 , 防止其污染环境,反应的离子方程式为 , 装置D中倒置的漏斗所起的作用是。(3)、Ⅱ.产品中亚硝基硫酸的纯度的测定称取1.700 g产品放入250 mL的锥形瓶中,加入100.00 mL溶液和少量稀硫酸,发生反应: , 产品中其他杂质不与反应。反应完全后,用 标准溶液滴定过量的,发生反应: , 消耗标准溶液30.00 mL。
配制100 mL 溶液所需要的玻璃仪器有量筒、烧杯、玻璃棒、。
(4)、滴定到终点时的实验现象是。(5)、产品中亚硝基硫酸的纯度为%(保留1位小数)。