从巩固到提高 高考化学二轮微专题05 氯碱工业
试卷更新日期:2023-01-21 类型:二轮复习
一、单选题
-
1. 一种清洁、低成本的三步法氯碱工艺工作原理的示意图如图。下列说法错误的是( )
 A、与传统氯碱工艺相比,该方法可避免使用离子交换膜 B、第一步中阳极反应为:Na0.44MnO2-xe-=Na0.44-xMnO2+xNa+ C、第二步中,放电结束后,电解质溶液中NaCl的含量增大 D、理论上,每消耗1mol O2 , 可生产4mol NaOH和2mol Cl22. 海水中不仅含有丰富的水资源,而且蕴藏着宝贵的化学资源。海水资源利用的部分过程如图,下列有关说法错误的是( )
A、与传统氯碱工艺相比,该方法可避免使用离子交换膜 B、第一步中阳极反应为:Na0.44MnO2-xe-=Na0.44-xMnO2+xNa+ C、第二步中,放电结束后,电解质溶液中NaCl的含量增大 D、理论上,每消耗1mol O2 , 可生产4mol NaOH和2mol Cl22. 海水中不仅含有丰富的水资源,而且蕴藏着宝贵的化学资源。海水资源利用的部分过程如图,下列有关说法错误的是( ) A、海水淡化的方法主要有蒸馏法、电渗析法和离子交换法等 B、在氯碱工业中,电解饱和食盐水可得到氢气、氯气和烧碱 C、在制镁工业中,由步骤②得到镁的反应中,另一产物可用于步骤③⑤中作氧化剂 D、在制溴工业中,步骤③④⑤分别为浓缩、氧化、提取3. 以电解食盐水为基础的“氯碱工业”是目前化学工业的重要支柱之一,原理如图所示。下列说法错误的是( )
A、海水淡化的方法主要有蒸馏法、电渗析法和离子交换法等 B、在氯碱工业中,电解饱和食盐水可得到氢气、氯气和烧碱 C、在制镁工业中,由步骤②得到镁的反应中,另一产物可用于步骤③⑤中作氧化剂 D、在制溴工业中,步骤③④⑤分别为浓缩、氧化、提取3. 以电解食盐水为基础的“氯碱工业”是目前化学工业的重要支柱之一,原理如图所示。下列说法错误的是( ) A、不可以使用阴离子交换膜,否则产品会有损失 B、阴极区消耗的是水,但进料为稀NaOH溶液,目的是增强导电性 C、阴极的电极反应式为2H++2e-=H2↑或2H2O+2e-=H2↑+2OH- D、两极实际收集到的气体体积相等4. 工业上仅以食盐和水为原料,不能得到的产品是( )A、烧碱 B、NaClO溶液 C、盐酸 D、氮肥NH4Cl5. 下列不属于烧碱工业用途的是( )A、制皂 B、造纸 C、精炼石油 D、制食盐6. 化学工业在经济发展中的作用举足轻重,下列有关工业生产的叙述中正确的是 ( )A、氯碱工业中阳极得到氢氧化钠和氢气 B、电镀铜时,电镀液中c(Cu2+)基本保持不变 C、工业上用电解熔融态氧化镁的方法得到金属镁 D、海水中含有钾元素,只需经过物理变化就可以得到钾单质
A、不可以使用阴离子交换膜,否则产品会有损失 B、阴极区消耗的是水,但进料为稀NaOH溶液,目的是增强导电性 C、阴极的电极反应式为2H++2e-=H2↑或2H2O+2e-=H2↑+2OH- D、两极实际收集到的气体体积相等4. 工业上仅以食盐和水为原料,不能得到的产品是( )A、烧碱 B、NaClO溶液 C、盐酸 D、氮肥NH4Cl5. 下列不属于烧碱工业用途的是( )A、制皂 B、造纸 C、精炼石油 D、制食盐6. 化学工业在经济发展中的作用举足轻重,下列有关工业生产的叙述中正确的是 ( )A、氯碱工业中阳极得到氢氧化钠和氢气 B、电镀铜时,电镀液中c(Cu2+)基本保持不变 C、工业上用电解熔融态氧化镁的方法得到金属镁 D、海水中含有钾元素,只需经过物理变化就可以得到钾单质二、实验探究题
-
7. “84”消毒液是一种常用家庭消毒液,某小组同学对“84”消毒液的制备、保存及消毒能力进行如下探究。(1)、利用下图装置制备“84”消毒液。

①盛放浓盐酸的仪器名称为 , 该仪器使用前应先进行的操作为。
②装置甲中制备氯气的离子方程式为。
③装置乙中盛放的药品为 , 若无此装置造成的后果为。
(2)、“84”消毒液需要在阴暗处密封保存,否则容易失效,用化学用语解释其原因:①NaClO+H2O+CO2=NaHCO3+HClO;
②。
(3)、某兴趣小组通过实验测定不同pH环境中不同浓度NaClO溶液的细菌杀灭率(%),实验结果如下表。NaClO溶液浓度(mg/L)
不同pH下的细菌杀灭率(%)
pH=4.0
pH=6.5
pH=9.0
250
98.90
77.90
53.90
①NaClO溶液呈碱性的原因为(用离子方程式表示)。
②调节NaClO溶液pH时不能选用清厕灵(含HCl)的原因为。
③结合表中数据可推断,相同条件下,HClO的杀菌能力 (填“强于”“弱于”或“相当于”)NaClO的杀菌能力。
三、综合题
-
8. 氯碱工业是化工产业的重要基础,其装置示意图如图。生产过程中产生的氯酸盐副产物需要处理。
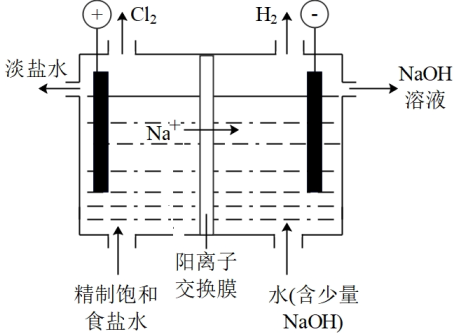
已知:pH升高时,易歧化为和。
(1)、电解饱和食盐水的离子方程式为。(2)、下列关于产生的说法中,合理的是(填序号)。a.主要在阴极室产生
b.在电极上放电,可能产生
c.阳离子交换膜破损导致向阳极室迁移,可能产生
(3)、测定副产物含量的方法如下图。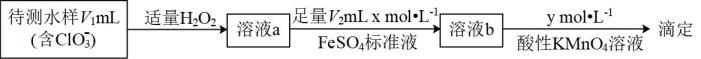
①加入的目的是消耗水样中残留的和。若测定中未加入 , 则测得的水样中的浓度将(填“偏大”“偏小”或“不受影响”)。
②滴定至终点时消耗酸性溶液,水样中的计算式为。
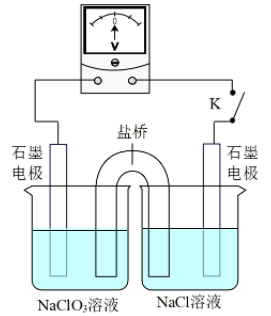
(4)、可用盐酸处理淡盐水中的并回收。①反应的离子方程式为。
②处理时,盐酸可能的作用是:
i.提高 , 使氧化性提高或还原性提高;
ii.提高 , 。
③用如图装置验证i,请补全操作和现象:闭合K,至指针读数稳定后,。
 9. “氯碱工业”以电解饱和食盐水为基础制取氯气等产品, 氯气是实验室和工业上的常用气体。请回答:(1)、电解饱和食盐水制取氯气的化学方程式是。(2)、下列说法错误的是______。A、可采用碱石灰干燥氯气 B、可通过排饱和食盐水法收集氯气 C、常温下,可通过加压使氯气液化而储存于钢瓶中 D、工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸(3)、在一定温度下,氯气溶于水的过程及其平衡常数为:
9. “氯碱工业”以电解饱和食盐水为基础制取氯气等产品, 氯气是实验室和工业上的常用气体。请回答:(1)、电解饱和食盐水制取氯气的化学方程式是。(2)、下列说法错误的是______。A、可采用碱石灰干燥氯气 B、可通过排饱和食盐水法收集氯气 C、常温下,可通过加压使氯气液化而储存于钢瓶中 D、工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸(3)、在一定温度下,氯气溶于水的过程及其平衡常数为:Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl2(aq) + H2O(l)⇌H+ (aq)+Cl- (aq) + HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH10。(填”>”、“=”或“<”)
②平衡常数K2的表达式为K2=。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
(4)、工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4 , 相应的化学方程式为;I.TiO2(s)+2Cl2(g)⇌TiCl4(g)+O2(g) ΔHI=181 mol·L-1 , KI=-3.4×10-29
II.2C(s)+O2(g)⇌2CO(g) ΔHII= - 221 mol·L-1 , KII=1.2×1048
结合数据说明氯化过程中加碳的理由 。
(5)、在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5 mol·L-1 , 反应30 min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是______。A、适当提高反应温度 B、改变催化剂 C、适当降低反应温度 D、改变反应物浓度10. 海水是巨大的化学资源宝库,利用海水可以直接或间接获取很多物质。(1)、利用1:氯碱工业从海水中提取粗盐的方法是。
(2)、图1是氯碱工业中电解饱和氯化钠溶液的示意图,饱和氯化钠溶液从a口进入,NaOH溶液从(填b或d)口导出。阳离子交换膜的作用是。(3)、图2是电解氯化钠溶液的微观示意图。X为电源的极,水合钠离子、水合氯离子吸引水分子的氢原子朝向不同的原因。 (4)、 利用2:提镁工业
(4)、 利用2:提镁工业从海水中提取镁的流程图如下,按示例所示补全缺少的流程:。
 11. 以橄榄石(主要成分是Mg9FeSi5O20)等为原料固定CO2并生产硅胶、碱式碳酸镁[Mg2(OH)2CO3]的部分工艺流程如图所示:
11. 以橄榄石(主要成分是Mg9FeSi5O20)等为原料固定CO2并生产硅胶、碱式碳酸镁[Mg2(OH)2CO3]的部分工艺流程如图所示: (1)、Mg9FeSi5O20中铁的化合价为 ,为提高镁的浸出率 ,可采取的两种主要措施是 ,渣料Ⅱ的成分是。(2)、若试剂c是氯碱工业中生成的某种气体 ,写出加入c后反应的离子方程式 ,试剂d的用途是调节溶液pH ,其成分是 ,余液中溶质的主要成分是。(3)、操作Ⅰ的内容是 ,若固碳后溶液中的阴离子主要为CO ,写出生成碱式碳酸镁的离子方程式。12. 海水的综合利用包括很多方面,下图是一种海水综合利用联合工业体系的简易示例图。
(1)、Mg9FeSi5O20中铁的化合价为 ,为提高镁的浸出率 ,可采取的两种主要措施是 ,渣料Ⅱ的成分是。(2)、若试剂c是氯碱工业中生成的某种气体 ,写出加入c后反应的离子方程式 ,试剂d的用途是调节溶液pH ,其成分是 ,余液中溶质的主要成分是。(3)、操作Ⅰ的内容是 ,若固碳后溶液中的阴离子主要为CO ,写出生成碱式碳酸镁的离子方程式。12. 海水的综合利用包括很多方面,下图是一种海水综合利用联合工业体系的简易示例图。
回答下列问题:
(1)、实验室中由粗盐制取精盐的过程中,溶解、过滤、蒸发三个阶段都要用到的一种玻璃仪器是。(2)、电解饱和食盐水的离子方程式为。(3)、在溴工业中富集溴一般先用空气和水蒸气吹出单质溴,再用SO2的水溶液将其还原吸收,发生反应的化学方程式为。(4)、镁工业为使苦卤中的Mg2+完全转化为Mg(OH)2(离子浓度小于10-5 mol·L-1时,沉淀就达完全),溶液的pH至少要控制在[常温下,Mg(OH)2的Ksp≈1×10-11];Mg(OH)2沉淀完全后,过滤,沉淀用盐酸酸化,从MgCl2溶液制得无水MgCl2 , 应如何操作。(5)、海水中也有丰富的锂资源,我国科学家研发出利用太阳能从海水中提取金属锂的技术,提取原理如下图所示:
①金属锂在电极(填“A”或“B”)上生成。
②阳极产生两种气体单质,电极反应式是。
13. 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:(1)、氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许离子通过,氯气的逸出口是(填标号)。 (2)、次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)= ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为。(3)、Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为。(4)、ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为mol;产生“气泡”的化学方程式为。(5)、“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是(用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为kg(保留整数)。14. 氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图1所示:
(2)、次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)= ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为。(3)、Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为。(4)、ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为mol;产生“气泡”的化学方程式为。(5)、“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是(用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为kg(保留整数)。14. 氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图1所示: (1)、该流程中可以循环的物质是 .(2)、电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42﹣等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水.
(1)、该流程中可以循环的物质是 .(2)、电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42﹣等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水.①第一次精制过程中所加除杂试剂顺序不合理的是
A.BaCl2、NaOH、Na2CO3、HCl B.BaCl2、Na2CO3、NaOH、HCl
C.NaOH、BaCl2、Na2CO3、HCl D.Na2CO3、BaCl2、NaOH、HCl
②一次精制后的食盐水仍会有少量的Ca2+、Mg2+ , 需要送入阳离子交换塔进行二次精制,若不经过二次精制,直接进入离子膜电解槽,这样会产生什么后果 .
(3)、图2是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成),则A处产生的气体是 , F电极的名称是 . 电解总反应的离子方程式为 .(4)、从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为 .(5)、已知在电解槽中,每小时通过1A的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8h,制得32%的烧碱溶液(密度为1.342t/m3)113m3 , 电解槽的电流强度1.45×104A,该电解槽的电解效率为(保留两位小数).15.某化工厂将钛、氯碱工业和甲醇制备联合生产,大大提高原料利用率,并减少环境污染.流程如图:
回答下列问题:
 (1)、写出以石墨为电极电解饱和食盐水的离子方程式(2)、写出钛铁矿在高温下与焦炭经氯化得四氯化钛的化学方程式 ,生成1mol四氯化钛时转移电子的物质的量为 mol(3)、利用四氯化钛制备TiO2•xH2O时,需加入大量的水并加热的目的是
(1)、写出以石墨为电极电解饱和食盐水的离子方程式(2)、写出钛铁矿在高温下与焦炭经氯化得四氯化钛的化学方程式 ,生成1mol四氯化钛时转移电子的物质的量为 mol(3)、利用四氯化钛制备TiO2•xH2O时,需加入大量的水并加热的目的是
(4)、钛广泛用于航天领域.氩气在冶炼钛的流程中的作用是(5)、利用CO和H2制备甲醇①已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为﹣285.8kJ/mol、﹣283.0kJ/mol和﹣726.5kJ/mol.写出CO和H2制备甲醇的热化学方程式
②假设联合生产中各原料利用率为100%,若得到6mol甲醇,则只需再补充标准状况下的H2 L.
-