从巩固到提高 高考化学二轮微专题04 侯氏制碱法
试卷更新日期:2023-01-21 类型:二轮复习
一、单选题
-
1. 化学与生产、生活、科技和环境等密切相关。下列有关说法错误的是( )A、侯氏制碱过程中应向饱和食盐水中先通NH3 , 后通CO2 B、84消毒液与洁厕灵不能混用,若混用能产生有毒气体 C、卫星探测器上的太阳能电池帆板主要成分是晶体硅 D、“汽车尾气处理”有助于改善城市空气质量,有利于实现“碳达峰、碳中和”2. 一种利用有机胺(TBA)参与联合生产碳酸氢钠和二氯乙烷的工艺流程如图所示。下列说法错误的是( )
 A、TBA替代了侯德榜制碱法中的氨气 B、胺再生过程的反应为 C、整个工艺原子利用率为100%,符合绿色化学的要求 D、氯化过程每生成 , 总反应中消耗3. 实验室模拟侯氏制碱法制备的实验装置和原理能达到实验目的的是( )
A、TBA替代了侯德榜制碱法中的氨气 B、胺再生过程的反应为 C、整个工艺原子利用率为100%,符合绿色化学的要求 D、氯化过程每生成 , 总反应中消耗3. 实验室模拟侯氏制碱法制备的实验装置和原理能达到实验目的的是( ) A、用装置甲制取 B、用装置乙制取并收集 C、用装置丙制备晶体 D、用装置丁加热固体制备4. 工业上以 和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法错误的是( )
A、用装置甲制取 B、用装置乙制取并收集 C、用装置丙制备晶体 D、用装置丁加热固体制备4. 工业上以 和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法错误的是( )
已知:NaHSO3溶液呈弱酸性
A、工业上用黄铁矿(FeS2 , 其中硫元素为-1价)在高温下和氧气反应制备SO2 B、结晶后母液中含有NaHCO3 C、中和后溶液中含Na2SO3和NaHCO3 D、侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4Cl5. 由于氯化铵的市场价格过低,某制碱厂在侯氏制碱基础上改进的工艺如图:
有关该制碱工艺描述错误的是( )
A、原料是饱和NaCl(aq)、CO2 B、NH3循环使用 C、X可能是石灰乳 D、产品是Na2CO3和CaCl26. 侯德榜是我国近代化学工业的奠基人之一,他将氨碱法和合成氨工艺联合起来,发明了“联合制碱法”。氨碱法中涉及的反应有:反应Ⅰ:
反应Ⅱ:
下列制取少量的实验原理和装置能达到实验目的的是( )
 A、制取 B、除去中 C、制取 D、制取7. “侯氏制碱法”是我国化学家侯德榜为世界制纯碱工业做出的突出贡献。某实验小组模拟制纯碱的工艺流程及实验装置(部分夹持装置省略)如图所示,下列叙述正确的是( )
A、制取 B、除去中 C、制取 D、制取7. “侯氏制碱法”是我国化学家侯德榜为世界制纯碱工业做出的突出贡献。某实验小组模拟制纯碱的工艺流程及实验装置(部分夹持装置省略)如图所示,下列叙述正确的是( ) A、装置①中的试管中应盛放氯化铵固体 B、装置②的球形干燥管中应盛放碱石灰 C、装置②和装置③之间应该增加盛有饱和碳酸钠溶液的洗气瓶 D、装置①可以用装置③代替,但不可用装置④代替8. 侯德榜为我国的制碱工业做出了突出贡献。侯氏制碱法流程如下:
A、装置①中的试管中应盛放氯化铵固体 B、装置②的球形干燥管中应盛放碱石灰 C、装置②和装置③之间应该增加盛有饱和碳酸钠溶液的洗气瓶 D、装置①可以用装置③代替,但不可用装置④代替8. 侯德榜为我国的制碱工业做出了突出贡献。侯氏制碱法流程如下:
下列说法不正确的是( )
A、精制饱和食盐水的操作依次为:取样、溶解、沉淀、过滤、蒸发浓缩、冷却结晶、过滤、洗涤、烘干 B、该生产工艺制得纯碱的同时也得到了化学肥料 C、吸氨操作的目的是把溶液中的碳酸氢盐转化为碳酸盐并增大铵根离子的浓度 D、盐析环节中加入NaCl,对析出氯化铵起到了促进作用9. 现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下:
有关说法错误的是( )
A、反应Ⅰ原理为CO2 + NH3 + NaCl + H2O → NaHCO3↓ + NH4Cl B、向饱和NaCl溶液中先通入足量的CO2 , 再通入足量的NH3 C、反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱 D、往母液中通入氨气,加入细小的食盐颗粒并降温,可使氯化铵析出10. 某探究活动小组根据侯德榜制碱原理,按下面设计的方案制备碳酸氢钠。实验装置如图所示(图中夹持、固定用的仪器未画出)。下列说法正确的是( ) A、乙装置中盛放的是饱和食盐水 B、丙装置中的溶液变浑浊,因有碳酸氢钠晶体析出 C、丁装置中倒扣的漏斗主要作用是防止产生的气体污染空气 D、实验结束后,分离碳酸氢钠的操作是蒸发结晶11. 海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列说法正确的是( )
A、乙装置中盛放的是饱和食盐水 B、丙装置中的溶液变浑浊,因有碳酸氢钠晶体析出 C、丁装置中倒扣的漏斗主要作用是防止产生的气体污染空气 D、实验结束后,分离碳酸氢钠的操作是蒸发结晶11. 海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列说法正确的是( ) A、步骤①是指蒸发结晶 B、步骤⑤是先通CO2再通NH3 C、在步骤②、③、④中,溴元素均被氧化 D、制取NaHCO3的反应是利用其溶解度在常温下小于NaCl和NH4HCO312. 某科研小组利用有机胺(TBA)参与联合生产碳酸氢钠和二氯乙烷的工艺流程如图所示。
A、步骤①是指蒸发结晶 B、步骤⑤是先通CO2再通NH3 C、在步骤②、③、④中,溴元素均被氧化 D、制取NaHCO3的反应是利用其溶解度在常温下小于NaCl和NH4HCO312. 某科研小组利用有机胺(TBA)参与联合生产碳酸氢钠和二氯乙烷的工艺流程如图所示。
下列说法错误的是( )
A、过程①中的TBA替代了侯德榜制碱法中的氨气 B、过程②的反应为 C、理论上每产生 需要 D、流程中可循环利用的物质是TBA、CuCl二、综合题
-
13. 我国化学家侯德榜发明了联合制碱法,为世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。
 (1)、①~③所涉及的操作方法中,包含过滤的是(填序号)。(2)、根据上图,请写出生成碳酸氢钠固体的化学方程式:。(3)、下列说法中,正确的是____(填字母)。A、碳酸氢钠分解产生的可回收并循环使用 B、副产物可用作氮肥 C、溶液B中一定含有 D、饱和氯化钠溶液中应该先通二氧化碳再通入氨气(4)、某种市售食用碱是纯碱与小苏打的混合物,可大量应用于食品加工,如:面条、面包、馒头等,某校化学兴趣小组利用如图所示装置进行实验测定此种食用碱中纯碱的质量分数。
(1)、①~③所涉及的操作方法中,包含过滤的是(填序号)。(2)、根据上图,请写出生成碳酸氢钠固体的化学方程式:。(3)、下列说法中,正确的是____(填字母)。A、碳酸氢钠分解产生的可回收并循环使用 B、副产物可用作氮肥 C、溶液B中一定含有 D、饱和氯化钠溶液中应该先通二氧化碳再通入氨气(4)、某种市售食用碱是纯碱与小苏打的混合物,可大量应用于食品加工,如:面条、面包、馒头等,某校化学兴趣小组利用如图所示装置进行实验测定此种食用碱中纯碱的质量分数。
实验步骤:
①检查装置的气密性,称取样品(仅由纯碱与小苏打组成)10g,加到装置B中;
②连接装置,打开弹簧夹,先通一段时间空气后,关闭弹簧夹,打开分液漏斗活塞滴入稀硫酸至不再有气体生成;
③关闭分液漏斗的活塞,打开弹簧夹,继续通入一段时间空气。实验中记录的数据如表所示:
装置B
装置C
干燥管I
滴入硫酸前称得的质量/g
180.0
30.0
120.4
滴入硫酸后称得的质量/g
174.2
31.5
124.8
请回答下列问题:
①试剂X为。
②实验开始前,先打开弹簧夹,通入一段时间空气,其目的为 , 实验结束后,需要继续通入一段时间的空气,其目的是将装置内的赶到干燥管中被吸收。
③干燥管Ⅱ的作用是。
④有同学认为,表格中三组数据都可以计算该样品中的质量分数,但也有同学认为不能用装置C前后的质量差来计算,其理由是吸收的水蒸气并不全部来自反应生成;通过实验数据计算,食用碱中的质量分数为(保留三位有效数字)。
14. 对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝( )、钼( )、镍( )等元素的氧化物,一种回收利用工艺的部分流程如下: 已知:25℃时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。(1)、“焙烧”中,有 生成,其中 元素的化合价为。(2)、“沉铝”中,生成的沉淀 为。(3)、“沉钼”中, 为7.0。
已知:25℃时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。(1)、“焙烧”中,有 生成,其中 元素的化合价为。(2)、“沉铝”中,生成的沉淀 为。(3)、“沉钼”中, 为7.0。①生成 的离子方程式为。
②若条件控制不当, 也会沉淀。为避免 中混入 沉淀,溶液中 (列出算式)时,应停止加入 溶液。
(4)、①滤液Ⅲ中,主要存在的钠盐有 和 , 为。②往滤液Ⅲ中添加适量 固体后,通入足量(填化学式)气体,再通入足量 ,可析出 。
(5)、高纯 (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止 刻蚀液与下层 (砷化镓)反应。
①该氧化物为。②已知: 和 同族, 和 同族。在 与上层 的反应中, 元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为。
三、实验探究题
-
15. 纯碱是重要的化工原料。我国科学家侯德榜发明的“侯氏制碱法”打破了西方对我国的技术封锁。某实验小组同学利用下图装置,模拟“侯氏制碱法”的部分流程。

已知:NaCl、NH4HCO3、NaHCO3、NH4Cl四种盐在不同温度下的溶解度如下表所示:
温度溶解度(g)
物质
10℃
20℃
30℃
40℃
50℃
60℃
70℃
NaCl
35.8
36.0
36.3.
36.6
37.0
37.3
37.8
NH4HCO3
15.8.
21.0
27.0
一
一
—
—
NaHCO3
8.15
9.6
11.1
12.7
14.45
。16.4
一
NH4Cl
33.3
37.2
41.1
45.8
50.4
55.2
60.2
回答下列问题:
(1)、试剂b的名称是 , 试剂a的作用是。(2)、实验时应先打开(填“K1”或“K2”)开关,持续通入气体一段时间后,关闭此开关,再打开另一开关。硬质玻璃管的作用是。(3)、反应一段时间后,双颈烧瓶中观察到的实验现象为。该反应一般控制在30~35℃下进行,温度不宜过高的主要原因是(用化学方程式表示)。(4)、实验结束后,过滤双颈烧瓶中的混合物,滤渣经灼烧得纯碱,并回收滤液中的NH4Cl。为促进滤液中NH4Cl析出,需向滤液中通入NH3并加入一定量NaCl固体,原因是。(5)、制得的纯碱中混有NaHCO3和少量不与盐酸反应的杂质。该小组为测定其中NaHCO3的含量,取ag样品于试管中加水完全溶解,加入几滴酚酞溶液,用cmol·L-1的盐酸滴定至溶液由红色变为浅红色,消耗盐酸V1mL;再加1~2滴甲基橙指示剂,继续用盐酸滴定至溶液由黄色变为橙色,又消耗盐酸V2mL。则纯碱样品中NaHCO3质量分数为。16.(1)、I.某化学兴趣小组采用如下图所示装置研究NaHCO3分解的CO2与Na2O2反应。
完成下列填空:
画出乙中实验装置图,并标出相应试剂。
(2)、装置丙中仪器名称是 , 其中反应的化学方程式是 , 该反应中氧化剂与还原剂的质量比为。(3)、装置丁中NaOH溶液的作用是 , 装置戊中澄清石灰水的作用是。(4)、II.NaHCO3俗称小苏打,工业上可由通过侯氏制碱法制取(又称联合制碱法,由我国近代著名的化工学家侯德榜发明)。写出侯氏制碱法中生成NaHCO3的离子方程式。操作时,往饱和食盐水中先通入气体,原因是。
(5)、在密闭容器中投入一定量的Na2O2和NaHCO3 , 在300℃下充分反应。若残留固体为纯净物,则起始时应满足的条件是。17. 化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献。某化学兴趣小组在实验室中模拟侯氏制碱法制备NaHCO3 , 进一步 得到产品Na2CO3和NH4Cl两种产品,并测定碳酸钠中碳酸氢钠的含量。过程如下:(1)、Ⅰ.NaHCO3 的制备实验流程及实验装置图如下:

回答下列问题:
a导管末端多孔球泡的作用。
(2)、b中通入的气体是 , 写出实验室制取该气体的化学方程式。(3)、生成NaHCO3的总反应的化学方程式为。(4)、Ⅱ.Na2CO3中NaHCO3含量测定i.称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中:
ii.移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用0.1000mol·L-1盐酸标准溶液滴定至溶液由浅红色变无色(第一滴定终点), 消耗盐酸V1mL;
iii.在上述锥形瓶中再加入2滴指示剂N,继续用0.1000mol·L-1盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸V2mL;
iv.平行测定三次,V1 平均值为22.25,V2平均值为23.51。
回答下列问题:
指示剂N为 , 第二滴定终点的现象是。
(5)、Na2CO3中NaHCO3的质量分数为 ( 保留三位有效数字)。(6)、第一滴定终点时,某同学仰视读数,其他操作均正确,则NaHCO3质量分数的计算结果(填“偏大”“偏小”或“无影响”)。18. 化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3 , 进一步处理得到产品Na2CO3和NH4Cl,实验流程如图: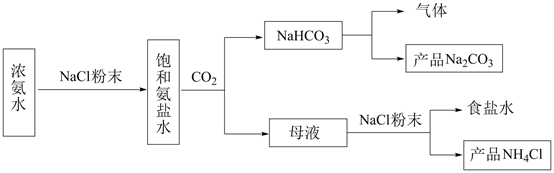
回答下列问题:
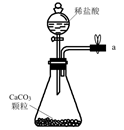
(1)、从A~E中选择合适的仪器制备NaHCO3 , 正确的连接顺序是(按气流方向,用小写字母表示)。为使A中分液漏斗内的稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或。A.
 B.
B. 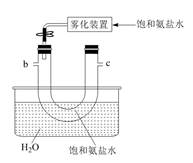 C.
C.  D.
D. 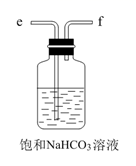 E.
E.  (2)、B中使用雾化装置的优点是 。(3)、生成NaHCO3的总反应的化学方程式为。(4)、反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:
(2)、B中使用雾化装置的优点是 。(3)、生成NaHCO3的总反应的化学方程式为。(4)、反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2 , Na2O2增重0.14g,则固体NaHCO3的质量为g。
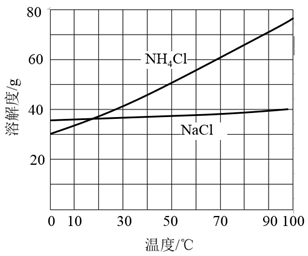
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为、、洗涤、干燥。
 (5)、无水NaHCO3可作为基准物质标定盐酸浓度.称量前,若无水NaHCO3保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果___(填标号)。A、偏高 B、偏低 不变
(5)、无水NaHCO3可作为基准物质标定盐酸浓度.称量前,若无水NaHCO3保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果___(填标号)。A、偏高 B、偏低 不变