从巩固到提高 高考化学二轮微专题02 工业制硫酸
试卷更新日期:2023-01-21 类型:二轮复习
一、单选题
-
1. 劳动创造幸福未来。下列劳动项目与所述的化学知识关联不合理的是( )
选项
劳动项目
化学知识
A
科学研究:燃煤脱硫
有利于实现“碳达峰、碳中和”
B
工厂生产:接触法制硫酸
涉及氧化还原反应
C
社会服务;推广使用免洗手酒精消毒液
酒精能使蛋白质变性
D
家务劳动:使用碳酸氢钠做食品膨松剂
碳酸氢钠在加热条件下分解产生CO2
A、A B、B C、C D、D2. 下列说法错误的是( )A、海水提溴过程中鼓入热空气的目的是除去多余的氯气 B、接触法制硫酸,用98.3%H2SO4吸收SO3 , 而不是用水吸收 C、将Cl2通入冷的石灰乳中,可制得有效成分为Ca(ClO)2的漂白粉 D、合成氨反应的原料气必须经过净化,目的是防止混有的杂质使催化剂“中毒”3. 下列说法正确的是( )A、将生铁进一步炼制减少含碳量,能得到耐腐蚀的钢 B、硫酸工业吸收塔中,采用从顶部喷淋水吸收SO3 C、将二氧化碳通入含氨的氯化钠饱和溶液中,析出碳酸钠晶体得到纯碱 D、工业上从铝土矿中提取铝的过程中加入Na3AlF6的目的是提高铝的产量4. 下列关于工业生产过程的叙述正确的是( )A、联合制碱法中循环使用CO2和NH3 , 以提高原料利用率 B、硫酸工业中,SO2氧化为SO3时采用常压,因为高压会降低SO2转化率 C、合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 D、SO2在接触室被氧化成SO3 , SO3在吸收塔内被吸收制成浓硫酸5. 工业制硫酸的接触室中发生反应:。该反应在500℃和催化剂存在下进行,下列有关说法正确的是( )A、如果使氧气过量,并给足够时间让反应充分进行,SO2可以全部转化为SO3 B、该反应的平衡常数(K)随体系压强的增加而增大 C、该反应选择在500℃和催化剂存在下进行,因此该反应是吸热反应 D、反应达到化学平衡后,只改变温度,化学平衡一定会被破坏6. 下列说法正确的是( )A、工业上通过电解六水合氯化镁制取金属镁 B、接触法制硫酸时,煅烧黄铁矿以得到三氧化硫 C、浓硝酸与铁在常温下不反应,所以可用铁质容器贮运浓硝酸 D、“洁厕灵”(主要成分为盐酸)和“84消毒液”(主要成分为次氯酸钠)不能混用7. 下列有关化工生产的说法错误的是( )A、硫酸工业中采用高压,以提高二氧化硫的转化率 B、联合制碱法在母液中继续通入氨气、加入食盐 C、氯碱工业可制得氢氧化钠、盐酸等化工产品 D、合成氨工业控制温度在500℃,以提高催化剂的催化效果8. 工业制硫酸的适宜条件不包括( )A、矿石粉碎成粉末可加快反应速率 B、原料气进入转化器之前需净化处理 C、SO2转化为SO3时用铁触媒作催化剂 D、用98.3%的浓硫酸吸收SO39. 热交换器是用来使热量从热流体传递到冷流体,以满足规定的工艺要求的装置,是对流传热及热传导的一种工业应用。下列化工生产在接触室中使用热交换器的是( )A、氯碱工业 B、石油分馏 C、硫酸工业 D、索尔维制碱法10. 如图所示为接触法制硫酸的设备和工艺流程,其中关键步骤是SO2的催化氧化:2SO2+O2 2SO3 △H<0。下列说法正确的是( ) A、反应后气体分子数减少,增大反应容器内压强一定有利于提高生产效益 B、反应放热,为提高SO2转化率,应尽可能在较低温度下反应 C、工业生产要求高效,为加快反应速率,应使用催化剂并尽可能提高体系温度 D、沸腾炉流出的气体必须经过净化,并补充适量空气,再进入接触室11. 下列说法正确的是( )A、 在空气中加热可得固体 B、 加入到过量 溶液中可得 C、 在沸腾炉中与 反应主要生成 D、 溶液中加入少量 粉末生成 和12. 工业上制备下列物质的生产流程不合理的是( )A、由黄铁矿制硫酸:黄铁矿 B、由重晶石制可溶性钡盐:重晶石(BaSO4) BaCO3 BaCl2(aq) C、由石英砂制高纯硅:石英砂 粗硅 SiCl4 Si D、由铝土矿冶炼铝:铝土矿 Al2O3 AlCl3(aq) Al13. 下列工业生产采取的措施能达到相应目的的是( )
A、反应后气体分子数减少,增大反应容器内压强一定有利于提高生产效益 B、反应放热,为提高SO2转化率,应尽可能在较低温度下反应 C、工业生产要求高效,为加快反应速率,应使用催化剂并尽可能提高体系温度 D、沸腾炉流出的气体必须经过净化,并补充适量空气,再进入接触室11. 下列说法正确的是( )A、 在空气中加热可得固体 B、 加入到过量 溶液中可得 C、 在沸腾炉中与 反应主要生成 D、 溶液中加入少量 粉末生成 和12. 工业上制备下列物质的生产流程不合理的是( )A、由黄铁矿制硫酸:黄铁矿 B、由重晶石制可溶性钡盐:重晶石(BaSO4) BaCO3 BaCl2(aq) C、由石英砂制高纯硅:石英砂 粗硅 SiCl4 Si D、由铝土矿冶炼铝:铝土矿 Al2O3 AlCl3(aq) Al13. 下列工业生产采取的措施能达到相应目的的是( )选项
化学工业
措施
目的
A
合成氨
500℃左右
防止催化剂中毒
B
石油化工
裂化
提高轻质油的产量
C
工业制硫酸
V2O5催化
提高SO2的转化率
D
侯氏制碱
先通CO2
有利于CO2充分吸收
A、A B、B C、C D、D14. 硫酸工业的有关叙述错误的是()A、硫铁矿磨成粉末,可加快反应速率 B、煅烧硫铁矿时鼓入较大量空气,可提高原料利用率 C、接触室(发生反应: )使用热交换器,可充分利用能量
D、接触室出来的气体被浓硫酸(
)使用热交换器,可充分利用能量
D、接触室出来的气体被浓硫酸(  溶于其中)吸收后,可直接排放到空气中
15. 某硫酸厂回收利用废气中SO2的方案如图所示。下列说法不正确的是( )
溶于其中)吸收后,可直接排放到空气中
15. 某硫酸厂回收利用废气中SO2的方案如图所示。下列说法不正确的是( ) A、X中可能含有2种盐 B、Y 中含有 NH4HSO4 C、(NH4)2S2O8是阴极产物 D、气体a转化为H2SO4的过程中发生了氧化还原反应
A、X中可能含有2种盐 B、Y 中含有 NH4HSO4 C、(NH4)2S2O8是阴极产物 D、气体a转化为H2SO4的过程中发生了氧化还原反应二、实验探究题
-
16. 某实验小组利用如图装置模拟古法制硫酸并进行性质探究。

已知:①“青矾”是指 , 高温受热可完全分解得红棕色固体和气体混合物;
②熔点-75.5℃,沸点-10℃:熔点16.8℃,沸点44.8℃。
请回答下列问题:
(1)、()11.12g,隔绝空气加热时,样品质量随温度变化的曲线如图所示,分解产物N的化学式。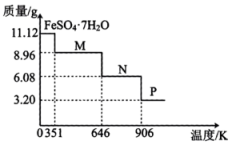 (2)、I.制取硫酸实验开始前打开活塞、 , 关闭活塞 , 通入一段时间后,关闭活塞、 , 打开活塞 , 用酒精喷灯高温加热绿矾。
(2)、I.制取硫酸实验开始前打开活塞、 , 关闭活塞 , 通入一段时间后,关闭活塞、 , 打开活塞 , 用酒精喷灯高温加热绿矾。A装置中发生反应的化学方程式为。
(3)、B装置的作用是。(4)、实验结束后,打开活塞 , 再通入一段时间 , 这样做的目的是。(5)、II.探究的性质在装置C中先后四次加入同浓度同体积不同情况的钡盐溶液,控制食用油油层厚度一致、通入流速一致。四次实验分别得到如表pH-t图:
①
②
③
④
已煮沸的
未煮沸的
已煮沸的
未煮沸的




C装置中覆盖食用油的目的是。
(6)、分析pH-t图,写出④中发生反应的离子方程式。17. Li-SOCl2电池采用LiAlCl4的SOCl2溶液为电解质溶液,是目前比能量最高的化学电源,具有电压高.储存寿命长.工作温度范围宽.成本低等优点。(1)、该电池的工作原理为:4Li+2SOCl2=4LiCl↓+SO2↑+S↓,该反应的还原产物为 , 若生成标准状况下气体11.2L,则转移电子的数目为;(2)、SOCl2可用于AlCl3·6H2O制备无水AlCl3 , 请结合离子方程式解释不采用直接加热晶体的方法除去结晶水的原因;(3)、解释Li-SOCl2电池组装必须在无水条件下的原因;(4)、工业制硫酸中,SO2的催化氧化采用常压而不是高压的原因;(5)、向NaOH溶液中缓慢通入SO2至过量,反应过程中某微粒X的物质的量浓度随着通入SO2体积的变化如图所示,该微粒X为 , SO2过量时溶液仍然存在微粒X的原因。
三、综合题
-
18. 硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
 (1)、以黄铁矿为原料生产SO2时反应的化学方程式为: , 该反应在中进行(填设备名称);(2)、某科研小组测得某硫酸工厂生产工厂中SO2的平衡转化率与外部条件的关系如下表所示,则生产过程中,最适合的生产条件是;
(1)、以黄铁矿为原料生产SO2时反应的化学方程式为: , 该反应在中进行(填设备名称);(2)、某科研小组测得某硫酸工厂生产工厂中SO2的平衡转化率与外部条件的关系如下表所示,则生产过程中,最适合的生产条件是;压强(Pa)
温度(℃)
1.013×105
5.065×105
10.13×105
15.195×105
400
99.61%
99.72%
99.84%
99.88×105
500
96.75%
97.67%
98.52%
98.94%
600
85.20%
88.97%
92.76%
94.68%
(3)、接触室内有一热交换器,其作用是 , 若将从C处(如图)出来的气体通入BaCl2溶液中,则主要负电离子方程式为(写总反应式);(4)、下列做法中,与提高硫酸工业的经济效益无关的是;a.适当地对黄铁矿进行粉碎
b.在接触室中使用适当过量的O2
c.利用生产中的余热发电或供暖
d.对废水进行无害化处理后再排放
(5)、硫酸工业会产生许多对环境有害的物质,因此无论是工厂厂址的选择还是生产过程中有害成分的处理都要充分考虑环保的要求;①某市计划建一个硫酸工厂,厂址有A、B、C三个地方可供选择,假设最终该厂建在B地,你认为选择B地建厂的理由是(至少回答两点)、;
②将尾气中SO2在一定条件下转化为CaSO4 , 然后利用焦炭将其转化为CaS(另有一种可燃性气体生成)具有重要的意义,写出CaSO4转化为CaS的化学方程式;
(6)、若用等质量的硫磺,FeS2生产硫酸,假设原料的总利用率均为90%,则二者得到的硫酸质量比为 .