高中化学人教版(2019)必修第一册寒假专项训练 铁和其化合物的性质
试卷更新日期:2023-01-12 类型:复习试卷
一、单选题
-
1. 化学与生活密切相关,下列物质用途错误的是( )A、漂白粉可用于棉、麻、纸张的漂白剂 B、小苏打用于治疗胃酸过多的一种药剂 C、泡沫灭火器用于钠着火的灭火剂 D、铁粉可用于食品袋内的脱氧剂2. 下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
选项
叙述Ⅰ
叙述Ⅱ
A
纯碱是强碱弱酸盐
用纯碱溶液可清洗油污
B
不锈钢合金
不锈钢在潮湿环境中容易被腐蚀
C
是碱性氧化物
可用作红色油漆和涂料
D
是红棕色气体
常温下可用铜与浓硝酸制取
A、A B、B C、C D、D3. 宏观辨识与微观探析是化学学科核心素养之一、下列物质性质实验对应的反应方程式书写正确的是( )A、放入水中: B、通过灼热铁粉: C、用醋酸除去水垢: D、通入水中制硝酸:4. 用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法正确的是( ) A、实验时,先点燃酒精喷灯再点燃酒精灯 B、反应中作氧化剂,发生反应的化学方程式为 C、干燥管中加入的固体干燥剂可以是无水氯化钙 D、收集反应产生的气体选用装置②5. 下列各组物质反应后,滴入KSCN溶液,显红色的是( )
A、实验时,先点燃酒精喷灯再点燃酒精灯 B、反应中作氧化剂,发生反应的化学方程式为 C、干燥管中加入的固体干燥剂可以是无水氯化钙 D、收集反应产生的气体选用装置②5. 下列各组物质反应后,滴入KSCN溶液,显红色的是( )①;②溶液;③溶液;④稀
A、②④ B、①② C、③④ D、①④6. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、7. 铁元素的“类—价”二维图如下图所示。下列有关说法正确的是( ) A、高温下a与水蒸气反应可得到e B、在空气中加热c,可实现c→b的转化 C、向d的硝酸盐溶液中加入稀盐酸,可实现d→g的转化 D、在水中g易水解,在水处理过程中常加入g的硫酸盐杀菌消毒8. 将使用过的废铝热剂(主要成分为 , 含少量)再生制取金属铝的工艺流程如图所示。下列说法中正确的是( )
A、高温下a与水蒸气反应可得到e B、在空气中加热c,可实现c→b的转化 C、向d的硝酸盐溶液中加入稀盐酸,可实现d→g的转化 D、在水中g易水解,在水处理过程中常加入g的硫酸盐杀菌消毒8. 将使用过的废铝热剂(主要成分为 , 含少量)再生制取金属铝的工艺流程如图所示。下列说法中正确的是( ) A、“碱浸”时,发生反应的化学方程式为 B、“沉铝”时,可以用足量HCl代替 C、冶炼金属铝的方法为热还原法 D、该流程中各步均不涉及氧化还原反应9. 下列实验中,能够正确描述其反应离子方程式的是( )A、用白醋除水垢:2H++CaCO3=Ca2++CO2↑+H2O B、常温下,硫化钾溶液的pH>7:S2-+H3O+HS-+H2O C、用铜电极电解饱和食盐水:2Cl-+2H2OH2↑+Cl2↑+2OH- D、向FeSO4溶液中加入K3[Fe(CN)6]溶液:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓10. 用铁泥(主要成分为Fe2O3、FeO和Fe)制备纳米Fe3O4(平均直径25nm)的流程示意图如图:
A、“碱浸”时,发生反应的化学方程式为 B、“沉铝”时,可以用足量HCl代替 C、冶炼金属铝的方法为热还原法 D、该流程中各步均不涉及氧化还原反应9. 下列实验中,能够正确描述其反应离子方程式的是( )A、用白醋除水垢:2H++CaCO3=Ca2++CO2↑+H2O B、常温下,硫化钾溶液的pH>7:S2-+H3O+HS-+H2O C、用铜电极电解饱和食盐水:2Cl-+2H2OH2↑+Cl2↑+2OH- D、向FeSO4溶液中加入K3[Fe(CN)6]溶液:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓10. 用铁泥(主要成分为Fe2O3、FeO和Fe)制备纳米Fe3O4(平均直径25nm)的流程示意图如图:
下列叙述不正确的是( )
A、铁红可用于油漆、油墨、建筑物着色剂 B、步骤②中,发生反应的离子方程式是2Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑ C、步骤④中使用过量的H2O2有利于提高纳米Fe3O4产率 D、为验证纳米态的Fe3O4 , 可将其形成分散系,做丁达尔效应实验11. 下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验提供的试剂:铁屑、6 mol/L硫酸溶液、NaOH溶液。下列说法不正确的是( ) A、B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑 B、实验开始时应先将活塞E关闭 C、生成Fe(OH)2的操作为:关闭E,使A中溶液压入B瓶中 D、取下装置B中的橡皮塞,使空气进入,有关反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)312. 下图所示实验方案无法达到预期实验目的的是( )
A、B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑 B、实验开始时应先将活塞E关闭 C、生成Fe(OH)2的操作为:关闭E,使A中溶液压入B瓶中 D、取下装置B中的橡皮塞,使空气进入,有关反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)312. 下图所示实验方案无法达到预期实验目的的是( ) A、用甲制备少量 B、用乙制备少量 C、用丙制备并收集 D、用丁比较Cl、C、Si的非金属性强弱13. 下列有关铁及其化合物的叙述正确的是( )A、Fe3O4可用作红色颜料 B、Cl2可用于除去FeCl2溶液中混有的少量FeCl3 C、铁与水蒸气高温反应可生成Fe3O4和氢气 D、饱和FeCl3溶液滴入NaOH溶液中可制得Fe(OH)3胶体14. 、的混合溶液中加入铁粉,充分反应后有固体存在,下列判断不正确的( )A、溶液中可能含 B、溶液中一定含 C、加入KSCN溶液可能会变红色 D、剩余固体中肯定含有Cu,还可能含有Fe15. 等物质的量的铁分别与足量的盐酸、水蒸气在一定条件下充分反应,则在相同的条件下,产生氢气的体积比是( )A、1∶1 B、3∶4 C、2∶3 D、4∶3
A、用甲制备少量 B、用乙制备少量 C、用丙制备并收集 D、用丁比较Cl、C、Si的非金属性强弱13. 下列有关铁及其化合物的叙述正确的是( )A、Fe3O4可用作红色颜料 B、Cl2可用于除去FeCl2溶液中混有的少量FeCl3 C、铁与水蒸气高温反应可生成Fe3O4和氢气 D、饱和FeCl3溶液滴入NaOH溶液中可制得Fe(OH)3胶体14. 、的混合溶液中加入铁粉,充分反应后有固体存在,下列判断不正确的( )A、溶液中可能含 B、溶液中一定含 C、加入KSCN溶液可能会变红色 D、剩余固体中肯定含有Cu,还可能含有Fe15. 等物质的量的铁分别与足量的盐酸、水蒸气在一定条件下充分反应,则在相同的条件下,产生氢气的体积比是( )A、1∶1 B、3∶4 C、2∶3 D、4∶3二、综合题
-
16. 铁在地壳中含量丰富,也是重要的人体微量元素之一.(1)、Ⅰ.如图所示装置可用来制取和观察在空气中被氧化时颜色的变化.实验时必须使用铁屑和的硫酸,其他试剂任选.填写下列空白:

B中盛一定量的NaOH溶液,A中应预先加入的试剂是.实验开始时先将止水夹E打开,C中收集到气体的主要成分是.
(2)、关闭止水夹E,A中压强增大,把溶液压入B瓶中进行反应.生成沉淀的离子方程式为.(3)、拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:.(4)、Ⅱ.验证菠菜中铁元素的存在.①取新鲜菠菜切开表皮,在内部组织上滴加KSCN溶液,无颜色变化,说明菠菜中铁元素不以(填离子符号)形式存在.
②另取新鲜菠菜洗净、烘干,放入坩埚中灼烧成灰烬.冷却后将灰烬移入烧杯中,加入溶液至没有气体产生,加蒸馏水稀释,充分搅拌后过滤.取少量滤液于试管中,加入KSCN溶液,溶液变为色,由此推断滤液中有.实验中加入溶液的目的为.
(5)、为了防止缺铁性贫血,一些食品中允许添加含铁物质.某种麦片含有微量的还原铁粉,铁粉在胃酸的作用下会溶解.铁与盐酸反应的离子方程式为.17. 铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。(1)、现配制100mL0.01mol∙L-1FeCl3溶液,配制过程中需要的玻璃仪器除量筒、烧杯、玻璃棒外,还需要。(2)、将饱和FeCl3溶液滴入沸水可得到红褐色液体,反应的化学方程式是。此液体具有的性质是(填写序号字母)。a.光束通过该液体时形成光亮的“通路”
b.将该液体进行过滤,可得到红褐色固体
c.将该液体加热、蒸干、灼烧后,有氧化物生成
d.向该液体中加入硝酸银溶液,无沉淀产生
(3)、“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分)氧化为 , 并使溶液酸性增强。①该过程反应的离子方程式为。
②人们可利用作强氧化剂溶解铜矿石(),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:。
_Cu2S+_Fe3++_H2O_Fe2++_Cu2++_+_
(4)、羟胺(NH2OH)是一种还原剂,用50.00mL0.25mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与25.00mL0.5mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是。18. 用工业废渣(主要含有Fe2O3、FeO、Al2O3及少量Fe)制备绿矾FeSO4·7H2O晶体的流程如下: (1)、“浸泡”过程中加入过量NaOH溶液的目的是。(2)、“溶解”后所得溶液中含有的金属阳离子为Fe3+和 , 检验此溶液中Fe3+可使用的试剂是。(3)、“还原”时选择FeS2而不用Cu粉的原因是。(4)、测定绿矾中Fe2+的氧化率实验方案如下:
(1)、“浸泡”过程中加入过量NaOH溶液的目的是。(2)、“溶解”后所得溶液中含有的金属阳离子为Fe3+和 , 检验此溶液中Fe3+可使用的试剂是。(3)、“还原”时选择FeS2而不用Cu粉的原因是。(4)、测定绿矾中Fe2+的氧化率实验方案如下:步骤一:称取一定质量的绿矾样品,将其溶于适量的无氧蒸馏水并配成250mL溶液;
步骤二:取步骤一中配得的溶液25.00mL于锥形瓶,并加入适量稀硫酸酸化,逐滴滴加0.0400mol/L KMnO4溶液至恰好完全反应(反应原理为:MnO+5Fe2++8H+=Mn2++5Fe3++4H2O),消耗KMnO4溶液20.00mL;
步骤三:另取步骤一中配得的溶液25.00mL于烧杯,加入足量氨水,将沉淀过滤、洗涤、干燥,在空气中灼烧至固体质量不再变化,称得残留红棕色固体的质量为0.4g。
①步骤三中灼烧所得残留固体的化学式为。
②已知:Fe2+的氧化率=×100%
根据以上数据,计算该绿矾样品中Fe2+的氧化率,写出计算过程。
19. 化学与人类生活、生产和社会可持续发展密切相关,请回答下列问题。(1)、Ⅰ春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入气体的化学方程式。
(2)、用的溶液吸收 , 所得溶液中和物质的量浓度之比为。(3)、Ⅱ.如图为铁及其化合物的“价一类”二维图。
图中①处填 , ②处填。
(4)、某小组在探究性质的实验(实验1)时,观察到溶液变红,片刻红色褪去,有气体生成。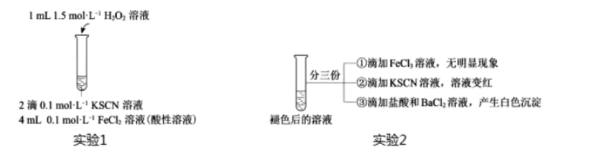
用实验2探究“红色褪去”的原因,则红色褪去的原因是。
20. 电子工业中常用覆铜板为基础材料制作印刷电路板,工业上利用FeCl3溶液作为“腐蚀液”将覆铜板上不想要的铜腐蚀,同时还可以从腐蚀废液(主要含FeCl3、FeCl2和CuCl2)中回收铜,并重新获得FeCl3溶液。废液处理流程如下:
请回答下列问题。
(1)、操作I的名称为。(2)、FeCl3溶液腐蚀铜板的离子方程式为。(3)、试剂a是一种常见金属单质,试剂a为(填化学式)。沉淀A为(填化学式)。从氧化还原反应的角度分析,试剂c是(填“氧化”或“还原”)剂。(4)、为了检验腐蚀废液中是否含有FeCl3 , 可将腐蚀废液取样然后滴加____(填字母)。A、NaOH溶液 B、KSCN溶液 C、AgNO3溶液(5)、实验室配制FeCl2溶液时为了防止FeCl2溶液变质,经常向其中加入铁粉,其原因是(用化学方程式表示)。