高中化学人教版(2019)必修第一册寒假专项训练 钠的重要化合物
试卷更新日期:2023-01-12 类型:复习试卷
一、单选题
-
1. 化学物质在航天领域有广泛用途。下列说法错误的是( )A、作航天器的太阳能电池 B、过氧化钠作航天供氧剂 C、合成纤维可作航天员航天服 D、硬铝可作航天飞船材料2. 以不同类别物质间的转化为线索,认识钠及其化合物.

下列分析正确的是( )
A、从煤油中取用钠只需小刀、滤纸和玻璃片 B、上述含钠的化合物溶于水加入少量酚酞溶液,最终都会变成红色 C、反应⑤、⑥可用于潜水艇中氧气的供给,常温下产生 , 转移电子 D、将相同质量的碳酸钠与碳酸氢钠分别加入足量稀盐酸中,前者产生的多3. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、4. 下列关于钠及其化合物的说法正确的是( )A、、均为碱性氧化物 B、将Na、投入水中,会生成同种气体 C、Na、、久置在空气中均会因发生氧化还原反应而变质 D、将Na、固体分别投入滴加了紫色石蕊试液的水中,均可以得到蓝色溶液5. 下列有关Na2CO3和NaHCO3比较中,正确的是( )A、向碳酸钠中加入少量水后,温度下降;向碳酸氢钠中加入少量水后,温度上升 B、相同条件下在水中的溶解度:Na2CO3<NaHCO3 C、相同条件下与等浓度的盐酸反应的剧烈程度:Na2CO3>NaHCO3 D、等质量的碳酸钠和碳酸氢钠与足量盐酸反应放出气体的量:Na2CO3<NaHCO36. 下列实验装置不能达到实验目的的是( ) A、利用装置①验证Na和水反应为放热反应 B、利用装置②检验Na2O2与H2O反应有O2生成 C、利用装置③观察纯碱的焰色实验的现象 D、利用装置④比较Na2CO3和NaHCO3的热稳定性7. 以不同类别物质间的转化为线索,认识钠及其化合物。下列分析错误的是( )
A、利用装置①验证Na和水反应为放热反应 B、利用装置②检验Na2O2与H2O反应有O2生成 C、利用装置③观察纯碱的焰色实验的现象 D、利用装置④比较Na2CO3和NaHCO3的热稳定性7. 以不同类别物质间的转化为线索,认识钠及其化合物。下列分析错误的是( ) A、反应①②中1mol Na均失去个电子 B、反应③说明具有酸性氧化物的性质 C、根据反应④可知,用加热的方法可以除去固体中的杂质 D、反应⑤⑥中,若各有1nol分别与足量的和反应,都转移2mol电子8. 下图是碳及其化合物的“价一类”二维图,f为、。下列说法正确的是( )
A、反应①②中1mol Na均失去个电子 B、反应③说明具有酸性氧化物的性质 C、根据反应④可知,用加热的方法可以除去固体中的杂质 D、反应⑤⑥中,若各有1nol分别与足量的和反应,都转移2mol电子8. 下图是碳及其化合物的“价一类”二维图,f为、。下列说法正确的是( ) A、a只能被氧化,c是酸性氧化物 B、d的水溶液能导电,d属于电解质 C、d→f的转化一定不是氧化还原反应 D、向饱和溶液中通入d有沉淀析出9. NaCl是一种化工原料,可以制备一系列物质,如图所示。下列说法中正确的是( )
A、a只能被氧化,c是酸性氧化物 B、d的水溶液能导电,d属于电解质 C、d→f的转化一定不是氧化还原反应 D、向饱和溶液中通入d有沉淀析出9. NaCl是一种化工原料,可以制备一系列物质,如图所示。下列说法中正确的是( ) A、25℃时,在水中的溶解度比的小 B、工业上可用石灰乳与反应制取漂粉精 C、和在点燃的条件下安静燃烧,产生淡蓝色火焰 D、如图所示转化反应都是氧化还原反应10. 下列有关钠及其化合物的叙述中,正确的是( )
A、25℃时,在水中的溶解度比的小 B、工业上可用石灰乳与反应制取漂粉精 C、和在点燃的条件下安静燃烧,产生淡蓝色火焰 D、如图所示转化反应都是氧化还原反应10. 下列有关钠及其化合物的叙述中,正确的是( )①金属钠着火时用泡沫灭火器灭火
②二氧化碳通过Na2O2粉末,反应后固体物质增重
③切开的金属钠暴露在空气中,光亮表面逐渐变暗:2Na+O2=Na2O2
④Na2O2用作呼吸面具的供氧剂
⑤为了除去NaHCO3溶液中含有的Na2CO3 , 可往溶液中滴加适量盐酸
A、①③ B、②③④ C、②③ D、②④11. 某实验小组通过如图所示实验,探究Na2O2与水的反应,下列说法中错误的是( ) A、②中的大量气泡的主要成分是氧气 B、③中溶液变红,说明有碱性物质生成 C、④中现象可能是由于溶液中含有漂白性物质造成的 D、⑤中MnO2的主要作用是作反应物12. 下列关于钠及其化合物的说法错误的是( )A、Na2O2中阴阳离子的个数比为1:2 B、用澄清石灰水可以鉴别NaHCO3溶液和Na2CO3溶液 C、等物质的量的钠和过氧化钠分别与足量水反应可产生等物质的量的气体 D、保持温度不变,向Na2CO3饱和溶液中通入CO2 , 会有结晶析出13. 下列选项中,陈述I、II均正确且两者之间具有因果关系的是( )
A、②中的大量气泡的主要成分是氧气 B、③中溶液变红,说明有碱性物质生成 C、④中现象可能是由于溶液中含有漂白性物质造成的 D、⑤中MnO2的主要作用是作反应物12. 下列关于钠及其化合物的说法错误的是( )A、Na2O2中阴阳离子的个数比为1:2 B、用澄清石灰水可以鉴别NaHCO3溶液和Na2CO3溶液 C、等物质的量的钠和过氧化钠分别与足量水反应可产生等物质的量的气体 D、保持温度不变,向Na2CO3饱和溶液中通入CO2 , 会有结晶析出13. 下列选项中,陈述I、II均正确且两者之间具有因果关系的是( )选项
陈述I
陈述II
A.
小苏打可用于治疗胃酸过多
NaHCO3受热易分解
B.
Na2O2可作潜水艇的供氧剂
Na2O2能和CO2、H2O反应生成O2
C.
碳单质在氧气中燃烧可以生成CO和CO2
CO和CO2都是酸性氧化物
D.
氨气是电解质
NH3的水溶液显碱性
A、A B、B C、C D、D14. A、B、C三种物质可以发生转化如图,A含钙元素,B、C的焰色试验均为黄色,下列说法错误的是( ) A、若A为 , 则B→C的反应可以为 B、若A为 , D是 , 则是难溶于水的盐 C、若A为 , 则B只能是碳酸钠,E为盐酸 D、若A为 , 则B→C的反应可以是15. 在一定条件下,将ag某物质在足量O2中充分燃烧后,再通过足量的Na2O2固体,测得固体共增重ag。则该物质可能是( )A、CH4 B、CO2 C、CH3OH D、H2O
A、若A为 , 则B→C的反应可以为 B、若A为 , D是 , 则是难溶于水的盐 C、若A为 , 则B只能是碳酸钠,E为盐酸 D、若A为 , 则B→C的反应可以是15. 在一定条件下,将ag某物质在足量O2中充分燃烧后,再通过足量的Na2O2固体,测得固体共增重ag。则该物质可能是( )A、CH4 B、CO2 C、CH3OH D、H2O二、综合题
-
16. 研究钠及其化合物的性质有重要的意义。(1)、金属钠非常活泼,通常保存在中,以隔绝空气。(2)、汽车安全气囊内装有、和等物质。
①当汽车发生严重碰撞时,引发分解:。的电子式为;若安全气囊内有 , 其完全分解所释放的在标准状况下的体积为L。
②产生的立即与发生置换反应生成 , 其中被还原的物质是。
③作冷却剂,吸收体系释放的热量。试解释作冷却剂的工作原理(用化学方程式表示)。
(3)、某同学向和的混合液中逐滴加入一定浓度的盐酸,生成的体积(标准状况)与加入盐酸的体积的关系如图所示。
①混合液中。
②盐酸的物质的量浓度为。
(4)、某兴趣小组向溶液中滴加溶液,产生白色沉淀和气体,该条件下反应的离子方程式为。17. 元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图是钠的价类二维图:
请回答以下问题:
(1)、在野外可用作生氢剂,其与水反应的化学方程式为。(2)、写出二维图中缺失①中某种淡黄色固体的化学式 , 其阳离子与阴离子的个数比为。(3)、溶液常因温度过高而分解,导致含有少量 , 除去杂质的方法为(用离子方程式表示)。(4)、向某物质的量浓度的溶液中缓慢通入一定量的(忽略溶液体积的变化),充分反应。将上述所得溶液,逐滴滴加的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
①原溶液的浓度为。
②AB段发生反应的离子方程式。
(5)、我国科学家研发了一种室温下“可呼吸”的充电电池。电池的总反应为:。①该电池消耗(标准状况)气体时,转移电子数为(用表示)。
②该电池中不能存在水,否则可能引起电池爆炸,用离子方程式表示其原因。
18. 回答下列问题:(1)、工业上,FeCl3溶液作为将铜箔刻制成电路的“腐蚀液”,产物是CuCl2和 , 回收铜,可向腐蚀后的溶液中加入 ( 选填“钠块”铁粉”或“银粉”)(2)、过氧化钠(Na2O2) 中氧的化合价为 , 它可用于呼吸面具中的供氧剂,其反应中氧化剂与还原剂的物质的量之比为。(3)、某化学兴趣小组拟开展探究FeSO4溶液性质的实验。回答下列问题:①用绿矾(FeSO4· 7H2O)配制500mL 0.1mol/L的FeSO4溶液,需要用到的玻璃仪器除量筒、烧杯、玻璃棒外,还需使用(填仪器名称)。
②下列操作可能使所配溶液浓度偏大的是(填选项编号)。
A.未洗涤烧杯和玻璃棒
B.定容时俯视容量瓶的刻度线定容
C.配制溶液前容量瓶中有少量的蒸馏水
D.摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
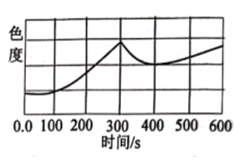
③FeSO4溶液露置在空气中颜色会加深,如图为该溶液露置在空气中,并在300s时加入10滴维生素C溶液,其色度(即颜色的色调和饱和度)随时间变化的图像,则维生素C导致溶液色度变化的原因是。
三、实验探究题
-
19. 某固体样品中含有杂质,为测定样品中的含量,某实验小组称取ag样品进行测定。回答下列问题:
 (1)、装置A中反应的化学方程式为;装置B的名称为。(2)、甲同学拟通过测定的质量来计算样品中含量,仪器的连接顺序为(每组装置仅使用一次)。(3)、乙同学拟选取A→C→B装置完成测定,则B装置中加入的试剂为。若C的质量变化为bg,则样品中的质量分数为。若无B装置会使测量结果(填“偏大”、“偏小”或“无影响”)。(4)、老师指出上述方案均会导致测定结果偏小,应将A装置更换为以下装置:
(1)、装置A中反应的化学方程式为;装置B的名称为。(2)、甲同学拟通过测定的质量来计算样品中含量,仪器的连接顺序为(每组装置仅使用一次)。(3)、乙同学拟选取A→C→B装置完成测定,则B装置中加入的试剂为。若C的质量变化为bg,则样品中的质量分数为。若无B装置会使测量结果(填“偏大”、“偏小”或“无影响”)。(4)、老师指出上述方案均会导致测定结果偏小,应将A装置更换为以下装置:
请说明原因。
20. 现有一不纯的小苏打样品(含杂质NaCl、Na2CO3·10H2O),为测定NaHCO3的质量分数,设计如图所示的实验装置(夹持仪器未画出)。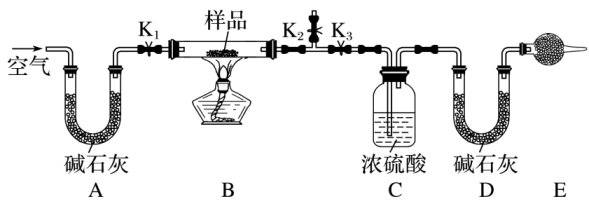
实验步骤如下:
①按图组装好实验装置并检查气密性。
②称取一定质量的样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2 , 关闭K3 , 缓缓鼓入空气数分钟。
④关闭活塞K1、K2 , 打开K3 , 点燃酒精灯加热至不再产生气体。
⑤打开活塞K1 , 缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C和U形管D的质量。
[资料]
i.浓硫酸常用于吸收水蒸气。
ii.碱石灰是固体氢氧化钠和氧化钙的混合物。
iii.Na2CO3·10H2ONa2CO3+10H2O↑。
回答下列问题:
(1)、仪器E的名称是 , 其中盛放的药品是;若无该装置,则会导致测得的NaHCO3的质量分数(填“偏大”“偏小”或“无影响”)。(2)、步骤③的目的是(3)、装置B中除反应Na2CO3·10H2ONa2CO3+10H2O↑外,还发生反应的化学方程式为。(4)、若实验中称取样品的质量为 50.0 g,反应后C、D装置增加的质量分别为12.6 g、8.8 g,则混合物中NaHCO3的质量分数为%(计算结果精确到0.1);若将等质量的该样品与足量稀硫酸混合,可得CO2的质量为g(计算结果精确到0.1)。