理综化学7+4二轮专题复习卷 专题十五 化学实验
试卷更新日期:2023-01-12 类型:二轮复习
一、单选题
-
1. 室温下,下列实验探究方案不能达到探究目的的是 ( )
选项
探究方案
探究目的
A
向盛有溶液的试管中滴加几滴溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化
具有还原性
B
向盛有水溶液的试管中滴加几滴品红溶液,振荡,加热试管,观察溶液颜色变化
具有漂白性
C
向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化
的氧化性比的强
D
用pH计测量醋酸、盐酸的pH,比较溶液pH大小
是弱电解质
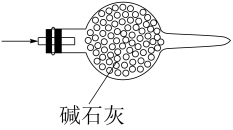
A、A B、B C、C D、D2. 实验室制取少量水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是 ( ) A、用装置甲制取气体 B、用装置乙制取水溶液 C、用装置丙吸收尾气中的 D、用干燥pH试纸检验水溶液的酸性3. 下列实验操作规范且能达到实验目的的是( )
A、用装置甲制取气体 B、用装置乙制取水溶液 C、用装置丙吸收尾气中的 D、用干燥pH试纸检验水溶液的酸性3. 下列实验操作规范且能达到实验目的的是( )选项
A
B
C
D
操作



实验目的
混合浓硫酸和乙醇
定容
干燥
分离碘和酒精
A、A B、B C、C D、D4. 某实验小组利用下图装置进行实验。下列说法错误的是( ) A、滴加浓盐酸时需将分液漏斗上端玻璃塞上的凹槽对准漏斗上的小孔 B、蘸有淀粉KI溶液的棉花变蓝,说明氯气的氧化性强于碘 C、蘸有品红溶液的棉花褪色,说明氯气具有漂白性 D、蘸有紫色石蕊溶液的棉花上出现的现象是棉花先变红后褪色5. 化学是以实验为基础的科学。下列实验设计正确的是( )
A、滴加浓盐酸时需将分液漏斗上端玻璃塞上的凹槽对准漏斗上的小孔 B、蘸有淀粉KI溶液的棉花变蓝,说明氯气的氧化性强于碘 C、蘸有品红溶液的棉花褪色,说明氯气具有漂白性 D、蘸有紫色石蕊溶液的棉花上出现的现象是棉花先变红后褪色5. 化学是以实验为基础的科学。下列实验设计正确的是( )选项
实验目的
实验设计
A
除去乙酸乙酯中的乙酸
加入NaOH溶液,振荡后分液
B
验证非金属性:O>S
向溶液中通入 , 观察溶液变浑浊
C
由溶液制备无水
将溶液加热蒸干
D
配制100mL一定物质的量浓度的NaOH溶液
准确称取NaOH固体,放入100mL的容量瓶中,加水溶解,振荡摇匀,定容
A、A B、B C、C D、D6. 下列说法错误的是( )A、用剩的药品能否放回原瓶,应视具体情况而定 B、在油脂制肥皂实验中,反应完全后加入热的饱和食盐水并搅拌,取上层物质加入新制悬浊液,可观察到溶液呈绛蓝色 C、制备摩尔盐时,应小火加热,蒸发浓缩至表面出现晶膜,自然冷却,得到产品 D、用稀酸性溶液检验火柴头燃烧时产生的二氧化硫7. 实验室从海带中提取碘的过程如下:
下列说法正确的是( )
A、步骤①④分别是灼烧、分液 B、海带中含有的硫酸盐在步骤②中实现与碘的分离 C、向反应液中通入过量实现步骤③ D、步骤⑤酸化时发生反应:二、实验探究题
-
8. 作为绿色氧化剂应用广泛,氢醌法制备原理及装置如下:

已知:、等杂质易使催化剂中毒。回答下列问题:
(1)、A中反应的离子方程式为。(2)、装置B应为(填序号)。 (3)、检查装置气密性并加入药品,所有活塞处于关闭状态。开始制备时,打开活塞 , 控温。一段时间后,仅保持活塞b打开,抽出残留气体。随后关闭活塞b,打开活塞 , 继续反应一段时间。关闭电源和活塞,过滤三颈烧瓶中混合物,加水萃取,分液,减压蒸馏,得产品。(4)、装置F的作用为。(5)、反应过程中,控温的原因为。(6)、氢醌法制备总反应的化学方程式为。(7)、取产品,加蒸馏水定容至摇匀,取于锥形瓶中,用酸性标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为、、。假设其他杂质不干扰结果,产品中质量分数为。9. 过二硫酸钾(K2S2O8)易潮解,易分解,是一种重要的氧化剂。某学习小组设计实验探究过二硫酸钾的性质。(1)、实验(一)探究过二硫酸钾的强氧化性。
(3)、检查装置气密性并加入药品,所有活塞处于关闭状态。开始制备时,打开活塞 , 控温。一段时间后,仅保持活塞b打开,抽出残留气体。随后关闭活塞b,打开活塞 , 继续反应一段时间。关闭电源和活塞,过滤三颈烧瓶中混合物,加水萃取,分液,减压蒸馏,得产品。(4)、装置F的作用为。(5)、反应过程中,控温的原因为。(6)、氢醌法制备总反应的化学方程式为。(7)、取产品,加蒸馏水定容至摇匀,取于锥形瓶中,用酸性标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为、、。假设其他杂质不干扰结果,产品中质量分数为。9. 过二硫酸钾(K2S2O8)易潮解,易分解,是一种重要的氧化剂。某学习小组设计实验探究过二硫酸钾的性质。(1)、实验(一)探究过二硫酸钾的强氧化性。用K2S2O8溶液与KI溶液反应,实验操作与现象如下表所示。
实验
操作
现象
Ⅰ
在10mL0.1mol/L含淀粉的KI溶液中滴加4mL0.1mol/LK2S2O8溶液
一段时间后,溶液缓慢变蓝色
Ⅱ
在10mL0.1mol/L含淀粉的KI溶液中先滴几滴0.1mol/LFeSO4溶液,再滴加4mL0.1 mol/LK2S2O8溶液
溶液迅速变蓝色
①用碰撞理论分析,实验Ⅰ中K2S2O8和KI反应很慢的主要原因是。
②实验Ⅱ中Fe2+起催化作用,总反应分两步进行:
(i)2Fe2+ +S2O=2Fe3++2SO;
(ii)。
请你补充反应( ii ) ,并设计实验证明实验Ⅱ反应后的溶液中含有Fe3+。
(2)、查阅文献知,氧化性:S2O> MnO。在稀硫酸酸化的MnSO4溶液中滴加1滴催化剂AgNO3溶液,再滴加K2S2O8溶液,实验现象是 , 该反应的离子方程式为。(3)、实验(二)探究过二硫酸钾的不稳定性。已知几种物质的熔、沸点如下表所示:
物质
SO3
SO2
O2
熔点/℃
16.8
-72.7
-218.4
沸点/℃
44.8
10
-182.9
取适量的K2S2O8装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D,实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
加热前,先通入一段时间N2 , 当观察到D装置中(填实验现象)时点燃酒精灯。
 (4)、B装置的U形管中收集到的物质是(填化学式)。(5)、当A装置的硬质玻璃管中固体完全分解时,停止加热。冷却至室温,然后取少量残留固体于试管中,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。写出A装置中K2S2O8发生分解的化学方程式。10. 利用Cl2氧化绿色K2MnO4浓强碱溶液制备KMnO4的装置如下图所示(加热、夹持装置略):
(4)、B装置的U形管中收集到的物质是(填化学式)。(5)、当A装置的硬质玻璃管中固体完全分解时,停止加热。冷却至室温,然后取少量残留固体于试管中,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。写出A装置中K2S2O8发生分解的化学方程式。10. 利用Cl2氧化绿色K2MnO4浓强碱溶液制备KMnO4的装置如下图所示(加热、夹持装置略):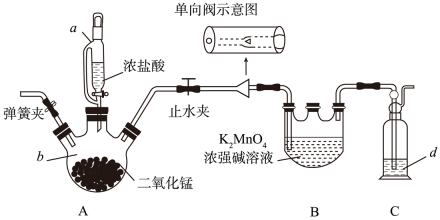 (1)、仪器b的名称为 , d中的溶液是。实验开始前向仪器a中加入水,盖好玻璃塞,关闭止水夹和弹簧夹,打开仪器a玻璃旋塞向b中滴加水,一段时间后看水能不能滴下,此操作(填“能”或“不能”)检验装置的气密性。(2)、装置B中Cl2氧化K2MnO4的化学方程式为。(3)、单向阀的作用是 , 当仪器B中即停止通氯气。(4)、当B中反应结束,后续操作是熄灭A处酒精灯,待冷却后拆除装置。(5)、锰酸钾(K2MnO4) 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: +MnO2↓+4OH-根据此信息,可以得出上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是。(6)、某兴趣小组同学用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某过氧化氢试样,反应原理为2+ 5H2O2 + 6H+ =2Mn2+ + 8H2O+5O2↑。用移液管移取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如表所示:
(1)、仪器b的名称为 , d中的溶液是。实验开始前向仪器a中加入水,盖好玻璃塞,关闭止水夹和弹簧夹,打开仪器a玻璃旋塞向b中滴加水,一段时间后看水能不能滴下,此操作(填“能”或“不能”)检验装置的气密性。(2)、装置B中Cl2氧化K2MnO4的化学方程式为。(3)、单向阀的作用是 , 当仪器B中即停止通氯气。(4)、当B中反应结束,后续操作是熄灭A处酒精灯,待冷却后拆除装置。(5)、锰酸钾(K2MnO4) 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: +MnO2↓+4OH-根据此信息,可以得出上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是。(6)、某兴趣小组同学用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某过氧化氢试样,反应原理为2+ 5H2O2 + 6H+ =2Mn2+ + 8H2O+5O2↑。用移液管移取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如表所示:第一次
第二次
第三次
第四次
17.30
17.90
18.00
18.10
计算试样中过氧化氢的浓度为mol·L-1 .
11. 高技术领域常使用高纯试剂。纯磷酸(熔点为 , 易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于易形成(熔点为),高于则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
回答下列问题:
(1)、A的名称是。B的进水口为(填“a”或“b”)。(2)、的作用是。(3)、空气流入毛细管的主要作用是防止 , 还具有搅拌和加速水逸出的作用。(4)、升高温度能提高除水速度,实验选用水浴加热的目的是。(5)、磷酸易形成过饱和溶液,难以结晶,可向过饱和溶液中加入促进其结晶。(6)、过滤磷酸晶体时,除了需要干燥的环境外,还需要控制温度为____(填标号)。A、 B、 C、(7)、磷酸中少量的水极难除去的原因是。