理综化学7+4二轮专题复习卷 专题十四 化学计算
试卷更新日期:2023-01-12 类型:二轮复习
一、单选题
-
1. 设为阿伏加德罗常数的值,下列说法正确的是( )A、1.8g含有的中子数为0.1 B、1L氨水中所含的数目为0.1 C、5.6g铁与足量稀盐酸反应、转移的电子数)0.3 D、124g(
 )分子中所含的共价键数目为6
2. 设为阿伏加德罗常数的值,下列说法正确的是( )A、溶液中含有的数为 B、中所含质子数为 C、和(均为标准状况)在光照下充分反应后的分子数为 D、1molNO与在密闭容器中充分反应后的分子数为3. 用惰性电极电解100mL4mol•L-1Cu(NO3)2溶液,一定时间后在阳极收集到标准状况下气体1.12L。停止电解,向电解后的溶液中加入足量的铁粉,充分反应后溶液中的Fe2+浓度为(设溶液的体积不变)( )A、0.75mol•L-1 B、3mol•L-1 C、4mol•L-1 D、3.75mol•L-14. 我国科学家进行了如图所示的碳循环研究。下列说法正确的是( )
)分子中所含的共价键数目为6
2. 设为阿伏加德罗常数的值,下列说法正确的是( )A、溶液中含有的数为 B、中所含质子数为 C、和(均为标准状况)在光照下充分反应后的分子数为 D、1molNO与在密闭容器中充分反应后的分子数为3. 用惰性电极电解100mL4mol•L-1Cu(NO3)2溶液,一定时间后在阳极收集到标准状况下气体1.12L。停止电解,向电解后的溶液中加入足量的铁粉,充分反应后溶液中的Fe2+浓度为(设溶液的体积不变)( )A、0.75mol•L-1 B、3mol•L-1 C、4mol•L-1 D、3.75mol•L-14. 我国科学家进行了如图所示的碳循环研究。下列说法正确的是( )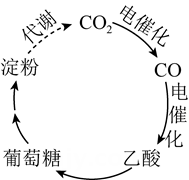 A、淀粉是多糖,在一定条件下能水解成葡萄糖 B、葡萄糖与果糖互为同分异构体,都属于烃类 C、 中含有 个电子 D、 被还原生成5. 对溶液氧化的反应,若加入 , 科研人员猜想其反应历程如下:
A、淀粉是多糖,在一定条件下能水解成葡萄糖 B、葡萄糖与果糖互为同分异构体,都属于烃类 C、 中含有 个电子 D、 被还原生成5. 对溶液氧化的反应,若加入 , 科研人员猜想其反应历程如下:Mn(VII)Mn(VI)Mn(IV)Mn(III)[Mn(C2O4)n]3-2n→Mn2++CO2
下列说法错误的是( )
A、既有氧化性,又有还原性 B、起始时加入 , 若反应产生气泡速率明显加快,可证明作催化剂 C、每生成标准状况下 , 消耗 D、加入某种试剂使Mn(Ⅵ)、Mn(Ⅳ)或Mn(Ⅲ)生成难溶物,若产生气泡速率减慢,则证明该猜想合理6. 氯磺酸是一种易水解的一元强酸,能与甲酸、苯等有机物反应。其与甲酸发生的反应为。下列说法错误的是( )A、将物质的量相等的与HCl分别溶于水制成1L溶液,前者的pH小 B、可与苯在一定条件下发生取代反应生成苯磺酸 C、中和溶液需要 D、与甲酸反应中每生成1mol HCl,转移电子的物质的量为2mol7. 将、组成的混合物投入适量稀硝酸中恰好反应,固体完全溶解时收集到唯一还原产物气体(标准状况),向反应后溶液中加入一定量的溶液,金属离子恰好沉淀完全。则形成沉淀质量为( )A、 B、 C、 D、二、综合题
-
8. 丙烯是重要的有机合成原料。由丙烷制备丙烯是近年来研究的热点,主要涉及如下反应。
反应i:
反应ii:
回答下列问题:
(1)、反应: △H3=。(2)、在刚性绝热容器中发生反应i,下列能说明已达到平衡状态的有____(填标号)。A、每断裂1 mol O=O键,同时生成4 molO-H键 B、容器内温度不再变化 C、混合气体的密度不再变化 D、n(C3H8)=n(C3H6)(3)、在压强恒定为100 kPa条件下,按起始投料n(C3H8):n(O2)=2:1,匀速通入装有催化剂的反应器中发生反应i和反应ii,其中不同温度下丙烷和氧气的转化率如图。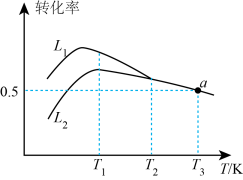
①线(填“L1”或“L2”)表示丙烷的转化率。
②温度高于T1K后曲线L2随温度升高而降低的原因为。
③当温度高于(填“T1”或“T2”)时,可判断反应ii不再发生,a点对应的温度下,丙烯的分压p(C3H6)=kPa(保留3位有效数字,下同),反应i的平衡常数。(已知:分压p分=总压×该组分物质的量分数,对于反应 , , 其中、、、为反应平衡时各组分的分压)
(4)、丙烷在碳纳米材料上脱氢的反应机理如图。
已知三步反应的活化能:反应I>反应III>反应II。则催化过程的决速反应为(填“反应I”“反应II”或“反应III”)。
9. 油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:(1)、已知下列反应的热化学方程式:①
②
③
计算热分解反应④的。
(2)、较普遍采用的处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解。相比克劳斯工艺,高温热分解方法的优点是 , 缺点是。(3)、在、反应条件下,将的混合气进行热分解反应。平衡时混合气中与的分压相等,平衡转化率为 , 平衡常数。(4)、在、反应条件下,对于分别为、、、、的混合气,热分解反应过程中转化率随时间的变化如下图所示。
①越小,平衡转化率 , 理由是。
②对应图中曲线 , 计算其在之间,分压的平均变化率为。
10. 二草酸合铜(Ⅱ)酸钾()可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:Ⅰ.取已知浓度的溶液,搅拌下滴加足量溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸()溶液中加入适量固体,制得和混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至80~85 ℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)、由配制Ⅰ中的溶液,下列仪器中不需要的是(填仪器名称)。 (2)、长期存放的中,会出现少量白色固体,原因是。(3)、Ⅰ中的黑色沉淀是(写化学式)。(4)、Ⅱ中原料配比为 , 写出反应的化学方程式。(5)、Ⅱ中,为防止反应过于剧烈而引起喷溅,加入应采取的方法。(6)、Ⅲ中应采用进行加热。(7)、Ⅳ中“一系列操作”包括。11. 环氧乙烷(
(2)、长期存放的中,会出现少量白色固体,原因是。(3)、Ⅰ中的黑色沉淀是(写化学式)。(4)、Ⅱ中原料配比为 , 写出反应的化学方程式。(5)、Ⅱ中,为防止反应过于剧烈而引起喷溅,加入应采取的方法。(6)、Ⅲ中应采用进行加热。(7)、Ⅳ中“一系列操作”包括。11. 环氧乙烷( , 别称EO)是重要的杀菌剂和工业合成原料。回答下列问题: (1)、(一)乙烯直接氧化法:
, 别称EO)是重要的杀菌剂和工业合成原料。回答下列问题: (1)、(一)乙烯直接氧化法:反应Ⅰ:
 (g)
(g) 反应Ⅱ:
乙烯与在a、b两种催化剂作用下发生反应,催化剂的催化活性(用EO%衡量)及生成EO的选择性(用EO选择性%表示)与温度(T)的变化曲线如图一所示。

①依据图给信息,选择制备环氧乙烷的适宜条件为。
②M点后曲线下降的原因为。
③下列说法正确的有(填标号)。
A.催化剂的选择性越高,其达到最高反应活性所需的温度越高
B.催化剂的催化活性与温度成正比
C.不同催化剂达到最高活性时的温度不同
(2)、设为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以。反应Ⅰ、Ⅱ对应的随(温度的倒数)的变化如图二所示。
①0(填“>”或“<”)。
②在T℃的恒温、恒容密闭容器中,按体积分数充入反应混合气体:乙烯30%、氧气7%,其余混合气63%(致稳气),发生反应Ⅰ(忽略反应Ⅱ)。平衡时体系压强为2000kPa,乙烯的转化率为 , 则T℃下反应Ⅰ的相对压力平衡常数。
(3)、(二)电化学合成法科学家利用、水合成环氧乙烷,有利于实现碳中和。总反应为:
 , 该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
, 该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
①电解槽1中阴极的电极反应式为。
②图四虚线框中发生的反应为:、、。