理综化学7+4二轮专题复习卷 专题十一 非金属元素及其化合物
试卷更新日期:2023-01-12 类型:二轮复习
一、单选题
-
1. 氮及其化合物的转化具有重要应用。下列说法错误的是( )A、自然固氮、人工固氮都是将转化为 B、侯氏制碱法以、、、为原料制备和 C、工业上通过催化氧化等反应过程生产 D、多种形态的氮及其化合物间的转化形成了自然界的“氮循环”2. 北京冬奥会备受世界瞩目。下列说法错误的是( )A、冰壶主材料花岗岩属于无机非金属材料 B、火炬“飞扬”使用的碳纤维属于有机高分子材料 C、冬奥会“同心”金属奖牌属于合金材料 D、短道速滑服使用的超高分子量聚乙烯属于有机高分子材料3. 实验室制取少量水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是 ( )
 A、用装置甲制取气体 B、用装置乙制取水溶液 C、用装置丙吸收尾气中的 D、用干燥pH试纸检验水溶液的酸性4. 在高温高压下可转变为具有一定导电性、高硬度的非晶态碳玻璃。下列关于该碳玻璃的说法错误的是( )A、具有自范性 B、与互为同素异形体 C、含有杂化的碳原子 D、化学性质与金刚石有差异5. 下列说法正确的是( )A、O2和O3互为同素异形体 B、淀粉(C6H10O5)n和纤维素(C6H10O5)n互为同分异构体 C、14C和14N互为同位素 D、
A、用装置甲制取气体 B、用装置乙制取水溶液 C、用装置丙吸收尾气中的 D、用干燥pH试纸检验水溶液的酸性4. 在高温高压下可转变为具有一定导电性、高硬度的非晶态碳玻璃。下列关于该碳玻璃的说法错误的是( )A、具有自范性 B、与互为同素异形体 C、含有杂化的碳原子 D、化学性质与金刚石有差异5. 下列说法正确的是( )A、O2和O3互为同素异形体 B、淀粉(C6H10O5)n和纤维素(C6H10O5)n互为同分异构体 C、14C和14N互为同位素 D、 和
和 互为同系物
6. 下列说法错误的是( )A、呈粉色的变色硅胶干燥剂(含氯化钴),可通过烘干至蓝色后重新使用 B、如果不慎将苯酚沾到皮肤上,应立即先用酒精洗涤,再用水冲洗 C、测定镀锌铁皮锌镀层厚度时,未及时将铁片从稀硫酸中取出,会导致结果偏高 D、移液管和滴定管均标有使用温度,使用时均应进行检漏、润洗再装液7. 部分含硫物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
互为同系物
6. 下列说法错误的是( )A、呈粉色的变色硅胶干燥剂(含氯化钴),可通过烘干至蓝色后重新使用 B、如果不慎将苯酚沾到皮肤上,应立即先用酒精洗涤,再用水冲洗 C、测定镀锌铁皮锌镀层厚度时,未及时将铁片从稀硫酸中取出,会导致结果偏高 D、移液管和滴定管均标有使用温度,使用时均应进行检漏、润洗再装液7. 部分含硫物质的分类与相应化合价关系如图所示。下列推断不合理的是( ) A、a可与c反应生成b B、c既可被氧化,也可被还原 C、b在足量的氧气中充分燃烧可生成d D、可存在a→b→c→d→f的转化关系
A、a可与c反应生成b B、c既可被氧化,也可被还原 C、b在足量的氧气中充分燃烧可生成d D、可存在a→b→c→d→f的转化关系二、综合题
-
8. 实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收Cu并制备纳米ZnO的部分实验过程如图所示:
 (1)、在“溶解”步骤中,提高铜帽溶解速率的措施(例举两种)。(2)、有同学提出溶解步骤中可在酸性条件下不断鼓入并加热,这种情况下,铜发生溶解的离子方程式为。(3)、“过滤”步骤中使用的玻璃仪器有。(4)、生成的沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是。(5)、在封闭的高温电炉中焙烧,焙烧后的ZnO粉末用去离子水洗净,再用乙醇洗涤3次,减压过滤,干燥,得到纯净的纳米级ZnO。用乙醇洗涤的目的是。(6)、有同学提出用纯碱代替溶液,在实际生产中得到的是一种碱式碳酸锌[],取该样品6.82g,充分灼烧后测得残留物质量为4.86g,将所得气体通入足量澄清石灰水中,得到2.00g沉淀,则此碱式碳酸锌的化学式是。9. 氯化亚砜(SOCl2)常用作脱水剂。某校科研小组拟以Cl2、S2Cl2、ClSO3H(氯磺酸)为原料合成SOCl2并探究其相关性质,制备装置如图所示。有关物质的部分性质见表。
(1)、在“溶解”步骤中,提高铜帽溶解速率的措施(例举两种)。(2)、有同学提出溶解步骤中可在酸性条件下不断鼓入并加热,这种情况下,铜发生溶解的离子方程式为。(3)、“过滤”步骤中使用的玻璃仪器有。(4)、生成的沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是。(5)、在封闭的高温电炉中焙烧,焙烧后的ZnO粉末用去离子水洗净,再用乙醇洗涤3次,减压过滤,干燥,得到纯净的纳米级ZnO。用乙醇洗涤的目的是。(6)、有同学提出用纯碱代替溶液,在实际生产中得到的是一种碱式碳酸锌[],取该样品6.82g,充分灼烧后测得残留物质量为4.86g,将所得气体通入足量澄清石灰水中,得到2.00g沉淀,则此碱式碳酸锌的化学式是。9. 氯化亚砜(SOCl2)常用作脱水剂。某校科研小组拟以Cl2、S2Cl2、ClSO3H(氯磺酸)为原料合成SOCl2并探究其相关性质,制备装置如图所示。有关物质的部分性质见表。物质
熔点/℃
沸点/℃
其他性质
SOCl2
-105
78.8
易水解,温度高于150℃分解
ClSO3H
-80
156
具有强吸水性,不易分解
S2Cl2
-77
138
遇水即反应

回答下列问题:
(1)、装置A中可能的试剂是(选填数字编号)。①MnO2和盐酸
②KMnO4和浓盐酸
③漂白粉和浓盐酸
④浓硫酸与NaCl
(2)、装置D中盛放的试剂是 , 装置E的作用是。(3)、将SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3 , 试解释原因。(4)、小明同学认为SOCl2也可与FeCl3·6H2O混合制取无水FeCl3 , 但小强同学认为可能会发生副反应使最后的产品不纯,可能产生的杂质微粒是;为验证猜想,可选择的试剂是(选填数字编号)。①BaCl2溶液、稀盐酸
②Ba(NO3)2溶液、稀HNO3
③KSCN溶液
④K3[Fe(CN)6]溶液
(5)、若硫元素全部转化到目标产物中,在50℃下C中发生反应的化学方程式为;反应结束后,利用如图所示装置将C中混合物分离,毛细玻璃管的作用是。 10. 磷酸氢二铵[]常用于干粉灭火剂。某研究小组用磷酸吸收氢气制备 , 装置如图所示(夹持和搅拌装置已省略)。
10. 磷酸氢二铵[]常用于干粉灭火剂。某研究小组用磷酸吸收氢气制备 , 装置如图所示(夹持和搅拌装置已省略)。
回答问题:
(1)、实验室用和制备氨气的化学方程式为。(2)、现有浓质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的溶液,则需浓mL(保留一位小数)。(3)、装置中活塞的作用为。实验过程中,当出现现象时,应及时关闭 , 打开。(4)、当溶液pH为8.0~9.0时,停止通 , 即可制得溶液。若继续通入 , 当时,溶液中、和(填离子符号)浓度明显增加。(5)、若本实验不选用pH传感器,还可选用作指示剂,当溶液颜色由变为时,停止通。11. 某课外小组探究含Cu2+的盐与Na2S2O3溶液的反应。查阅资料:
i.2+Cu2+[Cu(S2O3)2]2-(绿色),2+Cu+[Cu(S2O3)2]3-(无色);
ii.相比较 , Cu+更易与NH3络合为[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+(蓝色);
iii. 易被氧化为。
提出假设:
假设1:Cu2+与在溶液中发生络合反应生成[Cu(S2O3)2]2-;
假设2:Cu2+与在溶液中发生氧化还原反应。
实验探究一:探究CuSO4与Na2S2O3溶液的反应。
实验操作
序号
V1/mL
V2/mL
逐滴加入Na2S2O3溶液时的实验现象
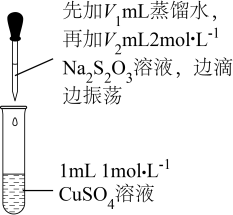
a
1.5
0.5
溶液逐渐变为绿色,静置无变化
b
1.0
1.0
溶液先变为绿色,后逐渐变成浅绿色,静置无变化
c
0
x
溶液先变为绿色,后逐渐变浅至无色,静置无变化
(1)、假设2的推测是因为Cu2+具有性。实验c中x=。(2)、根据实验a的现象可推测溶液中生成的含Cu微粒为(填化学符号)。(3)、某同学认为上述实验探究一可证明假设2成立,判断理由为。实验探究二:探究CuCl2与Na2S2O3溶液的反应。
 (4)、经检验白色沉淀为CuCl,从化学平衡的角度解释继续加Na2S2O3溶液后CuCl沉淀溶解的原因:。(5)、设计实验证明上述无色溶液中存在Cu+:。(6)、经检验氧化产物以形式存在。写出Cu2+与发生氧化还原反应得到无色溶液的离子方程式:。(7)、综合上述实验,可得出假设成立,试分析随着n():n(Cu2+)变化时,反应的趋势为。
(4)、经检验白色沉淀为CuCl,从化学平衡的角度解释继续加Na2S2O3溶液后CuCl沉淀溶解的原因:。(5)、设计实验证明上述无色溶液中存在Cu+:。(6)、经检验氧化产物以形式存在。写出Cu2+与发生氧化还原反应得到无色溶液的离子方程式:。(7)、综合上述实验,可得出假设成立,试分析随着n():n(Cu2+)变化时,反应的趋势为。