理综化学7+4二轮专题复习卷 专题十 化学键与物质结构
试卷更新日期:2023-01-12 类型:二轮复习
一、单选题
-
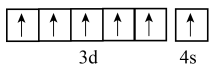
1. 亚铁氰化铁又名普鲁士蓝,化学式为 , 是一种配位化合物,可以用来上釉、用作油画染料等。下列有关普鲁士蓝构成微粒的符号表征正确的是( )A、基态的价电子排布图为
 B、氮原子的结构示意图为
B、氮原子的结构示意图为 C、的电子式为
D、阴离子的结构式为
C、的电子式为
D、阴离子的结构式为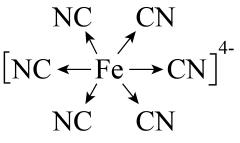 2. 在高温高压下可转变为具有一定导电性、高硬度的非晶态碳玻璃。下列关于该碳玻璃的说法错误的是( )A、具有自范性 B、与互为同素异形体 C、含有杂化的碳原子 D、化学性质与金刚石有差异3. 某立方卤化物可用于制作光电材料,其晶胞结构如图所示。下列说法错误的是( )
2. 在高温高压下可转变为具有一定导电性、高硬度的非晶态碳玻璃。下列关于该碳玻璃的说法错误的是( )A、具有自范性 B、与互为同素异形体 C、含有杂化的碳原子 D、化学性质与金刚石有差异3. 某立方卤化物可用于制作光电材料,其晶胞结构如图所示。下列说法错误的是( ) A、的配位数为6 B、与距离最近的是 C、该物质的化学式为 D、若换为 , 则晶胞棱长将改变4. 磷酰三叠氮是一种高能分子,结构简式为。下列关于该分子的说法正确的是( )A、为非极性分子 B、立体构型为正四面体形 C、加热条件下会分解并放出 D、分解产物的电子式为5. 短周期元素X、Y 、Z的原子序数依次减小,三者组成的化合物M(组成中阴、阳离子个数比为1:3,其中阴离子的结构如图)常用作冶炼铝的助熔剂,X是地壳中含量最多的金属元素,Z无正价。下列说法正确的是( )
A、的配位数为6 B、与距离最近的是 C、该物质的化学式为 D、若换为 , 则晶胞棱长将改变4. 磷酰三叠氮是一种高能分子,结构简式为。下列关于该分子的说法正确的是( )A、为非极性分子 B、立体构型为正四面体形 C、加热条件下会分解并放出 D、分解产物的电子式为5. 短周期元素X、Y 、Z的原子序数依次减小,三者组成的化合物M(组成中阴、阳离子个数比为1:3,其中阴离子的结构如图)常用作冶炼铝的助熔剂,X是地壳中含量最多的金属元素,Z无正价。下列说法正确的是( ) A、简单离子半径:X>Z> Y B、化合物YZ中只含共价键 C、Y和Z的单质都能与水反应产生气体 D、X、Y的单质分别与氧气化合均只得到一种产物6. 下列物质所属晶体类型分类正确的是( )
A、简单离子半径:X>Z> Y B、化合物YZ中只含共价键 C、Y和Z的单质都能与水反应产生气体 D、X、Y的单质分别与氧气化合均只得到一种产物6. 下列物质所属晶体类型分类正确的是( )选项
A
B
C
D
共价晶体
石墨
生石灰
碳化硅
金刚石
分子晶体
冰
固态氨
氯化铯
干冰
离子晶体
氮化铝
食盐
明矾
芒硝
金属晶体
铜
汞
铝
铁
A、A B、B C、C D、D7. 据相关资料报道,一种新型漂白剂M(如图)可用于漂白羊绒、羽毛等,其中W、Y、Z为不同周期不同主族元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布均与Ne原子相同。下列叙述错误的是( ) A、M的漂白原理与相同 B、是一种弱酸 C、W、X元素的简单离子半径相比,W简单离子的半径大 D、M中部分原子未达到8电子稳定结构
A、M的漂白原理与相同 B、是一种弱酸 C、W、X元素的简单离子半径相比,W简单离子的半径大 D、M中部分原子未达到8电子稳定结构二、综合题
-
8. John B.Goodenough等三位科学家因在发展锂离子电池方面做出的贡献而获得了诺贝尔化学奖。回答下列问题:(1)、锰酸锂( LiMn2O4)电池具有原料成本低合成工艺简单等优点。原子中运动的电子有两种相反的身旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋磁量子数。对于基态Li原子,其核外电子自旋磁量子数的代数和为。基态 Mn原子核外价层电子的运动状态有种。(2)、锂离子电池的电解液一般为溶有LiPF6的碳酸酯类有机溶剂,LiPF6遇水反应生成PF3和POF , PF中心原子的价层电子对数为 , POF3的空间构型为。 下列对PF5中心原子杂化方式的推断合理的是(填字母)。
A.sp2 B.sp3 C.sp3d D.sp3d2
(3)、三元正极材料LiCNjMnO2掺杂Al3+可使其性能更优,第三电离能:Fe(填“大于”或“小于”)Mn,原因是。(4)、链化锂被认为是很有潜力的正极材料,晶胞结构如图所示。
①晶施可以看作是由铋原子构成的面心立方晶格,锂原子填充在其中的四面体和八面体空隙处,晶体的化学式为。
②图中原子坐标参数:A为(0,0,0),B为(1,0.5,1),则C的坐标为 , Bi与Li(1)和Li(2)之间的最短距离的比值为。
9. Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用,请回答下列问题:(1)、Fe元素属于元素周期表的 区(填分区)(2)、基态Ni2+核外电子排布式为。(3)、鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M的结构如图甲所示。
①组成M的5中元素中,除H元素外,另外4种元素第一电离能由大到小的顺序为(填元素符号),其中C原子的杂化类型为。
②图中各微粒不存在的作用力有 ( 填标号)
a. 极性键 b.非极性键 c. 配位键
d. π键 e.离子键 f.氢键
(4)、一种铁氮化合物具有高磁导率,可用于制电子元件,其晶胞结构如图乙所示。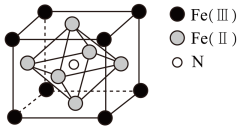
①铁氮化合物的化学式为。
②在该晶胞结构的另一种表示中,N处于顶点位置,则铁处于、位置
③若该化合物密度为pg·cm-3 , 用NA表示阿伏加德罗常数,则由Fe( II )构成的正八面体的体积为cm3
10. 回答下列问题:(1)、氨基酸锌是研究最早和使使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图是氨基酸锌的结构简式。
①组成氨基酸锌的C、N、O的第一电离能由大到小的顺序是。
②最简单的氨基酸是甘氨酸(结构简式如图),其结构中π键与σ键的数量比为。
 (2)、分于中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界。
(2)、分于中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界。
①配合物中每个中心离子的配位数为。
②Co2+的最高能层电子排布式为。
③下列状态的钴中,电离最外层一个电子所需能量最大的是(填标号)
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
(3)、二氯甲醛的结构简式为 , 已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是。 (4)、碳酸亚乙酯(
, 已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是。 (4)、碳酸亚乙酯( )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因。 (5)、化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn , 如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+ , 即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱。(6)、氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。晶胞中距离最近的两个O2-之间的距离为apm,MnO晶体的密度为ρg·cm-3 , 则阿伏加德罗常数的值为(用含a和ρ的最简代数式表示)。
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因。 (5)、化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn , 如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+ , 即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱。(6)、氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。晶胞中距离最近的两个O2-之间的距离为apm,MnO晶体的密度为ρg·cm-3 , 则阿伏加德罗常数的值为(用含a和ρ的最简代数式表示)。 11. 张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用.氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题:
11. 张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用.氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题: (1)、As原子的核外电子排布式为 .(2)、P和S是同一周期的两种元素,P的第一电离能比S大,原因是 .(3)、NH4+中H﹣N﹣H的键角比NH3中H﹣N﹣H的键角(填“大”或“小”),原因是 .(4)、Na3AsO4中含有的化学键类型包括;AsO43﹣的空间构型为 , As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是 .(5)、化合物NH5中的所有原子最外层都满足稳定结构,则NH5是晶体.(6)、白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子).已知晶胞的边长为a cm,阿伏加德罗常数为NA mol﹣l , 则该晶胞中含有的P原子的个数为 , 该晶体的密度为 g•cm﹣3(用含NA、a的式子表示).
(1)、As原子的核外电子排布式为 .(2)、P和S是同一周期的两种元素,P的第一电离能比S大,原因是 .(3)、NH4+中H﹣N﹣H的键角比NH3中H﹣N﹣H的键角(填“大”或“小”),原因是 .(4)、Na3AsO4中含有的化学键类型包括;AsO43﹣的空间构型为 , As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是 .(5)、化合物NH5中的所有原子最外层都满足稳定结构,则NH5是晶体.(6)、白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子).已知晶胞的边长为a cm,阿伏加德罗常数为NA mol﹣l , 则该晶胞中含有的P原子的个数为 , 该晶体的密度为 g•cm﹣3(用含NA、a的式子表示).