理综化学7+4二轮专题复习卷 专题九 电化学
试卷更新日期:2023-01-12 类型:二轮复习
一、单选题
-
1. 某水处理剂由纳米铁粉附着在多孔炭粉的表面复合而成,利用原电池原理处理弱酸性废水中的NO3-时,其表面发生如图所示反应。下列说法正确的是( )
 A、电池工作时,H+向负极移动 B、正极附近溶液的酸性增强 C、负极电极式:Fe-3e-=Fe3+ D、与单独使用纳米铁粉相比,该水处理剂能加快NO3-的除去速率2. 某储能电池原理如图。下列说法正确的是( )
A、电池工作时,H+向负极移动 B、正极附近溶液的酸性增强 C、负极电极式:Fe-3e-=Fe3+ D、与单独使用纳米铁粉相比,该水处理剂能加快NO3-的除去速率2. 某储能电池原理如图。下列说法正确的是( ) A、放电时负极反应: B、放电时透过多孔活性炭电极向中迁移 C、放电时每转移电子,理论上吸收 D、充电过程中,溶液浓度增大3. 如图,c管为上端封口的量气管,为测定乙酸溶液浓度,量取待测样品加入b容器中,接通电源,进行实验。下列说法正确的是( )
A、放电时负极反应: B、放电时透过多孔活性炭电极向中迁移 C、放电时每转移电子,理论上吸收 D、充电过程中,溶液浓度增大3. 如图,c管为上端封口的量气管,为测定乙酸溶液浓度,量取待测样品加入b容器中,接通电源,进行实验。下列说法正确的是( ) A、左侧电极反应: B、实验结束时,b中溶液红色恰好褪去 C、若c中收集气体 , 则样品中乙酸浓度为 D、把盐桥换为U形铜导线,不影响测定结果4. 电化学广泛应用于工业领域。下列叙述正确的是( )A、电解精炼铜时,与电源正极相连的是精铜 B、锌铜原电池产生电流时,溶液中的阳离子移向Zn电极 C、用惰性电极电解足量的饱和食盐水时,阳极的电极反应式: D、外接电源保护海水中钢闸门时,应将钢闸门与电源的正极相连5. 科学家近年发明了一种新型水介质电池。电池示意图如下,电极为金属锌和选择性催化材料。放电时,温室气体被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法正确的是( )
A、左侧电极反应: B、实验结束时,b中溶液红色恰好褪去 C、若c中收集气体 , 则样品中乙酸浓度为 D、把盐桥换为U形铜导线,不影响测定结果4. 电化学广泛应用于工业领域。下列叙述正确的是( )A、电解精炼铜时,与电源正极相连的是精铜 B、锌铜原电池产生电流时,溶液中的阳离子移向Zn电极 C、用惰性电极电解足量的饱和食盐水时,阳极的电极反应式: D、外接电源保护海水中钢闸门时,应将钢闸门与电源的正极相连5. 科学家近年发明了一种新型水介质电池。电池示意图如下,电极为金属锌和选择性催化材料。放电时,温室气体被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法正确的是( ) A、放电时,负极区pH升高 B、放电时,1mol转化为HCOOH,转移的电子数为4mol C、充电时,Zn电极连电源正极 D、充电时,产生22.4L(标准状况下) , 生成的Zn为130g6. 我国有着丰富的海风资源,在海水中建立风电设备,防腐蚀是一个突出问题。下列说法正确的是( )
A、放电时,负极区pH升高 B、放电时,1mol转化为HCOOH,转移的电子数为4mol C、充电时,Zn电极连电源正极 D、充电时,产生22.4L(标准状况下) , 生成的Zn为130g6. 我国有着丰富的海风资源,在海水中建立风电设备,防腐蚀是一个突出问题。下列说法正确的是( ) A、钢铁构件表面的镀铜破损后依然会保护内部钢铁不被腐蚀 B、可将钢铁构件与电源负极连接臧缓腐蚀发生 C、钢铁发生吸氧腐蚀时负极发生的反应为 D、海水中发生化学腐蚀的速率大于电化学腐蚀速率7. 某科研小组利用下图装置完成乙炔转化为乙烯的同时为用电器供电。其中锌板处发生的反应有:①;②;③。下列说法错误的是( )
A、钢铁构件表面的镀铜破损后依然会保护内部钢铁不被腐蚀 B、可将钢铁构件与电源负极连接臧缓腐蚀发生 C、钢铁发生吸氧腐蚀时负极发生的反应为 D、海水中发生化学腐蚀的速率大于电化学腐蚀速率7. 某科研小组利用下图装置完成乙炔转化为乙烯的同时为用电器供电。其中锌板处发生的反应有:①;②;③。下列说法错误的是( ) A、电极a的电势高于电极b的电势 B、放电过程中正极区KOH溶液浓度保持不变 C、电极a上发生的电极反应式为 D、电解足量溶液,理论上消耗2.24L(标准状况)时,生成6.4gCu
A、电极a的电势高于电极b的电势 B、放电过程中正极区KOH溶液浓度保持不变 C、电极a上发生的电极反应式为 D、电解足量溶液,理论上消耗2.24L(标准状况)时,生成6.4gCu二、实验探究题
-
8. 绿水青山和金山银山绝不是对立的,关键在人,关键在思路。消除NOx、CO、SO2等大气污染物对建设美丽环境具有重要意义。(1)、工业上常用氨水吸收法处理尾气中的SO2 , 已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+2NH3·H2O(aq)=(NH4)2SO3(aq)+H2O(l) △H1
②(NH4)2SO3(aq)+SO2(g)+H2O(l)=2NH4HSO3(aq) △H2
③2NH4HSO3(aq)+2NH3·H2O+O2(g)=2(NH4)2SO4(aq)+2H2O(l) △H3
则2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=。
(2)、工业上可将SO2和NO2混合转化,反应为SO2(g)+NO2(g)SO3(g)+NO(g) △H<0,进而制取硫酸。欲使该反应的速率增大且平衡逆向移动,改变的反应条件为。一定温度下,能判断该反应已达到化学平衡状态的是(填字母)。A.SO3和NO的浓度比保持不变
B.混合气体的颜色保持不变
C.容器中压强不再变化
D.恒容混合气体的密度保持不变
(3)、NO和NO2尾气可用碱液吸收,生成的可用电化学原理降解,原理如图所示,则阴极为(填a或b),电极反应式为。 (4)、利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g)N2(g)+2CO2(g) △H<0。实验测得v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2),k正、k逆为速率常数,只与温度有关。
(4)、利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g)N2(g)+2CO2(g) △H<0。实验测得v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2),k正、k逆为速率常数,只与温度有关。①达到平衡后,仅升高温度,k正增大的倍数(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,总压为a,在一定温度下达到平衡时,CO的转化率为50%,则=;在t1min时再向容器内加入1molCO和1molNO,保持温度不变,则再次达平衡时NO的转化率(填“增大”“减小”或“不变”)。整个过程中容器中的气压(P)与反应时间(t)的关系曲线如图所示,则用平衡分压代替平衡浓度表示的压强平衡常数Kp=。
 9. 2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:(1)、在一定温度下,向体积固定的密闭容器中加入足量的 和 ,起始压强为 时,发生下列反应生成水煤气:
9. 2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:(1)、在一定温度下,向体积固定的密闭容器中加入足量的 和 ,起始压强为 时,发生下列反应生成水煤气:Ⅰ.
Ⅱ.
①下列说法正确的是;
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时 的体积分数可能大于
D.将炭块粉碎,可加快反应速率
②反应平衡时, 的转化率为 , 的物质的量为 。此时,整个体系(填“吸收”或“放出”)热量 ,反应Ⅰ的平衡常数 (以分压表示,分压=总压×物质的量分数)。
(2)、一种脱除和利用水煤气中 方法的示意图如下:
①某温度下,吸收塔中 溶液吸收一定量的 后, ,则该溶液的 (该温度下 的 );
②再生塔中产生 的离子方程式为;
③利用电化学原理,将 电催化还原为 ,阴极反应式为。
10. 稀土( )包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下: 
已知:月桂酸 熔点为 ;月桂酸和 均难溶于水。该工艺条件下,稀土离子保持 价不变; 的 ; 开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子
开始沉淀时的pH
8.8
1.5
3.6
6.2~7.4
沉淀完全时的pH
/
3.2
4.7
/
(1)、“氧化调pH”中,化合价有变化的金属离子是。(2)、“过滤1”前,用 溶液调pH至的范围内,该过程中 发生反应的离子方程式为。(3)、“过滤2”后,滤饼中检测不到 元素,滤液2中 浓度为 。为尽可能多地提取 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中 低于 (保留两位有效数字)。(4)、①“加热搅拌”有利于加快 溶出、提高产率,其原因是。②“操作X”的过程为:先 , 再固液分离。
(5)、该工艺中,可再生循环利用的物质有(写化学式)。(6)、稀土元素钇(Y)可用于制备高活性的合金类催化剂 。①还原 和 熔融盐制备 时,生成
 转移 电子。
转移 电子。② 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化 的还原,发生的电极反应为。
11. 苯乙酸铜是合成优良催化剂、传感材料纳米氧化铜的重要前驱体之一、下面是它的一种实验室合成路线: +H2O+H2SO4
+H2O+H2SO4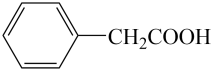 +NH4HSO4
+NH4HSO4 +Cu(OH)2
+Cu(OH)2 +H2O
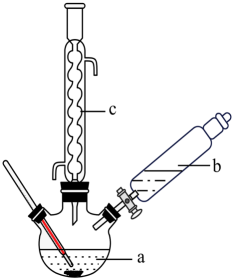
+H2O制备苯乙酸的装置示意图(加热和夹持装置等略):
已知:苯乙酸
 的熔点为76.5℃,微溶于冷水,溶于乙醇。 具体步骤:
的熔点为76.5℃,微溶于冷水,溶于乙醇。 具体步骤:i.在250mL三颈烧瓶a中加入70mL70%的硫酸。
ii.将a中的溶液加热至100℃,缓缓滴加40g苯乙腈(
 )到过量硫酸溶液中,然后升温至130℃继续反应。反应结束后加适量冷水,再分离出苯乙酸粗品。
)到过量硫酸溶液中,然后升温至130℃继续反应。反应结束后加适量冷水,再分离出苯乙酸粗品。iii.将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。回答下列问题:
(1)、配制70%硫酸时,加入蒸馏水与浓硫酸的先后顺序是:先加 的后加。(2)、在装置中,仪器b的名称是 ; 仪器c的作用是。反应分离苯乙酸粗品时,加适量冷水的目的是。(3)、下列仪器中可用于分离苯乙酸粗品的是____ (填标号)。A、分液漏斗 B、漏斗 C、烧杯 D、直形冷凝管 E、玻璃棒(4)、最终得到41 g苯乙酸晶体,则苯乙酸的产率是% (结果保留小数点后两位数字)(5)、写出用CuCl2·2H2O和NaOH溶液制备Cu(OH)2沉淀的化学方程式:。(6)、某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置电解CuCl2·2H2O溶液,该电池的负极反应式为。