理综化学7+4二轮专题复习卷 专题八 盐的水解和难容电解质的溶解平衡
试卷更新日期:2023-01-12 类型:二轮复习
一、单选题
-
1. 一种捕集烟气中CO2的过程如图所示。室温下以0.1mol∙L-1KOH溶液吸收CO2 , 若通入CO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含碳物种的浓度c总=c(H2CO3)+c()+c()。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。下列说法正确的是 ( )
 A、KOH吸收CO2所得到的溶液中:c(H2CO3)>c() B、KOH完全转化为K2CO3时,溶液中:c(OH-)= c(H+)+c()+c(H2CO3) C、KOH溶液吸收CO2 , c总=0.1mol∙L-1溶液中:c(H2CO3)>c() D、如图所示的“吸收”“转化”过程中,溶液的温度下降2. 甘氨酸是人体必需氨基酸之一、在时,、和的分布分数【如】与溶液关系如图。下列说法错误的是( )
A、KOH吸收CO2所得到的溶液中:c(H2CO3)>c() B、KOH完全转化为K2CO3时,溶液中:c(OH-)= c(H+)+c()+c(H2CO3) C、KOH溶液吸收CO2 , c总=0.1mol∙L-1溶液中:c(H2CO3)>c() D、如图所示的“吸收”“转化”过程中,溶液的温度下降2. 甘氨酸是人体必需氨基酸之一、在时,、和的分布分数【如】与溶液关系如图。下列说法错误的是( )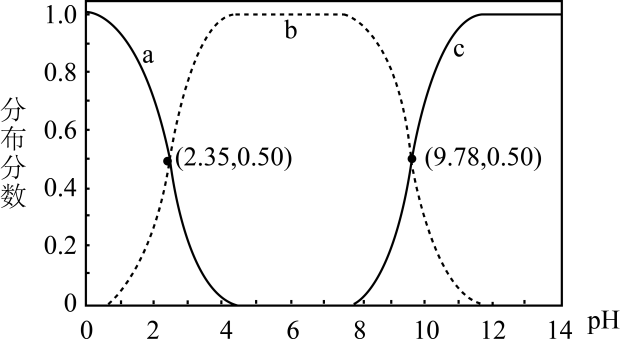 A、甘氨酸具有两性 B、曲线c代表 C、的平衡常数 D、3. 难溶盐MA在水中溶解为吸热过程,其沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A、甘氨酸具有两性 B、曲线c代表 C、的平衡常数 D、3. 难溶盐MA在水中溶解为吸热过程,其沉淀溶解平衡曲线如图所示。下列说法错误的是( )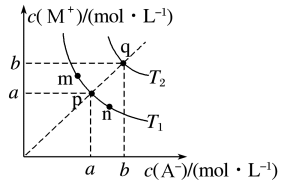 A、图中温度 B、温度下,值为 C、在温度下,加适量的NaA固体可使饱和溶液由p点变到n点 D、向q点的饱和溶液中滴加NaA溶液,立即析出MA沉淀4. 次磷酸()是一种一元弱酸,与等浓度等体积的NaOH完全反应后生成 , 下列叙述错误的是( )A、的水溶液加水稀释,增大 B、溶液中存在电离平衡: C、溶液中: D、溶液中存在:5. 常温下,将溶液滴加到20mL二元弱酸溶液中,混合溶液的pH随NaOH溶液滴入量的关系如图所示。下列叙述错误的是( )
A、图中温度 B、温度下,值为 C、在温度下,加适量的NaA固体可使饱和溶液由p点变到n点 D、向q点的饱和溶液中滴加NaA溶液,立即析出MA沉淀4. 次磷酸()是一种一元弱酸,与等浓度等体积的NaOH完全反应后生成 , 下列叙述错误的是( )A、的水溶液加水稀释,增大 B、溶液中存在电离平衡: C、溶液中: D、溶液中存在:5. 常温下,将溶液滴加到20mL二元弱酸溶液中,混合溶液的pH随NaOH溶液滴入量的关系如图所示。下列叙述错误的是( ) A、 B、b点时溶液中存在 C、c点时溶液中存在 D、溶液中水的电离程度:c>b>a6. 硫代碳酸钠能用于处理废水中的重金属离子,可通过如下反应制备: , 下列说法正确的是( )A、不能被氧化 B、溶液显碱性 C、该制备反应是熵减过程 D、的热稳定性比的高7. 根据酸碱质子理论,给出质子的物质是酸,给出质子的能力越强,酸性越强。已知: , , 下列酸性强弱顺序正确的是( )A、 B、 C、 D、
A、 B、b点时溶液中存在 C、c点时溶液中存在 D、溶液中水的电离程度:c>b>a6. 硫代碳酸钠能用于处理废水中的重金属离子,可通过如下反应制备: , 下列说法正确的是( )A、不能被氧化 B、溶液显碱性 C、该制备反应是熵减过程 D、的热稳定性比的高7. 根据酸碱质子理论,给出质子的物质是酸,给出质子的能力越强,酸性越强。已知: , , 下列酸性强弱顺序正确的是( )A、 B、 C、 D、二、实验探究题
-
8. 稀土(
 )包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下: 
已知:月桂酸 熔点为 ;月桂酸和 均难溶于水。该工艺条件下,稀土离子保持 价不变; 的 ; 开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子
开始沉淀时的pH
8.8
1.5
3.6
6.2~7.4
沉淀完全时的pH
/
3.2
4.7
/
(1)、“氧化调pH”中,化合价有变化的金属离子是。(2)、“过滤1”前,用 溶液调pH至的范围内,该过程中 发生反应的离子方程式为。(3)、“过滤2”后,滤饼中检测不到 元素,滤液2中 浓度为 。为尽可能多地提取 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中 低于 (保留两位有效数字)。(4)、①“加热搅拌”有利于加快 溶出、提高产率,其原因是。②“操作X”的过程为:先 , 再固液分离。
(5)、该工艺中,可再生循环利用的物质有(写化学式)。(6)、稀土元素钇(Y)可用于制备高活性的合金类催化剂 。①还原 和 熔融盐制备 时,生成
 转移 电子。
转移 电子。② 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化 的还原,发生的电极反应为。
9. 铬及其化合物在催化、金属防腐等方面具有重要应用。(1)、催化剂 可由 加热分解制备,反应同时生成无污染气体。①完成化学方程式: 。
② 催化丙烷脱氢过程中,部分反应历程如图1, 过程的焓变为(列式表示)。

③ 可用于 的催化氧化。设计从 出发经过3步反应制备 的路线(用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为。
(2)、 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(ⅰ)
(ⅱ)
①下列有关 溶液的说法正确的有。
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量 溶液,反应(ⅰ)的平衡逆向移动
D.加入少量 固体,平衡时 与 的比值保持不变
② 时, 溶液中 随pH的变化关系如图2。当 时,设 、 与 的平衡浓度分别为x、y、z ,则x、y、z之间的关系式为 ;计算溶液中 的平衡浓度(写出计算过程,结果保留两位有效数字)。

③在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长( )有关;在一定波长范围内,最大A对应的波长( )取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究pH对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、 不同的 稀溶液,测得其A随 的变化曲线如图3。波长 、 和 中,与 的 最接近的是;溶液 从a变到b的过程中, 的值(填“增大”“减小”或“不变”)。
10. 对氯苯氧乙酸是一个常用的植物生长调节剂,俗称“防落素”,可以减少农作物或瓜果蔬菜的落花落果,有明显的增产作用。其实验原理为:实验步骤:①在反应器中,加入氯乙酸和5mL水,开始搅拌,慢慢滴加饱和碳酸钠溶液,至溶液的为7~8,然后加入2.5g苯酚,再慢慢滴加35%氢氧化钠溶液至;

②将反应器置于油浴中缓慢加热,维持此温度;
③移去油浴,用浓盐酸调 , 析出固体,抽滤,水洗2~3次,再用乙醇溶液洗涤,得到粗产品;
④加入少量三氯化铁和浓盐酸,升温至 , 滴加双氧水,反应 , 升温使固体溶解,慢慢冷却,析出固体,抽滤,洗涤,重结晶。
完成下列问题:
(1)、装置中A的名称是 , 球形冷凝管的出水口是(填“a”或“b”)(2)、步骤②中采用油浴加热,不采用直接加热的原因是(3)、步骤④升温至 , 温度不宜过低也不宜过高的主要原因是(4)、用乙醇溶液洗涤粗产品的目的是(5)、步骤③和④均涉及抽滤,下列关于抽滤的说法中正确的是____ A、抽滤的主要目的是得到较多的沉淀 B、滤纸的直径应略小于漏斗内径,又能盖住全部小孔 C、图中没有明显出错 D、抽滤结束,从吸滤瓶的支管口倒出滤液(6)、步骤④中加入浓盐酸的目的是 , 有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是11. 为检验溶液中是否含有Cl- , 某同学采用向溶液中先加HNO3 , 再加AgNO3 , 若有白色沉淀生成,则证明有Cl-。对此结论,有人提出了质疑,溶液中可能有SO , 设计了如下探究性实验。(1)、实验一:向Na2SO4溶液中滴加AgNO3溶液
A、抽滤的主要目的是得到较多的沉淀 B、滤纸的直径应略小于漏斗内径,又能盖住全部小孔 C、图中没有明显出错 D、抽滤结束,从吸滤瓶的支管口倒出滤液(6)、步骤④中加入浓盐酸的目的是 , 有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是11. 为检验溶液中是否含有Cl- , 某同学采用向溶液中先加HNO3 , 再加AgNO3 , 若有白色沉淀生成,则证明有Cl-。对此结论,有人提出了质疑,溶液中可能有SO , 设计了如下探究性实验。(1)、实验一:向Na2SO4溶液中滴加AgNO3溶液编号
Na2SO4溶液
AgNO3溶液
现象
体积
mL
浓度
mol·L−1
体积
滴
浓度
mol·L−1
混合后Ag+浓度mol·L−1
①
1
1
3
2
0.2
出现大量白色沉淀
②
1
1
3
0.5
0.05
出现少量白色沉淀
③
1
1
3
0.1
0.01
有些许浑浊
④
1
1
3
0.01
0.001
无明显变化
实验一中产生沉淀的离子方程式为。
(2)、已知:25℃时Ksp(Ag2SO4)=1.2×10-5 , Ksp(AgCl)=1.8×10-10实验一中编号④无明显变化,若要产生浑浊,溶液中c(SO)理论上至少达到mol·L−1。若向l mL某浓度的NaCl与Na2SO4混合溶液中加入3滴0.1mol·L−1AgNO3溶液,分析上面数据,判断下列说法正确的是(填字母序号)。
A.混合液中c(SO)=1mol·L−1时不会产生Ag2SO4沉淀
B.混合液中c(SO)=0.1 mol·L−1时不会产生Ag2SO4沉淀
C.无论SO浓度大小都会产生Ag2SO4沉淀
D.若使用0.01 mol·L−1AgNO3溶液,可基本排除SO对Cl-检验构成的干扰
(3)、将实验一编号③中的理论计算结果与现象对照,发现理论上大部分Ag+应该形成沉淀,这与“有些许浑浊”的现象相矛盾。为探究真相,在实验一的基础上继续设计了以下实验。实验二:
编号
AgNO3浓度/mol·L−1
现象
滴加硝酸后的现象
①
2
出现大量白色沉淀
滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失
②
0.5
出现少量白色沉淀
滴加稀硝酸,沉淀基本消失
对于Ag2SO4溶于硝酸的原因提出了如下假设,请完成假设二。
假设一:NO对Ag2SO4溶解起作用。
假设二:。
(4)、选择适当试剂并设计实验方案,分别验证假设一和假设二是否成立。请写出实验步骤和现象。编号
操作
现象
结论
①
取少量Ag2SO4于试管中,加入2mL水,振荡
固体不溶解
②
将①的浊液分成两等份
③
向其中一份加入1mL0.1mol/L的NaNO3 , 振荡
假设一不成立
④
向另一份加入
假设二成立
(5)、通过(4)的实验,请用平衡理论解释Ag2SO4溶解的原因。(已知:H2SO4=H++HSO、HSOH++SO)。(6)、用硝酸银滴定法,可以测定水体中氯化物的含量。洗涤沉淀必须干燥后才能称量,沉淀完全干燥的判断方法是。