理综化学7+4二轮专题复习卷 专题六 化学反应速率和化学平衡
试卷更新日期:2023-01-12 类型:二轮复习
一、单选题
-
1. 某水处理剂由纳米铁粉附着在多孔炭粉的表面复合而成,利用原电池原理处理弱酸性废水中的NO3-时,其表面发生如图所示反应。下列说法正确的是( )
 A、电池工作时,H+向负极移动 B、正极附近溶液的酸性增强 C、负极电极式:Fe-3e-=Fe3+ D、与单独使用纳米铁粉相比,该水处理剂能加快NO3-的除去速率2. 实验室用盐酸和二氧化锰制备Cl2 , 有关说法正确的是( )A、增大盐酸的浓度能加快反应速率 B、用稀盐酸则反应速率较慢 C、增加MnO2的用量可显著加快反应速率 D、升高温度则减慢反应速率3. 利用合成气(CO和H2)在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g)+Q(Q>0),反应体系中CO的平衡转化率α(CO)与温度、压强的关系如图所示。下列说法错误的是( )
A、电池工作时,H+向负极移动 B、正极附近溶液的酸性增强 C、负极电极式:Fe-3e-=Fe3+ D、与单独使用纳米铁粉相比,该水处理剂能加快NO3-的除去速率2. 实验室用盐酸和二氧化锰制备Cl2 , 有关说法正确的是( )A、增大盐酸的浓度能加快反应速率 B、用稀盐酸则反应速率较慢 C、增加MnO2的用量可显著加快反应速率 D、升高温度则减慢反应速率3. 利用合成气(CO和H2)在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g)+Q(Q>0),反应体系中CO的平衡转化率α(CO)与温度、压强的关系如图所示。下列说法错误的是( ) A、升高温度,平衡常数减小 B、p1>p2>p3 C、在不同温度、压强下进行该反应,α(CO)不可能相等 D、若α(CO)=α(H2),则合成气中4. 实验室中模拟合成氨反应: N2((g)+3H2(g)
A、升高温度,平衡常数减小 B、p1>p2>p3 C、在不同温度、压强下进行该反应,α(CO)不可能相等 D、若α(CO)=α(H2),则合成气中4. 实验室中模拟合成氨反应: N2((g)+3H2(g)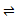 2NH3(g) 在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:
2NH3(g) 在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示: 实验序号
温度(
 )
) 浓度(
浓度( )
)


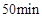

1
300
2.00
1.70
1.50
1.36
1.25
1.20
1.20
2
300
2.00
1.50
1.28
1.20
1.20
1.20
1.20
3
200
2.00
1.60
1.39
1.29
1.27
1.27
1.27
下列有关说法不正确的是( )
A、当容器内的压强不再改变时,说明该可逆反应已达到化学平衡状态 B、实验2中,前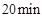 内以
内以 的浓度变化表示的化学反应速率为
的浓度变化表示的化学反应速率为 C、比较实验1和2,说明实验2使用了更高效的催化剂
D、实验3中,
C、比较实验1和2,说明实验2使用了更高效的催化剂
D、实验3中, 时向容器中充入一定量
时向容器中充入一定量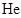 , 则正反应速率
, 则正反应速率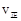 不变
5. 下列说法不正确的是( )A、非自发的反应一定可以通过改变条件使其成为自发反应 B、相同物质的量的同种物质气态时熵值最大,固态时熵值最小 C、反应
不变
5. 下列说法不正确的是( )A、非自发的反应一定可以通过改变条件使其成为自发反应 B、相同物质的量的同种物质气态时熵值最大,固态时熵值最小 C、反应 在室温下可自发进行,则该反应的
在室温下可自发进行,则该反应的 D、恒温恒压下,
D、恒温恒压下, 且
且 的反应正向能自发进行
6. 在密闭容器中,反应2X(g)+Y2(g)
的反应正向能自发进行
6. 在密闭容器中,反应2X(g)+Y2(g)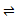 2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是( )
2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是( )  A、图Ⅰ中,甲、乙的平衡常数分别为
A、图Ⅰ中,甲、乙的平衡常数分别为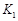 、
、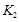 , 则
, 则 B、图Ⅱ中,平衡状态甲与乙的反应物转化率乙>甲
C、图Ⅱ中,t时刻可能是增大了压强
D、图Ⅲ表示反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
7. t ℃时,在体积不变的密闭容器中发生反应:X(g)+2Y(g) 2Z(g),各组分在不同时刻的浓度如下表:
B、图Ⅱ中,平衡状态甲与乙的反应物转化率乙>甲
C、图Ⅱ中,t时刻可能是增大了压强
D、图Ⅲ表示反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
7. t ℃时,在体积不变的密闭容器中发生反应:X(g)+2Y(g) 2Z(g),各组分在不同时刻的浓度如下表:物 质
X
Y
Z
初始浓度/(mol·L-1)
0.1
0.2
0
2 min末浓度/(mol·L-1)
0.08
a
b
平衡浓度/(mol·L-1)
0.05
0.05
0.1
下列说法正确的是( )
A、平衡时,X的转化率为50% B、t ℃时,该反应的平衡常数为40 C、平衡后增大体系的压强,v(正)增大,v(逆)减小,平衡向正反应方向移动 D、前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.04mol·L-1·min-1二、综合题
-
8. (四)丙烯(C3H6)是石油化工的基础有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等。制备方法如下:(1)、方法一 丙烷氧化脱氢法制备丙烯:C3H8(g)+1/2O2(g) C3H6(g)+H2O(g)(正反应放热)。在催化剂的作用下、相同的反应时间,C3H8的转化率和C3H6的产率随温度变化关系如图。

完成下列填空:
C3H8的转化率随温度升高而上升的原因是 , 写出一条提高C3H6产率的措施。
(2)、方法二 丙烷脱氢制备丙烯:C3H8(g)→C3H6(g)+H2(g)+Q kJ。已知:C3H8(g)→CH4(g)+C2H2(g)+H2(g)+a kJ;C3H6(g)→CH4(g)+C2H2(g)+b kJ
用含a、b的代数式表示Q=。
(3)、某温度下,在一恒容容器中充入C3H8 , 发生脱氢制丙烯反应,起始压强为10 kPa,平衡时总压强为14 kPa,C3H8的平衡转化率为。该反应的平衡常数Kp=kPa。(用平衡分压代替平衡浓度,分压=总压×物质的量分数)(4)、将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器发生脱氢反应:C3H8(g)→C3H6(g)+H2(g)。经相同时间,流出的c(C3H6)、c(CO)和c(H2)随初始c(CO2)的变化关系如图。结合化学方程式解释c(H2)和c(C3H6)变化差异的原因。
 (5)、一定条件下,CH3CH=CH2与HCl发生反应有①、②两种可能,反应进程中的能量变化如图。保持其他条件不变,若要提高产物中CH3CH2CH2Cl(g)的比例,可采用的措施是。
(5)、一定条件下,CH3CH=CH2与HCl发生反应有①、②两种可能,反应进程中的能量变化如图。保持其他条件不变,若要提高产物中CH3CH2CH2Cl(g)的比例,可采用的措施是。
a.适当提高反应温度 b.改变催化剂
c.适当降低反应温度 d.改变反应物浓度
9. (一)铁的常见化合价有+2、+3,在很强的氧化剂作用下也可形成不稳定的+6价高铁酸盐。实验室以FeCl2(aq)为原料制备高密度磁记录材料Fe/Fe3O4复合物,装置如图所示。在氩气气氛中,向装有50 mL 1 mol·L-1 FeCl2(aq)的三颈烧瓶中逐滴加入100 mL 14 mol·L-1 KOH(aq),100℃下搅拌回流3 h,得到成分为Fe和Fe3O4的黑色沉淀。待三颈烧瓶中的混合物冷却后,过滤,再依次用沸水和乙醇洗涤,40℃干燥后焙烧3 h,得到Fe/Fe3O4复合物产品 3.24 g。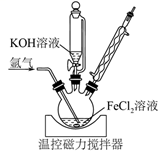
完成下列填空:
(1)、三颈烧瓶内发生反应的离子方程式为;检验反应是否进行完全的操作是。(2)、焙烧需在隔绝空气条件下进行,原因是。实验所得产品的产率为。(3)、FeCl3的晶体类型属于。(4)、向BaCl2(H+)中加入Ba(OH)2以除去杂质FeCl3 , 为使溶液中c(Fe3+)≤10-6 mol·L-1 , 则溶液中c(OH-)≥mol·L-1。用平衡移动原理解释除杂原理。10.(1)、下列物质中,属于电解质的是 , 属于强电解质的是 , 属于弱电解质的是(填序号)。①H2SO4 ②盐酸 ③硫酸钡 ④乙醇 ⑤铜 ⑥H2S ⑦蔗糖 ⑧氨气 ⑨NH4HSO3
(2)、甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,相关反应的热化学方程式及平衡常数如下所示:ⅰ.
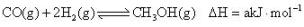 K1
K1ⅱ.
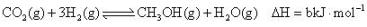 K2
K2ⅲ.
 K3
K3回答下列问题:
①a=(用b、c表示),则K1=(用K2、K3表示)。
②在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2和H2 , 在催化剂的作用下仅发生反应ⅲ.下列叙述能表示该反应达到平衡状态的是(填标号)。
a.容器中混合气体的压强不再改变
b.容器中CO、CO2的物质的量相等
c.容器中气体的密度不再改变
d.相同时间内,断裂H-O的数目是断裂H-H的2倍
(3)、在密闭容器中充入一定量的CO和NO气体,发生反应2CO(g)+2NO(g) ⇌ 2CO2(g)+N2(g)ΔH<0 ,如图为平衡时NO的体积分数与温度、压强的关系:
①温度:T1 T2 (填“>”、“<”或“=”)。
②若在D点对应容器升温,同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的点(填字母)。
11. 研究氮氧化物的性质具有重要的意义。(1)、 NO可以催化SO2与O2的反应:反应Ⅰ.2NO(g)+O2(g)2NO2(g) △H1=-114.1 kJ/mol
反应Ⅱ.SO2(g)+NO2(g)SO3(g)+NO(g) △H2=-41.6 kJ/mol
①下列说法正确的是:。
A.高温下有利于反应Ⅰ的自发进行
B.反应Ⅱ的△S对该反应的自发性影响不大
C.恒温恒容下加入一定量SO2和O2 , 若容器内压强没有明显变化,说明不加催化剂时,SO2和O2的反应不能自发进行
D.NO催化下,一定量SO2和O2反应一段时间后,升高温度,SO3的体积分数可能变大
②据报道,瑞典某工厂利用上述反应制取硫酸。在合成SO3时,向反应容器中适时通入冷激气(冷的原料气),其作用是
(2)、密闭容器中加入一定量NO2(g)和SO2(g),发生反应Ⅱ(忽略其它反应)。保持常压条件,经过相同时间,测得SO2的体积分数随温度的变化如图所示:①由图可知,在M点之前,反应中SO2的体积分数随温度升高而减小,其原因为:
②250℃和常压下,等物质的量的SO2和NO2反应后,测得平衡时NO的物质的量分数为40%,则该反应的物质的量分数平衡常数Kx=。(Kx是用平衡时物质的量分数代替平衡浓度计算)
③保持上述条件不变,提高原料中NO2的比例,使平衡时SO3的产率为90%。则NO2和SO2的投料比(即起始时加入的物质的量之比)为。
 (3)、在一定温度下,一定量N2O分解成氮气和氧气,同时释放出热量。分解的旁艇均调整据如下表。反应一段时间后,只改变如下一个条件。下列说法正确的是:
(3)、在一定温度下,一定量N2O分解成氮气和氧气,同时释放出热量。分解的旁艇均调整据如下表。反应一段时间后,只改变如下一个条件。下列说法正确的是:反应时间/ min
0
10
20
30
40
50
60
70
80
90
100
c(N2O)/mol·L-1
0.100
0.090
0.080
0.070
0.060
0.050
0.040
0.030
0.020
0.010
0.000
A、增大压强,N2O分解速率增大 B、增大容器的体积,该分解反应平衡右移,c(N2O)变小 C、减小N2O的浓度,该分解反应速率减小 D、升高温度,容器内气体的压强一定变大(4)、以固体催化剂催化CO还原NO生成N2和CO2气体,反应历程如下(*表示吸附态),请补充完整。化学吸附: NO(g) NO*;
表面反应: 2NO* ON-NO*;;
ON- NO- CO* ON-N* +CO2*;。
脱附: N2* N2(g); CO2* CO2(g)