理综化学7+4二轮专题复习卷 专题五 化学反应与能量
试卷更新日期:2023-01-12 类型:二轮复习
一、单选题
-
1. Ni可活化
 放出
放出 , 其反应历程如图所示。下列说法正确的是( )
, 其反应历程如图所示。下列说法正确的是( )  A、决速步骤:中间体1→中间体2 B、总反应为
A、决速步骤:中间体1→中间体2 B、总反应为
 kJ·mol
kJ·mol C、涉及非极性键的断裂和生成
D、在此反应过程中Ni的成键数目没有发生变化
2. 通过甲醇羧基化法获取甲酸甲酯(HCOOCH3):CH3OH(g)+CO(g)
C、涉及非极性键的断裂和生成
D、在此反应过程中Ni的成键数目没有发生变化
2. 通过甲醇羧基化法获取甲酸甲酯(HCOOCH3):CH3OH(g)+CO(g) HCOOCH3(g),在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图中实线所示(图中虚线表示相同条件下CO的平衡转化率随温度的变化),下列说法不正确的是( )
HCOOCH3(g),在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图中实线所示(图中虚线表示相同条件下CO的平衡转化率随温度的变化),下列说法不正确的是( ) 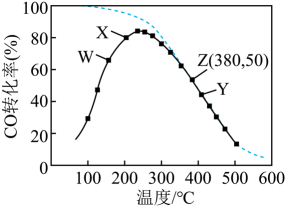 A、此制取甲酸甲酯的反应△H<0 B、图中X点,延长反应时间能提高CO转化率 C、图中W点,升高温度能提高CO转化率 D、380℃下,图中Z点,c起始(CH3OH)=5.0×10-4 mol/L,CO平衡转化率为50%,则平衡常数K(z)=20003. 如图所示为某储氢合金的吸氢过程,已知储氢合金在吸氢时放热。下列说法正确的是( )
A、此制取甲酸甲酯的反应△H<0 B、图中X点,延长反应时间能提高CO转化率 C、图中W点,升高温度能提高CO转化率 D、380℃下,图中Z点,c起始(CH3OH)=5.0×10-4 mol/L,CO平衡转化率为50%,则平衡常数K(z)=20003. 如图所示为某储氢合金的吸氢过程,已知储氢合金在吸氢时放热。下列说法正确的是( ) A、H2以分子形式存在于储氢合金中 B、储氢合金在吸氢时体系能量升高 C、β相金属氢化物的释氢过程不破坏化学键 D、利用储氢合金可制备超高纯H24. 下列有热量放出的过程是( )A、浓硫酸稀释 B、冰融化 C、石灰石高温分解 D、断开H2中的H-H键5. N2H4是一种高效清洁的火箭燃料,0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放 出133.5 kJ热量。下列热化学方程式正确的是( )A、
A、H2以分子形式存在于储氢合金中 B、储氢合金在吸氢时体系能量升高 C、β相金属氢化物的释氢过程不破坏化学键 D、利用储氢合金可制备超高纯H24. 下列有热量放出的过程是( )A、浓硫酸稀释 B、冰融化 C、石灰石高温分解 D、断开H2中的H-H键5. N2H4是一种高效清洁的火箭燃料,0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放 出133.5 kJ热量。下列热化学方程式正确的是( )A、 N2H4(g) +
N2H4(g) +  O2(g)=
O2(g)= N2(g) + H2O(g) ΔH= +267 kJ·mol-1
B、N2H4(g) + O2(g)=N2(g) + 2H2O(g) ΔH= -534 kJ·mol-1
C、N2H4(g) + O2(g)=N2(g) + 2H2O(g) ΔH= +534 kJ·mol-1
D、N2H4(g) + O2(g) N2(g) + 2H2O(l) ΔH= -133.5 kJ·mol-1
6. 已知:CH3CH2CH2·+HCl CH3CH2CH2+Cl··CH(CH3)2+HCl
N2(g) + H2O(g) ΔH= +267 kJ·mol-1
B、N2H4(g) + O2(g)=N2(g) + 2H2O(g) ΔH= -534 kJ·mol-1
C、N2H4(g) + O2(g)=N2(g) + 2H2O(g) ΔH= +534 kJ·mol-1
D、N2H4(g) + O2(g) N2(g) + 2H2O(l) ΔH= -133.5 kJ·mol-1
6. 已知:CH3CH2CH2·+HCl CH3CH2CH2+Cl··CH(CH3)2+HClCH3CH2CH2·+HBrCH3CH2CH2+Br··CH(CH3)2+HBr
下列说法正确的是: ( )
A、△H2>△H4 B、HCl和HBr的键能差可以表示为△H1-△H3 C、△H1=△H2+△H3-△H4 D、升温时,丙烷与Cl·反应速率加快,与Br·反应速率降低7. 天然气水蒸气转化法是目前获取H2 的主流方法,CH4 经过两步反应完全转化为H2 和CO2 , 其能量变化如图:
则总反应
 CH4 (g)+H2O(g)=
CH4 (g)+H2O(g)= CO2 (g)+2H2 (g) 的 ΔH 等于 ( )A、+82.7kJ·mol-1 B、+165.4kJ·mol-1 C、-82.7kJ·mol-1 D、-165.4kJ·mol-1
CO2 (g)+2H2 (g) 的 ΔH 等于 ( )A、+82.7kJ·mol-1 B、+165.4kJ·mol-1 C、-82.7kJ·mol-1 D、-165.4kJ·mol-1二、综合题
-
8. (四)丙烯(C3H6)是石油化工的基础有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等。制备方法如下:(1)、方法一 丙烷氧化脱氢法制备丙烯:C3H8(g)+1/2O2(g) C3H6(g)+H2O(g)(正反应放热)。在催化剂的作用下、相同的反应时间,C3H8的转化率和C3H6的产率随温度变化关系如图。

完成下列填空:
C3H8的转化率随温度升高而上升的原因是 , 写出一条提高C3H6产率的措施。
(2)、方法二 丙烷脱氢制备丙烯:C3H8(g)→C3H6(g)+H2(g)+Q kJ。已知:C3H8(g)→CH4(g)+C2H2(g)+H2(g)+a kJ;C3H6(g)→CH4(g)+C2H2(g)+b kJ
用含a、b的代数式表示Q=。
(3)、某温度下,在一恒容容器中充入C3H8 , 发生脱氢制丙烯反应,起始压强为10 kPa,平衡时总压强为14 kPa,C3H8的平衡转化率为。该反应的平衡常数Kp=kPa。(用平衡分压代替平衡浓度,分压=总压×物质的量分数)(4)、将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器发生脱氢反应:C3H8(g)→C3H6(g)+H2(g)。经相同时间,流出的c(C3H6)、c(CO)和c(H2)随初始c(CO2)的变化关系如图。结合化学方程式解释c(H2)和c(C3H6)变化差异的原因。
 (5)、一定条件下,CH3CH=CH2与HCl发生反应有①、②两种可能,反应进程中的能量变化如图。保持其他条件不变,若要提高产物中CH3CH2CH2Cl(g)的比例,可采用的措施是。
(5)、一定条件下,CH3CH=CH2与HCl发生反应有①、②两种可能,反应进程中的能量变化如图。保持其他条件不变,若要提高产物中CH3CH2CH2Cl(g)的比例,可采用的措施是。
a.适当提高反应温度 b.改变催化剂
c.适当降低反应温度 d.改变反应物浓度
9. 在2 L的密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:时间(s)
0
1
2
3
4
5
n(NO)(mol)
0.020
0.010
0.008
0.007
0.007
0.007
(1)、写出该反应的平衡常数表达式:K=。已知:K300℃>K350℃ , 则该反应是热反应。
(2)、下图表示NO2的变化的曲线是。用O2表示从0~2 s内该反应的平均速率v=。 (3)、能说明该反应已达到平衡状态的是。
(3)、能说明该反应已达到平衡状态的是。a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)、为使该反应的反应速率增大,且平衡向正反应方向移动的是。a.准时分别出NO2气体 b.适当上升温度 c.增大O2的浓度 d.选择高效催化剂
10. 与研究物质变化一样,研究化学反应中的能量变化同样具有重要意义。(1)、I.的有效回收利用能缓解能源危机。热化学循环还原制的原理如下图所示。
从循环结果看,能量转化的主要方式是。
(2)、在反应中循环使用,其作用是。(3)、II.已知二甲醚( , 常温下呈气态)、的燃烧热分别为1455、286。请写出表示二甲醚燃烧热的热化学方程式。
(4)、利用二甲醚可制取 , 总反应为。已知 , 则总反应的。总反应能自发进行的条件是。(5)、二甲醚制的总反应分两步完成:二甲醚水解: 活化能
甲醇与水蒸气重整: 活化能
已知远小于。在恒温恒容容器内,二甲醚与水按1∶3投料进行制氢,请在图中画出甲醇()浓度随时间变化的曲线图。
 11.(1)、Ⅰ.利用如图装置测定中和热的实验步骤如下:
11.(1)、Ⅰ.利用如图装置测定中和热的实验步骤如下:
①用量筒量取硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
回答下列问题:
实验过程中用到只量筒,只温度计,测定一组数据需要测定次温度。
(2)、经测定中和热。则中和热热化学方程式:。向的NaOH溶液中加入下列物质:①稀醋酸,②稀盐酸,③浓硫酸,恰好完全反应时对应的热效应、、的关系正确的是
A. B.
C. D.
(3)、Ⅱ.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。
a、b、c三点的电离程度大小关系:。
(4)、a、b、c三点溶液用溶液中和,消耗NaOH溶液体积大小关系:。