理综化学7+4二轮专题复习卷 专题三 氧化还原反应
试卷更新日期:2023-01-12 类型:二轮复习
一、单选题
-
1. 镀锌铁钉放入棕色的碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入 , 振荡,静置,液体分层。下列说法正确的是( )A、褪色原因为被还原 B、液体分层后,上层呈紫红色 C、镀锌铁钉比镀锡铁钉更易生锈 D、溶液恢复棕色的原因为被氧化2. 生活因化学更美好。以下生活用途和化学原理都正确且具有对应关系的是( )
选项
生活用途
化学原理
A
维生素C帮助人体将转化为易吸收的
维生素C具有还原性
B
葡萄酒中添加二氧化硫
二氧化硫具有漂白性
C
过氧化钠用作呼吸面具中的供氧剂
过氧化钠分解放出氧气
D
明矾可用作净水剂和消毒剂
铝离子水解生成氢氧化铝胶体
A、A B、B C、C D、D3. 已知溶于水发生电离。某工业制硼的有机合物的催化过程如下(其中R、Ln为基团,Pd为钯元素,X为卤素元素),下列说法正确的是( ) A、是三元酸 B、和微粒中原子周围都达到8个电子结构 C、LnPb是催化剂,
A、是三元酸 B、和微粒中原子周围都达到8个电子结构 C、LnPb是催化剂, 是中问产物
D、加入反应时,LnPd被氧化
4. 关于反应 , 下列说法正确的是( )A、为氧化产物 B、只发生还原反应 C、生成时,转移1mol电子 D、氧化产物与还原产物的物质的量之比为1:25. 关于反应 , 下列说法错误的是( )A、还原产物仅为KCl B、标准状况下,生成11.2L , 转移10mol电子 C、发生氧化反应 D、氧化剂与还原剂的物质的量之比为11:66. 高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下,可能用到的数据见下表。
是中问产物
D、加入反应时,LnPd被氧化
4. 关于反应 , 下列说法正确的是( )A、为氧化产物 B、只发生还原反应 C、生成时,转移1mol电子 D、氧化产物与还原产物的物质的量之比为1:25. 关于反应 , 下列说法错误的是( )A、还原产物仅为KCl B、标准状况下,生成11.2L , 转移10mol电子 C、发生氧化反应 D、氧化剂与还原剂的物质的量之比为11:66. 高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下,可能用到的数据见下表。
开始沉淀pH
1.9
4.2
6.2
沉淀完全pH
3.2
6.7
8.2
下列说法错误的是( )
A、固体X主要成分是和S;金属M为Zn B、浸取时,增大压强可促进金属离子浸出 C、中和调pH的范围为3.2~4.2 D、还原时,增大溶液酸度有利于Cu的生成7. 对溶液氧化的反应,若加入 , 科研人员猜想其反应历程如下:Mn(VII)Mn(VI)Mn(IV)Mn(III)[Mn(C2O4)n]3-2n→Mn2++CO2
下列说法错误的是( )
A、既有氧化性,又有还原性 B、起始时加入 , 若反应产生气泡速率明显加快,可证明作催化剂 C、每生成标准状况下 , 消耗 D、加入某种试剂使Mn(Ⅵ)、Mn(Ⅳ)或Mn(Ⅲ)生成难溶物,若产生气泡速率减慢,则证明该猜想合理二、综合题
-
8. 重晶石()作为原料制备金属钡及其他含钡化合物的方法如下图:

完成下列填空:
(1)、Ba在元素周期表中位于第族,最外层电子的电子云形状是。图中涉及的第二周期元素原子半径由大到小的顺序是 , 可以判断其中两种元素非金属性强弱的反应是(选填流程中的反应编号)。(2)、配平BaS与稀硝酸反应的化学方程式:。





检验溶液中BaS是否完全反应的方法是:取少量反应液,加入(填试剂),有黑色沉淀生成,则BaS未反应完全。
(3)、工业上,利用反应①②而不用BaS直接与稀硝酸反应制的原因是。(4)、元素的金属性:AlBa(选填“>”或“<”);已知:沸点Al>Ba,反应④在真空容器中可以发生的理由是。9. 锗是一种稀散金属,在光纤通信、航空航天等领域有广泛应用,模拟从氧化锌烟灰(成分有ZnO、ZnO·GeO2、FeO·GeO2、Fe2O3·GeO2、PbO等)中提取锗元素的流程图如下: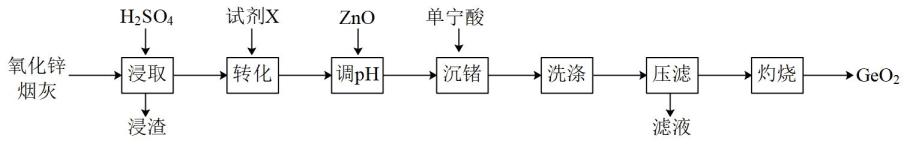
已知:①浸取后溶液pH为2,Ge以GeO2+的形式存在;
②单宁酸为复杂有机酸,易与Fe3+络合沉淀。
(1)、浸取时ZnO·GeO2发生反应的化学方程式是 , 浸渣的主要成分是。(2)、试剂X的作用是。(3)、下图为沉锗时溶液pH对锗沉淀率的影响,则适宜的pH应为____(填标号)。 A、1.0 B、2.0 C、2.5 D、3.0(4)、沉锗时有一段沉锗和二段沉锗两种工艺,单宁酸用量与锗沉淀率关系如表所示,工业常用二段沉锗工艺且单宁酸总用量为25倍,其原因是。
A、1.0 B、2.0 C、2.5 D、3.0(4)、沉锗时有一段沉锗和二段沉锗两种工艺,单宁酸用量与锗沉淀率关系如表所示,工业常用二段沉锗工艺且单宁酸总用量为25倍,其原因是。一段沉锗单宁酸总用量/倍
10
15
20
25
30
锗沉淀率/%
88.5
89.5
90.5
91.5
93.5
二段沉锗单宁酸总用量/倍
10
15
20
25
30
锗沉淀率/%
92
93.5
94.5
97
97.5
(5)、可从滤液中回收的金属元素主要有。(6)、若用C2H2O表示单宁酸,压滤后的含锗沉淀表示为GeO(C2H2O)2SO4 , 其在空气中灼烧会得到SO2、H2O、CO2三种气体,该反应方程式为。10. 用零价铁()去除含氮废水中的硝酸盐()是环境修复的重要方法。一种去除的过程如下。 (1)、Ⅱ中充分反应后,分离混合物的方法是。(2)、Ⅱ中反应的离子方程式是。(3)、实验发现,在Ⅱ中补充一定量的可以明显提高的去除率。向两份含氮废水[]中均加入足量粉,做对比研究。
(1)、Ⅱ中充分反应后,分离混合物的方法是。(2)、Ⅱ中反应的离子方程式是。(3)、实验发现,在Ⅱ中补充一定量的可以明显提高的去除率。向两份含氮废水[]中均加入足量粉,做对比研究。实验序号
ⅰ
ⅱ
所加试剂
粉
粉、()
的去除率
≈50%
≈100%
分析ⅱ中的去除率提高的原因:
a.直接还原了。
通过计算说明电子得、失数量关系: , 证明该原因不合理。
b.研究发现:(导电)覆盖在铁粉表面;随着反应的进行,产生(不导电),它覆盖在表面,形成钝化层,阻碍电子传输。
c.能与反应生成。
用做同位素示踪实验,证明该原因合理。
d.破坏钝化层。
将ⅱ中的替换为 , 的去除率约为50%,证明该原因不合理。
(4)、ⅰ、ⅱ中均能发生。该反应明显有助于ⅰ中的去除,结合方程式解释原因:。(5)、测定含量步骤1.取v含氮()水样,加入催化剂、标准溶液(过量),再加入稀。
步骤2.用标准溶液滴定剩余的(被还原为),终点时消耗。
已知:
①水样中的含量为。
②溶液中影响测定。向步骤1中加入适量 , 产生驱赶 , 否则会使测定结果(填“偏大”或“偏小”)。
11. 某小组同学探究不同条件下氯气与二价锰化合物的反应。资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、(绿色)、(紫色)。
ii.浓碱条件下,可被OH-还原为。
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)

序号
物质a
C中实验现象
通入Cl2前
通入Cl2后
I
水
得到无色溶液
产生棕黑色沉淀,且放置后不发生变化
II
5%NaOH溶液
产生白色沉淀,在空气中缓慢变成棕黑色沉淀
棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
III
40%NaOH 溶液
产生白色沉淀,在空气中缓慢变成棕黑色沉淀
棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
(1)、B中试剂是。(2)、通入Cl2前,II、III中沉淀由白色变为黑色的化学方程式为。(3)、对比实验I、II通入Cl2后的实验现象,对于二价锰化合物还原性的认识是。(4)、根据资料ii,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将氧化为。
①化学方程式表示可能导致溶液碱性减弱的原因 , 但通过实验测定溶液的碱性变化很小。
②取III中放置后的1 mL悬浊液,加入4 mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为 , 溶液绿色缓慢加深,原因是MnO2被(填“化学式”)氧化,可证明III的悬浊液中氧化剂过量;
③取II中放置后的1 mL悬浊液,加入4 mL水,溶液紫色缓慢加深,发生的反应是。
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因。