理综化学7+4二轮专题复习卷 专题二 离子反应
试卷更新日期:2023-01-12 类型:二轮复习
一、单选题
-
1. 宏观辨识与微观探析是化学学科核心素养之一、下列关于含N化合物的物质性质实验对应的反应方程式书写错误的是( )A、将过量氨气通入氯化铝溶液中: B、用浓氨水检验氯气管道是否泄漏: C、温度升高气体颜色加深: D、溶液显碱性:2. 下列各组离子在给定溶液中能大量共存的是( )A、在氨水中: B、在氯化钠溶液中: C、在醋酸溶液中: D、在硝酸银溶液中:3. 下列方程式与所给事实不相符的是( )A、加热固体,产生无色气体: B、过量铁粉与稀硝酸反应,产生无色气体: C、苯酚钠溶液中通入 , 出现白色浑浊:
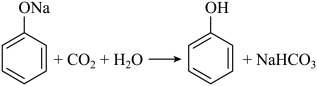 D、乙醇、乙酸和浓硫酸混合加热,产生有香味的油状液体:
4. 下列判断正确的是( )A、加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可确定原溶液中有Cl-存在 B、加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定原溶液中有CO32-存在 C、加入稀盐酸酸化的BaCl2溶液,生成白色沉淀,可确定原溶液中有SO42-存在 D、通入Cl2后,溶液由无色变为深黄色,加入淀粉溶液后,溶液变蓝,可确定原溶液中有I-存在5. 钒元素用途广泛,如图是一种钒的化合物催化某反应的反应机理。下列叙述错误的是( )
D、乙醇、乙酸和浓硫酸混合加热,产生有香味的油状液体:
4. 下列判断正确的是( )A、加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可确定原溶液中有Cl-存在 B、加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定原溶液中有CO32-存在 C、加入稀盐酸酸化的BaCl2溶液,生成白色沉淀,可确定原溶液中有SO42-存在 D、通入Cl2后,溶液由无色变为深黄色,加入淀粉溶液后,溶液变蓝,可确定原溶液中有I-存在5. 钒元素用途广泛,如图是一种钒的化合物催化某反应的反应机理。下列叙述错误的是( ) A、
A、 是该反应的催化剂
B、过程①②④中反应的原子利用率为100%
C、该催化循环中V的成键数目发生变化
D、该反应的离子方程式为:H2O2+Cl-+ H+= HOCl+ H2O
6. 海带中含有丰富的碘元素,某化学兴趣小组设计的海带提碘实验流程如下图,下列说法中正确的是( )
是该反应的催化剂
B、过程①②④中反应的原子利用率为100%
C、该催化循环中V的成键数目发生变化
D、该反应的离子方程式为:H2O2+Cl-+ H+= HOCl+ H2O
6. 海带中含有丰富的碘元素,某化学兴趣小组设计的海带提碘实验流程如下图,下列说法中正确的是( ) A、上述流程中各步操作用到的仪器包括:
A、上述流程中各步操作用到的仪器包括: 、
、 、
、 、
、 、
、 B、“氧化”时,试剂可选用O2、H2O2或Br2
C、上述流程包括三个氧化还原反应和三种分离操作
D、“反萃取”时,反应的离子方程式为I2+2OH-=I-+IO+H2O
7. 铍是航天、航空、电子和核工业等领域不可替代的材料,有“超级金属”之称。以绿柱石[]为原料制备金属铍的工艺如下:
B、“氧化”时,试剂可选用O2、H2O2或Br2
C、上述流程包括三个氧化还原反应和三种分离操作
D、“反萃取”时,反应的离子方程式为I2+2OH-=I-+IO+H2O
7. 铍是航天、航空、电子和核工业等领域不可替代的材料,有“超级金属”之称。以绿柱石[]为原料制备金属铍的工艺如下:
已知:750℃烧结时,与绿柱石作用生成易溶于水的 , “滤渣1”中含有铁、铝、硅的氧化物,难溶于水,可与过量结合成。下列说法正确的是( )
A、提高烧结后的水浸效率可以将烧结固体粉碎处理 B、对过滤1后的滤液中加入过量的NaOH溶液有利于Be元素的沉淀 C、“沉氟”反应的离子方程式为 D、工业上电解熔融混合物制备金属铍,在阳极析出金属铍二、综合题
-
8. 某炉渣主要成分有、、、MgO、CaO以及少量的。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

已知:“焙烧”中,、几乎不发生反应,、MgO、CaO、转化为相应的硫酸盐。在上述实验条件下,有关金属离子开始沉淀和沉淀完全的pH见下表。
金属离子
开始沉淀的pH
2.2
3.5
9.5
12.4
沉淀完全()的pH
3.2
4.7
11.1
13.8
回答下列问题:
(1)、产生的“尾气”是。(2)、在“分步沉淀”时先加氨水调节pH=5,此时过滤所得滤渣主要成分是;再向滤液中加入氨水调pH=11.4,此时“母液①”中的浓度为。(3)、“水浸渣”的主要成分为、和;“酸溶”时,转化为进入溶液,则发生反应的化学方程式为。(4)、“酸溶”后,将溶液适当稀释并加热,“水解”生成沉淀,该反应的离子方程式是。9. 碘化钾常用作合成有机化合物的原料。某实验小组设计实验探究KI的还原性。(1)、I.配制KI溶液配制500mL的KI溶液,需要称取KI的质量为g。
(2)、下列关于配制KI溶液的操作错误的是____(填序号)。A、 B、
B、 C、
C、 D、
D、 (3)、II.探究不同条件下空气中氧气氧化KI的速率。
(3)、II.探究不同条件下空气中氧气氧化KI的速率。组别
温度
KI溶液
溶液
蒸馏水
淀粉溶液
c(KI)
V
V
1
298K
5mL
5mL
10mL
3滴
2
313K
mL
5mL
10mL
3滴
3
298K
10mL
5mL
5mL
3滴
酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为。
(4)、通过实验组别1和组别2探究温度对氧化速率的影响。其中a= , b=。(5)、设计实验组别3的目的是。(6)、III.探究反应“”为可逆反应。试剂:KI溶液,溶液,淀粉溶液,溶液,KSCN溶液。实验如下:

甲同学通过试管i和试管ii中现象结合可证明该反应为可逆反应,则试管i中现象为;乙同学认为该现象无法证明该反应为可逆反应,原因为。
(7)、请选择上述试剂重新设计实验,证明该反应为可逆反应:。10. 随着人们对晒的性质深入认识及产品硒的纯度提高,硒的应用范围越来越广。某科学小组以含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)为原料提取硒,设计的流程如图:
回答下列问题:
(1)、“脱硫”时,测得脱硫率随温度的变化如图,最佳温度是。 (2)、“氧化酸浸”中,Se转化成H2SeO3(Ka1=2.7×10-3),H2SeO3的化学名称为 , 该反应的离子方程式为。(3)、采用催化剂联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。如表是“氧化酸浸”液中主要粒子的电位。
(2)、“氧化酸浸”中,Se转化成H2SeO3(Ka1=2.7×10-3),H2SeO3的化学名称为 , 该反应的离子方程式为。(3)、采用催化剂联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。如表是“氧化酸浸”液中主要粒子的电位。名称
Cu2+/Cu
Zn2+/Zn
Fe2+/Fe
Fe3+/Fe2+
ClO2/Cl-
H2SeO3/Se
电位/V
0.345
-0.760
-0.440
0.770
1.511
0.740
①控制电位在0.740-1.511V范围内,在氧化酸浸液中添加催化剂,可选择性还原ClO2 , 该过程的还原反应(半反应)式为。
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在V以上。
(4)、粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)])→Na2S净化→H2SO4酸化等。①净化后的溶液中c(Na2S)达到0.026mol·L-1 , 此时溶液中的c(Cu2+)的最大值为mol·L-1 , 精硒中基本不含铜。([Ksp(CuS)=1.3×10-36])
②硒代硫酸钠酸化生成硒的离子方程式为。
(5)、H2SeO4在水溶液中的电离方程式如下:H2SeO4=H++HSeO , HSeOH++SeO。已知0.01mol·L-1H2SeO4溶液的pH为x,则K(HSeO)=(写出含x的表达式)。11. 硫酸锌()是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用.硫酸锌可由菱锌矿制备.菱锌矿的主要成分为 , 杂质为以及、、、等的化合物.其制备流程如下: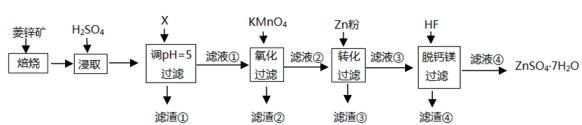
本题中所涉及离子的氯氧化物溶度积常数如下表:
离子
回答下列问题:
(1)、菱锌矿焙烧生成氧化锌的化学方程式为。(2)、为了提高锌的浸取效果,可采取的措施有、。(3)、加入物质X调溶液pH=5,最适宜使用的X是(填标号)。
A.B.C.滤渣①的主要成分是、、。
(4)、向的滤液①中分批加入适量溶液充分反应后过滤,滤渣②中有 , 该步反应的离子方程式为。(5)、滤液②中加入锌粉的目的是。(6)、滤渣④与浓反应可以释放并循环利用,同时得到的副产物是、。