九年级科学2022年寒假每日一练:第二章解答题专练1
试卷更新日期:2023-01-12 类型:复习试卷
一、解答题
-
1. 绵阳西北部山区石灰石资源非常丰富,大量用于生产水泥。用石灰石和砂岩粘土高温煅烧得到一种新型水泥熟料,主要反应为:(1)、上述反应涉及四类化合物中的哪几类?。(2)、 的化学式可表示为 , 含的水泥熟料中含的质量分数为。(3)、在实验室下图所小方法粗略测定石灰石中的质量分数,无需测定的数据是___________(填序号)。
 A、取用石灰石样品的质量 B、倒入的过量稀盐酸的质量 C、盐酸接触样品前电子秤的读数 D、反应停止后电子秤的读数(4)、用含的石灰石生产新型水泥熟料,理论上会排放多少吨?(无计算过程不给分)2. 建知识网络是一种重要的学习方法。图为某同学绘制的铁的化学性质网络示意图。
A、取用石灰石样品的质量 B、倒入的过量稀盐酸的质量 C、盐酸接触样品前电子秤的读数 D、反应停止后电子秤的读数(4)、用含的石灰石生产新型水泥熟料,理论上会排放多少吨?(无计算过程不给分)2. 建知识网络是一种重要的学习方法。图为某同学绘制的铁的化学性质网络示意图。 (1)、反应①通过在高温下与反应,把铁矿石中的铁元素变成单质,此反应利用了的性;(2)、反应②导致每年有大量的钢铁锈蚀,为阻止该反应的发生,人们常采用在钢铁表面涂刷油漆或镀上其它金属等方法。它们的共同原理是阻止钢铁与周围环境中等物质接触;生产中还通常将镍、铬等金属熔合在铁中制成不锈钢,改变其内部结构,达到防止铁制品生锈的目的,这说明了一个重要的道理,即(选填“①物质的性质决定用途”或“②物质的结构决定性质”)。(3)、早在西汉时期,我国劳动人民就利用铁与硫酸铜溶液反应制取铜,称为“湿法炼铜”,即反应③,若用该方法制得铜32千克,理论上需要消耗铁多少千克?3. 永嘉楠溪江某飞行基地有热气球飞行运动。其中某款热气球的体积为2000立方米,自身质量为170千克。
(1)、反应①通过在高温下与反应,把铁矿石中的铁元素变成单质,此反应利用了的性;(2)、反应②导致每年有大量的钢铁锈蚀,为阻止该反应的发生,人们常采用在钢铁表面涂刷油漆或镀上其它金属等方法。它们的共同原理是阻止钢铁与周围环境中等物质接触;生产中还通常将镍、铬等金属熔合在铁中制成不锈钢,改变其内部结构,达到防止铁制品生锈的目的,这说明了一个重要的道理,即(选填“①物质的性质决定用途”或“②物质的结构决定性质”)。(3)、早在西汉时期,我国劳动人民就利用铁与硫酸铜溶液反应制取铜,称为“湿法炼铜”,即反应③,若用该方法制得铜32千克,理论上需要消耗铁多少千克?3. 永嘉楠溪江某飞行基地有热气球飞行运动。其中某款热气球的体积为2000立方米,自身质量为170千克。 (1)、按要求,热气球上要必须备有两个燃烧系统,某燃烧系统中的燃料是甲烷(CH4),从物质的分类角度看,甲烷属于纯净物中的 。(2)、当热气球的匀速直线上升时,热气球受到重力(填“大于”,“等于”或“小于”)浮力。(不考虑空气摩檫力)(3)、查资料得:常温下空气密度为1.29千克/米3 , 某次热气球升空时,气球内部密度为0.99千克/米3。求这次热气球升空最多可以带几人(假设每个人的质量70千克)。4. 已知钠与水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑。质量均为mg的钠、镁、锌三种金属分别与25g质量分数为19.6%的稀硫酸反应。
(1)、按要求,热气球上要必须备有两个燃烧系统,某燃烧系统中的燃料是甲烷(CH4),从物质的分类角度看,甲烷属于纯净物中的 。(2)、当热气球的匀速直线上升时,热气球受到重力(填“大于”,“等于”或“小于”)浮力。(不考虑空气摩檫力)(3)、查资料得:常温下空气密度为1.29千克/米3 , 某次热气球升空时,气球内部密度为0.99千克/米3。求这次热气球升空最多可以带几人(假设每个人的质量70千克)。4. 已知钠与水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑。质量均为mg的钠、镁、锌三种金属分别与25g质量分数为19.6%的稀硫酸反应。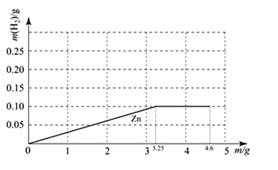 (1)、由于金属的量不确定,产生的氢气的质量大小有多种可能(不考虑镁与水的反应),如镁、锌产生氢气的质量相同且都小于钠产生的氢气质量的情况表示为Na>Mg=Zn。请按以上表示,写出所有可能情况。(2)、试确定,当产生的氢气的质量大小为Na>Mg=Zn时,m的取值范围。(3)、m=4.6时,Zn与酸反应产生H2的质量与金属质量(m)的关系如下图。请在图中再画出钠和镁二种金属分别与酸反应产生H2的质量与金属质量(m)的关系图线。(在图线上用元素符号注明)5. 小科看到同桌在喝可乐,想到老师曾说过易拉罐的主要成分是铝镁合金(已知其他杂质不溶于酸也不与稀硫酸反应)。为探究铝镁合金的组成,取16g铝镁合金样品,将80g氢氧化钠溶液平均分成四份依次加入到样品中(镁与氢氧化钠溶液不反应),铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
(1)、由于金属的量不确定,产生的氢气的质量大小有多种可能(不考虑镁与水的反应),如镁、锌产生氢气的质量相同且都小于钠产生的氢气质量的情况表示为Na>Mg=Zn。请按以上表示,写出所有可能情况。(2)、试确定,当产生的氢气的质量大小为Na>Mg=Zn时,m的取值范围。(3)、m=4.6时,Zn与酸反应产生H2的质量与金属质量(m)的关系如下图。请在图中再画出钠和镁二种金属分别与酸反应产生H2的质量与金属质量(m)的关系图线。(在图线上用元素符号注明)5. 小科看到同桌在喝可乐,想到老师曾说过易拉罐的主要成分是铝镁合金(已知其他杂质不溶于酸也不与稀硫酸反应)。为探究铝镁合金的组成,取16g铝镁合金样品,将80g氢氧化钠溶液平均分成四份依次加入到样品中(镁与氢氧化钠溶液不反应),铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:所加氢氧化钠溶液的次数
第一次
第二次
第三次
第四次
剩余固体的质量/克
10.6
m
4.0
4.0
试计算:
(1)、分析表中数据可知,第二次反应结束后,剩余固体质量m是 克。(2)、该铝镁合金中铝的质量分数。(3)、所用氢氧化钠溶液中溶质的质量分数?6.为测定含杂质(杂质不参加反应)的氧化铜样品中氧化铜的质量分数。小柯同学取了10克氧化铜样品利用下图所示装置进行了实验,并分别称量了部分装置反应前后的质量情况,得到下表中的两组数据:

反应前
完全反应后
A组
玻璃管和固体物质的质量共42.5克
玻璃管和固体物质的质量共40.9克
B组
U形管和其中物质的质量共180.0克
U形管和其中物质的质量共182.3克
请回答下列问题:
(1)、小柯分析后决定用A组数据进行计算,且得出A组中玻璃管和固体物质反应前后减少的质量是元素的质量,并计算得出样品中氧化铜的质量为;(2)、小柯不选择“B组”实验数据来计算样品中的氧化铜的质量分数,原因是;(3)、若要使两组数据计算得到的结果一样,应将图中装有(写试剂名称)的E装置连接在图中A和B装置之间。7. 镍(Ni)元素存在于我们生活用品中,例如保温杯的不锈钢就含有。为了了解镍金属活动性的强弱,某兴趣小组的同学将等量的镍和镁与等质量等浓度的稀硫酸进行实验。将金属与稀硫酸同时加入反应装置中,当稀硫酸过量时记录反应时间和生成氢气质量,得到如图甲所示的图像;当金属过量时记录反应时间和生成氢气的质量,得到如图乙所示的图像。若将镁置于反应装置中,然后向反应装置中逐渐滴加稀硫酸,每加一滴完全反应后再加下一滴,以此形式滴加至过量,记录镁完全反应时生成氢气的质量和消耗稀硫酸的质量,得到如图所示的图像。(反应的化学方程式:Mg+H2SO4=MgSO4+H2↑;Ni+H2SO4=NiSO4+H2↑)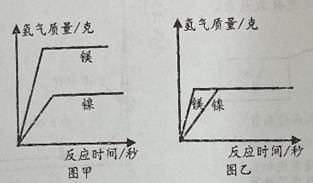
 (1)、查阅资料得知,与等质量等浓度的同种酸反应,当同种金属的相同质量时,粉末状的要比块状 的反应快。则以上实验中,镁和镍还需要控制相同。(2)、下列对于甲乙两图理解的说法正确的是 (可多选)。A、甲图中反应结束后两种金属一定没有剩余 B、乙图中反应结束后稀硫酸可能有剩余 C、甲图中反应结束后消耗稀硫酸的质量不相等 D、乙图中反应结束后消耗稀硫酸的质量相等(3)、取与镁等质量的镍置于反应装置中,然后采用与镁相同的方式向反应装置中滴加稀硫酸。请在丙图上画出镍与稀硫酸反应产生氢气质量与稀硫酸质量的关系图,标出镍完全反应时生成氢气质量和消耗稀硫酸的质量。8. 建造“南昌舰”的特种钢材需要用富铁矿石(含铁量高于50%)来冶炼。研学实践小组为测出某地赤铁矿石(主要成分是Fe2O3)中的含铁量,进行实验;取20g赤铁矿石样品,逐渐加入稀盐酸,充分反应。实验相关数据如图所示(假设杂质不溶于水,也不与酸反应)。
(1)、查阅资料得知,与等质量等浓度的同种酸反应,当同种金属的相同质量时,粉末状的要比块状 的反应快。则以上实验中,镁和镍还需要控制相同。(2)、下列对于甲乙两图理解的说法正确的是 (可多选)。A、甲图中反应结束后两种金属一定没有剩余 B、乙图中反应结束后稀硫酸可能有剩余 C、甲图中反应结束后消耗稀硫酸的质量不相等 D、乙图中反应结束后消耗稀硫酸的质量相等(3)、取与镁等质量的镍置于反应装置中,然后采用与镁相同的方式向反应装置中滴加稀硫酸。请在丙图上画出镍与稀硫酸反应产生氢气质量与稀硫酸质量的关系图,标出镍完全反应时生成氢气质量和消耗稀硫酸的质量。8. 建造“南昌舰”的特种钢材需要用富铁矿石(含铁量高于50%)来冶炼。研学实践小组为测出某地赤铁矿石(主要成分是Fe2O3)中的含铁量,进行实验;取20g赤铁矿石样品,逐渐加入稀盐酸,充分反应。实验相关数据如图所示(假设杂质不溶于水,也不与酸反应)。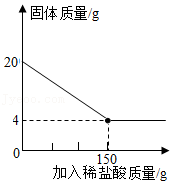 (1)、20g赤铁矿石样品中氧化铁的质量为g;(2)、该样品中铁元素的质量分数为 , 由此判断出该赤铁矿石(填“属于”或“不属于”)富铁矿石。(3)、若赤铁矿中氧化铁的质量分数为80%(其他成分不含铁),600t这样的赤铁矿可以炼出含杂质为4%的生铁多少吨?9. 某化学兴趣小组的同学对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成,他们称取了13.6g固体样品,用图1所示的装置继续实验,测定的部分数据图2所示.请计算:
(1)、20g赤铁矿石样品中氧化铁的质量为g;(2)、该样品中铁元素的质量分数为 , 由此判断出该赤铁矿石(填“属于”或“不属于”)富铁矿石。(3)、若赤铁矿中氧化铁的质量分数为80%(其他成分不含铁),600t这样的赤铁矿可以炼出含杂质为4%的生铁多少吨?9. 某化学兴趣小组的同学对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成,他们称取了13.6g固体样品,用图1所示的装置继续实验,测定的部分数据图2所示.请计算: (1)、固体样品中氧化铁的质量是多少克?(2)、在上述反应后的固体中加入100g稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数.10. 高纯硅可用于制备硅半导体材料.制备高纯硅的主要生产流程如图所示.
(1)、固体样品中氧化铁的质量是多少克?(2)、在上述反应后的固体中加入100g稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数.10. 高纯硅可用于制备硅半导体材料.制备高纯硅的主要生产流程如图所示.信息:石英砂的主要成分是SiO2。
 (1)、石英砂属于(填“纯净物”或“混合物”);写出合理处理中间产物CO的一种方法。(2)、反应③反应除生成高纯硅外,同时还生成一种化合物.请写出此过程的化学方程式。(3)、若杂质不参加反应,利用反应①生产含硅质量分数为9O%的粗硅2.8吨,计算至少需要焦炭多少吨?11. 钢铁的使用是人类文明和进步的重要标志。某钢铁公司用500吨含氧化铁(Fe2O3)64%的赤铁矿石进行炼铁,高炉炼铁的原理为3CO+Fe2O32Fe+3CO2。计算(1)、铁矿石中氧化铁的质量为吨;(2)、这些矿石理论上能炼得铁多少吨?(写出简明的计算过程)12. 2021年11月1日建党100周年纪念币开始兑换,纪念币外环部分是铜锌合金。为测定外环的铜锌合金(假设合金中仅含铜、锌)中铜的质量分数,兴趣小组同学称取制作硬币材料余料样品粉末10g于烧杯中,加入稀硫酸,用精密仪器测得反应中烧杯中剩余物质的总质量与加入的稀硫酸质量关系如图所示:
(1)、石英砂属于(填“纯净物”或“混合物”);写出合理处理中间产物CO的一种方法。(2)、反应③反应除生成高纯硅外,同时还生成一种化合物.请写出此过程的化学方程式。(3)、若杂质不参加反应,利用反应①生产含硅质量分数为9O%的粗硅2.8吨,计算至少需要焦炭多少吨?11. 钢铁的使用是人类文明和进步的重要标志。某钢铁公司用500吨含氧化铁(Fe2O3)64%的赤铁矿石进行炼铁,高炉炼铁的原理为3CO+Fe2O32Fe+3CO2。计算(1)、铁矿石中氧化铁的质量为吨;(2)、这些矿石理论上能炼得铁多少吨?(写出简明的计算过程)12. 2021年11月1日建党100周年纪念币开始兑换,纪念币外环部分是铜锌合金。为测定外环的铜锌合金(假设合金中仅含铜、锌)中铜的质量分数,兴趣小组同学称取制作硬币材料余料样品粉末10g于烧杯中,加入稀硫酸,用精密仪器测得反应中烧杯中剩余物质的总质量与加入的稀硫酸质量关系如图所示:
 (1)、样品粉末完全反应生成氢气的总质量为g。(2)、该样品粉末中铜的质量分数为多少?(写出计算过程)(3)、实验完全反应,过滤,滤液中锌元素的质量为g。13. 铁的锈蚀对社会生产造成较大损害,但也有有利的一面。(1)、某些食品包装袋内常放入铁粉作“双吸剂”(吸收氧气和水蒸气,含少量杂质,杂质既不溶于水也不溶于酸),以防止食品腐败。小明取了一包食品袋中的“双吸剂”,均分出完全相同的5份样品,分别加入浓度相同的稀硫酸充分反应。测得如下表数据,请根据有关信息回答问题:
(1)、样品粉末完全反应生成氢气的总质量为g。(2)、该样品粉末中铜的质量分数为多少?(写出计算过程)(3)、实验完全反应,过滤,滤液中锌元素的质量为g。13. 铁的锈蚀对社会生产造成较大损害,但也有有利的一面。(1)、某些食品包装袋内常放入铁粉作“双吸剂”(吸收氧气和水蒸气,含少量杂质,杂质既不溶于水也不溶于酸),以防止食品腐败。小明取了一包食品袋中的“双吸剂”,均分出完全相同的5份样品,分别加入浓度相同的稀硫酸充分反应。测得如下表数据,请根据有关信息回答问题:实验次数
1
2
3
4
5
样品质量/g
30
30
30
30
30
稀硫酸质量/g
30
90
120
1505
180
产生气体质量/g
0
0.1
0.3
0.5
0.6
①食品袋内的“双吸剂”用铁粉而不用铁块的理由是。
②通过计算求30g样品中单质铁的质量。
(2)、暖宝宝的主要成分是:铁粉、碳粉、水、食盐等,它的产热原理与铁生锈相同,能在短时间内产生大量的热,且食盐能使铁快速生锈。小明利用如图装置推测:U型管左侧红墨水水位先上升。但实际上他观察到反应开始后左侧水位反而先下降。请解释U型管左侧红墨水先下降的原因。14. 日常生活中使用的塑料袋常用聚乙烯(C2H4)n制成的,小明利用平常在超市买东西时带回来的塑料袋进行探究,以验证其元素组成。小明利用如图进行实验,塑料袋充分燃烧,还观察到的实验现象: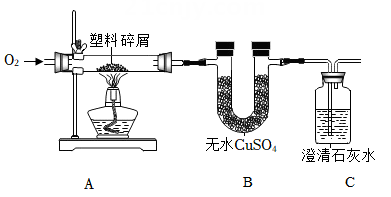
⑴B装置中的固体由白色变成蓝色;
⑵C装置中的澄清石灰水变浑浊
根据以上信息回答问题:
(1)、根据物质类别判断,聚乙烯属于化合物中的。(2)、能推断该有机物中一定含有氢元素的实验现象是。(3)、将C装置中的澄清石灰水更换为浓氢氧化钠溶液,重新实验测得C装置质量增加了17.6克,请计算该 有机物中碳元素的是多少克?15. 实验室可用如图装置模拟工业炼铁。 (1)、实验前先通入CO的目的是 , 试管中出现的现象是。(2)、装置图末端的导气管口放一盏燃着的酒精灯,这样做的目的是。(3)、若工厂用100吨含Fe2O3的质量分数为80 %的铁矿石炼铁,可提炼出含铁的质量分数为96 %的生铁多少吨? (计算结果 保留一位小数)16. 2019年6月21日,杭州市开始在全市范围稳步推进垃圾分类管理,将生活垃圾分为如图所示的4类:(1)、以下四种物品中属于垃圾分类中可回收物的是 ________。A、破碗瓷片 B、过期药物 C、废旧报纸 D、枯枝落叶(2)、易腐垃圾经过处理会产生沼气,沼气可以燃烧发电。沼气的主要成分是甲烷(CH4),请写出甲烷燃烧的化学方程式。(3)、废电池属于“有害垃圾”,主要是因为废电池里含有大量的汞、镉、锰、铅等重金属 (选填“元素”或“单质”)。(4)、“可回收物”中包含铝制易拉罐和废弃铁制品,铝的金属活动性比铁强,但为什么铝制品比铁制品更耐腐蚀? 。
(1)、实验前先通入CO的目的是 , 试管中出现的现象是。(2)、装置图末端的导气管口放一盏燃着的酒精灯,这样做的目的是。(3)、若工厂用100吨含Fe2O3的质量分数为80 %的铁矿石炼铁,可提炼出含铁的质量分数为96 %的生铁多少吨? (计算结果 保留一位小数)16. 2019年6月21日,杭州市开始在全市范围稳步推进垃圾分类管理,将生活垃圾分为如图所示的4类:(1)、以下四种物品中属于垃圾分类中可回收物的是 ________。A、破碗瓷片 B、过期药物 C、废旧报纸 D、枯枝落叶(2)、易腐垃圾经过处理会产生沼气,沼气可以燃烧发电。沼气的主要成分是甲烷(CH4),请写出甲烷燃烧的化学方程式。(3)、废电池属于“有害垃圾”,主要是因为废电池里含有大量的汞、镉、锰、铅等重金属 (选填“元素”或“单质”)。(4)、“可回收物”中包含铝制易拉罐和废弃铁制品,铝的金属活动性比铁强,但为什么铝制品比铁制品更耐腐蚀? 。 17. 阅读下列材料,回答问题:
17. 阅读下列材料,回答问题:新型铸铁材料−−蠕墨铸铁在高碳铁液中加入稀土合金,得到断口呈“花斑”状,石墨为蠕虫状蠕墨铸铁(又称蠕铁)。蠕铁是具有片状和球状石墨之间的过渡形态铸铁,片状石墨和球状石墨内部原子排列方式不同。蠕铁是一种具有良好力学性能(耐高温、强度大、断面敏感性小)、导热率高和抗氧化性能的新型铸铁材料。蠕铁广泛用于制造汽车发动机、汽车制动零件、排气管等。国产蠕铁中的蠕化剂均含有稀土元素,如稀土硅铁镁合金、稀土硅钙合金等。国产蠕铁技术冲破了国外的技术封锁,助推我国发动机制造技术迈向世界领先水平。
(1)、蠕墨铸铁从材料分类看属于材料(填“有机合成”或“金属”)。(2)、蠕墨铸铁作为发动机材料主要是利用其独特的(填“物理”或“化学”)性质。(3)、片状石墨和球状石墨的组成元素(填“相同”或“不同”)。(4)、工业上采用赤铁矿石(主要成分为氧化铁)炼铁的反应原理是。(用化学方程式表示),其中是还原剂。(5)、要炼出含铁90%的生铁100吨,至少需要Fe2O3质量分数为80%的铁矿石多少吨?(计算结果取整数)18. 如图是实验室模拟工业上用大理石(含少量Fe2O3和SiO2)为原料提纯碳酸钙的实验流程。已知:①SiO2不溶于水也不溶于酸 ②氨水呈碱性,与盐酸反应的化学方程式为:NH3•H2O+HCl═NH4Cl+H2O,请回答问题: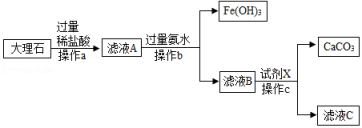 (1)、操作a中需要用到的玻璃仪器有烧杯、玻璃棒和。(2)、写出滤液A中加氨水生成Fe(OH)3的化学方程式:。(3)、滤液B中加入试剂X,恰好完全反应,若滤液C中只含有两种溶质,则试剂X的化学式为。19. 2020年10月12日,舟山市开始在城镇范围稳步推进垃圾分类管理,将生活垃圾分为如图所示的四类。
(1)、操作a中需要用到的玻璃仪器有烧杯、玻璃棒和。(2)、写出滤液A中加氨水生成Fe(OH)3的化学方程式:。(3)、滤液B中加入试剂X,恰好完全反应,若滤液C中只含有两种溶质,则试剂X的化学式为。19. 2020年10月12日,舟山市开始在城镇范围稳步推进垃圾分类管理,将生活垃圾分为如图所示的四类。 (1)、以下四种物品中属于垃圾分类中可回收物的是 ;A、破碗瓷片 B、过期药物 C、废旧报纸 D、枯枝落叶(2)、易腐垃圾经过处理会产生沼气,沼气可以燃烧发电。沼气的主要成分是甲烷(CH4),请写出甲烷燃烧的化学方程式。(3)、废电池属于“有害垃圾”,主要是因为废电池里含有大量的汞、镉、锰、铅等重金属(选填“元素”或“单质”)。(4)、“可回收物”中也包含铝制易拉罐,对铝制易拉罐的回收一般分四步:破碎、脱漆、打包、熔炼。将易拉罐熔炼成铝块的过程,铝发生的物态变化是。20. 北京冬奥,科技助梦,化学在其中扮演着重要角色。从化学视角回答下列问题:(1)、国产氢氧燃料电池豪华中巴在冬奥会投入使用。氢气在氧气中燃烧反应的化学方程式为 , 氢气作燃料能实现“零排放”的原因是。(2)、“冰丝带”速滑馆采用单层双向正交马鞍形索网屋面,将用钢量降到传统屋面的 , 大幅减少了冶炼钢铁产生的碳排放。
(1)、以下四种物品中属于垃圾分类中可回收物的是 ;A、破碗瓷片 B、过期药物 C、废旧报纸 D、枯枝落叶(2)、易腐垃圾经过处理会产生沼气,沼气可以燃烧发电。沼气的主要成分是甲烷(CH4),请写出甲烷燃烧的化学方程式。(3)、废电池属于“有害垃圾”,主要是因为废电池里含有大量的汞、镉、锰、铅等重金属(选填“元素”或“单质”)。(4)、“可回收物”中也包含铝制易拉罐,对铝制易拉罐的回收一般分四步:破碎、脱漆、打包、熔炼。将易拉罐熔炼成铝块的过程,铝发生的物态变化是。20. 北京冬奥,科技助梦,化学在其中扮演着重要角色。从化学视角回答下列问题:(1)、国产氢氧燃料电池豪华中巴在冬奥会投入使用。氢气在氧气中燃烧反应的化学方程式为 , 氢气作燃料能实现“零排放”的原因是。(2)、“冰丝带”速滑馆采用单层双向正交马鞍形索网屋面,将用钢量降到传统屋面的 , 大幅减少了冶炼钢铁产生的碳排放。①“冰丝带”速滑馆所用钢属于材料,与纯铁比较具有等优点;
②工业炼铁的原理是在高温下还原赤铁矿,其化学方程式为。
(3)、冬奥会纪念钞是我国第一枚拥有完全自主知识产权的聚丙烯塑料钞。聚丙烯化学式表示为 , 它属于有机高分子材料,其中碳、氢元素的质量比为。 (4)、冬奥会礼仪服“瑞雪祥云”采用了高科技石墨烯发热材料,在也能御寒。石墨烯是单层石墨片,下列有关石黑烯的说法正确的是___________(填序号)。A、属于化合物 B、与金刚石的硬度相近 C、导热性能好 D、室温下能够稳定存在21. 有同学将金属氧化物知识整理如下:
(4)、冬奥会礼仪服“瑞雪祥云”采用了高科技石墨烯发热材料,在也能御寒。石墨烯是单层石墨片,下列有关石黑烯的说法正确的是___________(填序号)。A、属于化合物 B、与金刚石的硬度相近 C、导热性能好 D、室温下能够稳定存在21. 有同学将金属氧化物知识整理如下:氧化钾
氧化钙
氧化钠
氧化镁
氧化铝
氧化锌
氧化铁
氧化铜
K2O
CaO
Na2O
MgO
Al2O3
ZnO
CuO
(1)、写出表中氧化铁的化学式;(2)、表中的排列规律是根据金属排列的(填序号).①元素化合价 ②活动性顺序 ③原子的相对原子质量.
(3)、氧化镁2克与足量的硫酸反应可以生成硫酸镁多少克?22. 某样品为Cu和CuO的混合物。为测定样品中CuO的含量,甲、乙、丙、丁四位学生用同一样品分别进行实验,测定的数据如下:物质质量
甲
乙
丙
丁
所取固体样品的质量(g)
30
25
20
20
加入硫酸溶液的质量(g)
100
100
100
120
反应后剩余固体的质量(g)
22
17
12
12
分析实验数据,回答下列问题:
(1)、写出氧化铜与硫酸反应的化学方程式:。(2)、求混合物中氧化铜的质量分数。(3)、求硫酸溶液的质量分数。23. 某兴趣小组为了测定铜钱(铜锌合金)中铜的质量分数,取多枚铜钱放入烧杯中,另取80克稀硫酸,分四次等质量加入,每次均充分反应,实验数据记录如下表。实验次数
1
2
3
4
稀硫酸的用量/克
20
20
20
20
剩余固体的质量/克
20.0
17.4
14.8
13.8
分析上述数据,请回答下列问题:
①第4次实验结束后溶液的pH7(填“>”、“=”或“<”)。
②计算铜钱中铜的质量分数(计算结果精确到0.1%)。
③计算参加反应的稀硫酸中的溶质质量分数。(计算结果保留一位小数) 。
24. 中国科学家从千金藤中提取的活性化学成分千金藤素,千金藤素的化学式为C37H38N5O6 , 经研究发现使用少量千金藤素就能阻止新冠病毒的扩增和传播,并于2022年5月获得了国家发明专利授权。(1)、千金藤素属于 (选填“单质”或“化合物”) 。(2)、千金藤素的相对分子质量是。(3)、32.4g 千金藤素含有氮元素的质量为 g。25. 某维生素C泡腾片的主要成分如图甲所示。
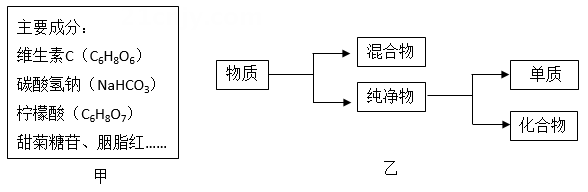 (1)、维生素C由种元素组成。(2)、按照如图乙的物质分类方法,该泡腾片属于。(3)、该泡腾片放入水中,会立刻产生大量的气泡,其原因是:柠檬酸是一种酸,它和碳酸氢钠在水中会发生反应,生成能使澄清石灰水变浑浊的气体。26. Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某科学兴趣小组的同学为了测定某黄铜的组成,取10g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录如表所示。请回答下列问题:
(1)、维生素C由种元素组成。(2)、按照如图乙的物质分类方法,该泡腾片属于。(3)、该泡腾片放入水中,会立刻产生大量的气泡,其原因是:柠檬酸是一种酸,它和碳酸氢钠在水中会发生反应,生成能使澄清石灰水变浑浊的气体。26. Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某科学兴趣小组的同学为了测定某黄铜的组成,取10g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录如表所示。请回答下列问题:加入稀硫酸的质量(g)
充分反应后剩余固体的质量(g)
第1次
10
m
第2次
10
7.4
第3次
10
6.1
第4次
10
5.6
第5次
10
5.6
(1)、将纯铜片和黄铜片互相刻划,纯铜片上留下明显的划痕,而黄铜片上没有明显的划痕。说明。(2)、从表中数据可知,m=。(3)、黄铜样品中锌的质量分数为。(4)、计算所用稀硫酸中硫酸的质量分数。27. 最近,“水晶泥”在同学间流行起来,但看似美丽的水晶泥内却藏着一种叫做“硼砂”的有毒物质。硼砂的化学式是Na2B4O7),对人体各种器官都可产生毒害,长期接触会使人食欲减退,抑制营养素的吸收。急性中毒时会出现呕吐腹泻,头晕和头痛等症状,甚至出现循环系统障碍,休克和昏迷等。请回答问题: (1)、硼砂属于(选填“无机物”或“有机物”)(2)、硼砂分子中Na、B、O的原子个数比是。(3)、20.2g硼砂中含有硼元素g。28. 铜镁合金具有优良的导电性,常用作飞机天线。兴趣小组欲测定合金的组成(其他元素忽略不计),进行了如下实验:取铜镁合金 放入烧杯,将 稀硫酸分4次加入,充分反应后,测得剩余固体的质量,数据记录如下。请回答以下问题:
(1)、硼砂属于(选填“无机物”或“有机物”)(2)、硼砂分子中Na、B、O的原子个数比是。(3)、20.2g硼砂中含有硼元素g。28. 铜镁合金具有优良的导电性,常用作飞机天线。兴趣小组欲测定合金的组成(其他元素忽略不计),进行了如下实验:取铜镁合金 放入烧杯,将 稀硫酸分4次加入,充分反应后,测得剩余固体的质量,数据记录如下。请回答以下问题:次数
1
2
3
4
加入稀硫酸的质量
30
30
30
30
剩余固体的质量
8.8
m
6.4
6
(1)、m的值是。(2)、合金中镁的质量为g。(3)、求第3次反应后溶液的溶质质量分数(计算结果保留到0.1%)。29. 近年来,人们为预防肥胖、心血管疾病的发生,开始有意识的控制糖类物质的摄取量。因而,“代糖"应运而生。赤藓糖醇是一种填充型甜味剂,常作为“代糖”,它是四碳糖醇,分子式为C4H10O4。(1)、赤藓糖醇是(填“氧化物”、y有机物”或“无机物”)。(2)、赤薛糖醇由种元素组成(3)、6.1g赤藓糖醇中含碳元素的质量为g30. 央视网2022-03-20消息:在国家卫健委最新发布的新冠病毒肺炎第九版诊疗方案中,国家药监局批准的利托那韦片作为治疗特异性抗新冠病毒药物,现已从上海入关,迅速运往全国抗疫-线,以下是利托那韦的信息表。根据信息回答: (1)、利托那韦属于(填 “有机物”或“无机物”)。(2)、一个C37H48N6O5S2分子中共有个原子(3)、C37H48N6O5S2中H、N、O三种元素质量比为。31. 为测定某赤铁矿样品中Fe2O3的质量分数,现称取10g赤铁矿样品进行了如图所示实验。
(1)、利托那韦属于(填 “有机物”或“无机物”)。(2)、一个C37H48N6O5S2分子中共有个原子(3)、C37H48N6O5S2中H、N、O三种元素质量比为。31. 为测定某赤铁矿样品中Fe2O3的质量分数,现称取10g赤铁矿样品进行了如图所示实验。装置
反应前
反应后
A
10克
7.6克
B
50克
56.6克
已知赤铁矿主要成分Fe2O3 , 其它成分不参加反应。
 (1)、加热前,通入一段时间CO的目的是;(2)、充分反应后,A、B装置前后质量如表所示。请选用合适的数据计算该赤铁矿样品
(1)、加热前,通入一段时间CO的目的是;(2)、充分反应后,A、B装置前后质量如表所示。请选用合适的数据计算该赤铁矿样品中Fe2O3的质量分数。
(3)、如果利用B装置的数据测得Fe2O3的质量分数偏小,原因是(填写序号)。①实验前装置中有空气
②装置B中部分水被尾气带出
③反应后未继续通入一会儿CO
32. 根据国家于2020年初发布的《关于进一步加强塑料污染治理的意见》要求,许多饮品店已用纸质吸管代替塑料吸管。纸质吸管的主要成分纤维素的化学式为(C6H10O5)n , 塑料吸管的主要成分聚丙烯的化学式为(C3H6)n。(1)、纤维素是一种(选填"有机物”或“无机物")。(2)、纤维素分子中,氢、氧原子的个数比为。(3)、计算:多少克聚丙烯的碳元素质量与32.4克纤维素的碳元素质量相等?33. 2022年2月4日,第二十四届冬奥会在北京开幕。解码智慧冬奥,请根据相关信息回答下列问题。 (1)、据悉,2022年北京冬奥会,国家速滑馆“冰丝带”采用当前最先进的二氧化碳跨临界直冷制冰技术,可实现二氧化碳循环利用和碳排放几乎为零,进而有效缓解的环境问题是;保持二氧化碳化学性质的最小微粒是 (填化学符号)。(2)、氢能“黑科技”将亮相北京冬奥会。冬奥会“飞扬”火炬科技亮点之一是采用氢气作为燃料,氢气燃烧的化学方程式是: 。(3)、“冰墩墩”是2022年北京冬奥会的吉祥物,某“冰墩墩”玩具的外用材料为纯羊毛,内充物为聚酯纤维,区别纯羊毛和聚酯纤维的最好方法是: 。A、闻气味 B、摸手感 C、是否溶于水 D、燃烧法34. 央视《这是真的吗》栏目播出了电脑浸在液体中也能正常工作的新鲜事,原来这种无色的液体是被称作“绝缘液”的液态-氟二氯乙烷(CCl2FCH3),这种液体可为手机电脑“洗澡”,用来清洗电子产品。(1)、一氟二氯乙烷是。(填“无机物”或“有机物”)。(2)、一氟二氯乙烷中碳、氢、氯三种元素的质量比为。(3)、117 g一氟二氯乙烷中碳元素的质量为g。35. 近日,曾红极一时的休闲食品——槟榔的广告宣传被广电总局全面林止。槟榔中含有的槟榔破(C5H12NO2)就像烟碱(尼古丁)一样,会使人兴奋、上瘾,甚至致癌。槟榔碱是一种生物碱,它在常温下是一种油状液体,能溶于水和乙醇。(1)、槟榔碱属于(选填“有机物”或“混合物”)(2)、请写出槟榔破的一条物理性质: 。(3)、31g槟榔碱中含有氧元素的质量为 g
(1)、据悉,2022年北京冬奥会,国家速滑馆“冰丝带”采用当前最先进的二氧化碳跨临界直冷制冰技术,可实现二氧化碳循环利用和碳排放几乎为零,进而有效缓解的环境问题是;保持二氧化碳化学性质的最小微粒是 (填化学符号)。(2)、氢能“黑科技”将亮相北京冬奥会。冬奥会“飞扬”火炬科技亮点之一是采用氢气作为燃料,氢气燃烧的化学方程式是: 。(3)、“冰墩墩”是2022年北京冬奥会的吉祥物,某“冰墩墩”玩具的外用材料为纯羊毛,内充物为聚酯纤维,区别纯羊毛和聚酯纤维的最好方法是: 。A、闻气味 B、摸手感 C、是否溶于水 D、燃烧法34. 央视《这是真的吗》栏目播出了电脑浸在液体中也能正常工作的新鲜事,原来这种无色的液体是被称作“绝缘液”的液态-氟二氯乙烷(CCl2FCH3),这种液体可为手机电脑“洗澡”,用来清洗电子产品。(1)、一氟二氯乙烷是。(填“无机物”或“有机物”)。(2)、一氟二氯乙烷中碳、氢、氯三种元素的质量比为。(3)、117 g一氟二氯乙烷中碳元素的质量为g。35. 近日,曾红极一时的休闲食品——槟榔的广告宣传被广电总局全面林止。槟榔中含有的槟榔破(C5H12NO2)就像烟碱(尼古丁)一样,会使人兴奋、上瘾,甚至致癌。槟榔碱是一种生物碱,它在常温下是一种油状液体,能溶于水和乙醇。(1)、槟榔碱属于(选填“有机物”或“混合物”)(2)、请写出槟榔破的一条物理性质: 。(3)、31g槟榔碱中含有氧元素的质量为 g