九年级科学2022年寒假每日一练:第一章填空题专练(中等难度)2
试卷更新日期:2023-01-12 类型:复习试卷
一、填空题
-
1. 天宫课堂中,航天员王亚平视频展示了在无容器材料实验柜中进行的“锆金属熔化与凝固”实验。金属锆具有抗腐蚀性强、熔点高、硬度大等特性,广泛用于航空航天、军工、原子能等领域。
 (1)、金属锆熔化属于(填“物理”或“化学”)变化。(2)、如图所示是锆元素在元素周期表中的信息,其中“40”是锆元素的原子序数,即它在元素周期表中的位置序号,也是锆原子的核电荷数(即质子数),由此可知锆原子的核外电子数为。(3)、在850℃条件下,镁(Mg) 与四氯化锆(Z rCl4) 发生置换反应获得金属锆。该反应的化学方程式为:。2. 据报道,我国科学家发现治疗新冠的新药——中药千金藤素,获得国家发明专利授权。千金藤素来自千金藤,其化学式为C37H38N2O6 , 白色固体,难溶于水,易氧化,需密封避光低温保存。
(1)、金属锆熔化属于(填“物理”或“化学”)变化。(2)、如图所示是锆元素在元素周期表中的信息,其中“40”是锆元素的原子序数,即它在元素周期表中的位置序号,也是锆原子的核电荷数(即质子数),由此可知锆原子的核外电子数为。(3)、在850℃条件下,镁(Mg) 与四氯化锆(Z rCl4) 发生置换反应获得金属锆。该反应的化学方程式为:。2. 据报道,我国科学家发现治疗新冠的新药——中药千金藤素,获得国家发明专利授权。千金藤素来自千金藤,其化学式为C37H38N2O6 , 白色固体,难溶于水,易氧化,需密封避光低温保存。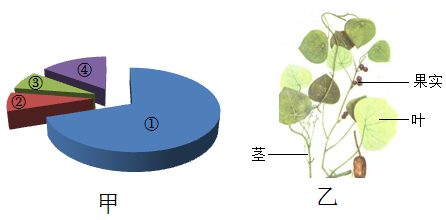 (1)、根据上述信息,写出千金藤素的一条物理性质:。(2)、千金藤素中各元素质量分数如图甲所示,其中表示碳元素的是。(填序号)(3)、图乙所示为千金藤植株,据图判断其为植物。3. 物质结构决定性质,性质决定用途,现象反映本质。如图是小科构建的硫酸部分知识网络,其中“一”表示相连物质能发生化学反应。
(1)、根据上述信息,写出千金藤素的一条物理性质:。(2)、千金藤素中各元素质量分数如图甲所示,其中表示碳元素的是。(填序号)(3)、图乙所示为千金藤植株,据图判断其为植物。3. 物质结构决定性质,性质决定用途,现象反映本质。如图是小科构建的硫酸部分知识网络,其中“一”表示相连物质能发生化学反应。 (1)、石蕊试液在H2SO4溶液中显红色,该溶液中能使石蕊试液变红的离子是。(2)、在实验室中常用浓硫酸做干燥剂,这是利用它的。4. 2021年12月9日,神舟十三号航天员工亚平在“天宫课堂"上做了水球的实验(1)、首先她将少量蓝色颜料注入水球,一会儿整个水球都变成了蓝色。请从微观角度解释该现象。(2)、接着她将半粒泡腾片塞入水球,水球中马上产生大量的气泡,这是由于柠檬酸和碳酸氢钠在水中发生反应产生大量二氧化碳,该变化属于变化。(3)、实验中产生的大量气泡最后都停留在水球中,请你推测气泡是否受到水的浮力作用?。5. 如图所示,把试管小心地放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入适量的镁片,再用滴管滴加适量稀盐酸于试管中,请回答下列问题。
(1)、石蕊试液在H2SO4溶液中显红色,该溶液中能使石蕊试液变红的离子是。(2)、在实验室中常用浓硫酸做干燥剂,这是利用它的。4. 2021年12月9日,神舟十三号航天员工亚平在“天宫课堂"上做了水球的实验(1)、首先她将少量蓝色颜料注入水球,一会儿整个水球都变成了蓝色。请从微观角度解释该现象。(2)、接着她将半粒泡腾片塞入水球,水球中马上产生大量的气泡,这是由于柠檬酸和碳酸氢钠在水中发生反应产生大量二氧化碳,该变化属于变化。(3)、实验中产生的大量气泡最后都停留在水球中,请你推测气泡是否受到水的浮力作用?。5. 如图所示,把试管小心地放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入适量的镁片,再用滴管滴加适量稀盐酸于试管中,请回答下列问题。 (1)、镁和稀盐酸反应,生成氯化镁和氢气,同时溶液的温度会升高,因此这是(填“吸热”或“放热”)反应。(2)、实验中观察到的现象是镁带表面产生气泡,澄清石灰水变浑浊,石灰水变浑浊原因是。6. 如图1是关于氢氧化钠化学性质的思维导图,请据图回答
(1)、镁和稀盐酸反应,生成氯化镁和氢气,同时溶液的温度会升高,因此这是(填“吸热”或“放热”)反应。(2)、实验中观察到的现象是镁带表面产生气泡,澄清石灰水变浑浊,石灰水变浑浊原因是。6. 如图1是关于氢氧化钠化学性质的思维导图,请据图回答
 (1)、根据性质②,将氢氧化钠溶液滴入稀盐酸中,图2表示该反应过程中溶液pH的变化曲线,m点溶液中的溶质是。(填写化学式)(2)、根据性质③,除去硫酸厂在生产过程中产生的二氧化硫气体,化学方程式为。7. 氯化钡是一种可溶性重金属盐。广泛应用于化工领城,其水溶液呈中性。工业上用毒重石(只要成分是碳酸钡)制备氨化铜晶体。某实验小组模拟工业上制备氯化钡晶体的流程,设计了实验室中制备氯化钡晶体的方案。实验流程如图所示(该毒重石样品所含杂质难溶于水且不与酸反应)。
(1)、根据性质②,将氢氧化钠溶液滴入稀盐酸中,图2表示该反应过程中溶液pH的变化曲线,m点溶液中的溶质是。(填写化学式)(2)、根据性质③,除去硫酸厂在生产过程中产生的二氧化硫气体,化学方程式为。7. 氯化钡是一种可溶性重金属盐。广泛应用于化工领城,其水溶液呈中性。工业上用毒重石(只要成分是碳酸钡)制备氨化铜晶体。某实验小组模拟工业上制备氯化钡晶体的流程,设计了实验室中制备氯化钡晶体的方案。实验流程如图所示(该毒重石样品所含杂质难溶于水且不与酸反应)。 (1)、步骤①中发生反应的化学方程式为:。(2)、滤液II是30℃时氯化钡的饱和溶液,请说明原因:。(3)、关于上述实验方案的相关内容,下列说法正确的是 (填字母)。A、氯化钡是一种有毒的物质,使用时应注意安全 B、该实验流程中得到的副产品二氧化碳是重要的化工原料 C、可用重晶石(主要成分是硫酸锁)代替该实验流程中的毒重石制备氟化钡晶体 D、步骤②将滤渣进行水洗,既能提高氯化钡晶体的产率,又能减少Ba2+对环境的污染8. 小李同学用如下图总结NaOH的四类化学性质(即NaOH能够与四类物质发生化学反应)。
(1)、步骤①中发生反应的化学方程式为:。(2)、滤液II是30℃时氯化钡的饱和溶液,请说明原因:。(3)、关于上述实验方案的相关内容,下列说法正确的是 (填字母)。A、氯化钡是一种有毒的物质,使用时应注意安全 B、该实验流程中得到的副产品二氧化碳是重要的化工原料 C、可用重晶石(主要成分是硫酸锁)代替该实验流程中的毒重石制备氟化钡晶体 D、步骤②将滤渣进行水洗,既能提高氯化钡晶体的产率,又能减少Ba2+对环境的污染8. 小李同学用如下图总结NaOH的四类化学性质(即NaOH能够与四类物质发生化学反应)。
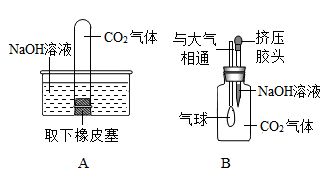
为验证性质④,他选择了二氧化碳与其反应,为探究两者是否发生了化学反应,小李设计了如图所示的A、B实验进行验证。实验现象为:A中试管内液面上升,B中。
李莉提出质疑,她认为A实验不严谨,应做一个对比实验:。
9. 微型化学实验利用微型仪器,被誉为绿色环保的化学实验。学习小组同学利用井穴板进行以下实验验证稀盐酸的化学性质,在井穴中分别加入一定量下列物质,然后依次加入适量稀盐酸。 (1)、写出以上实验中有水生成的化学反应方程式:(写一个即可) ;(2)、某同学在⑤号井穴中加入一定量稀盐酸后,想证明稀盐酸己过量,可加入的试剂是 (填字母)。A、无色酚酞试液 B、Cu(OH)2 C、AgNO3溶液10. 在新冠肺炎疫情防控中,化学发挥着重要作用。(1)、我国研发的新型冠状病毒灭活疫苗的辅料成分中含有Al(OH)3 , 其中铝元素的化合价为 ;(2)、熔喷布是生产口罩的主要原材料,主要成分是聚丙烯。熔喷布采用高速热空气使聚丙烯熔化成细流,同时再经自身粘合而成。这个过程中聚丙烯发生的变化为变化。11. 如图是关于氢氧化钠化学性质的思维导图,请据图回答
(1)、写出以上实验中有水生成的化学反应方程式:(写一个即可) ;(2)、某同学在⑤号井穴中加入一定量稀盐酸后,想证明稀盐酸己过量,可加入的试剂是 (填字母)。A、无色酚酞试液 B、Cu(OH)2 C、AgNO3溶液10. 在新冠肺炎疫情防控中,化学发挥着重要作用。(1)、我国研发的新型冠状病毒灭活疫苗的辅料成分中含有Al(OH)3 , 其中铝元素的化合价为 ;(2)、熔喷布是生产口罩的主要原材料,主要成分是聚丙烯。熔喷布采用高速热空气使聚丙烯熔化成细流,同时再经自身粘合而成。这个过程中聚丙烯发生的变化为变化。11. 如图是关于氢氧化钠化学性质的思维导图,请据图回答
 (1)、依据性质③,除去硫酸厂在生产过程中产生的二氧化硫气体,化学方程式为(2)、性质④,将氢氧化钠固体和某种盐混合研磨,能放出有刺激性气味的气体。推测这种盐的组成中含有。(写出原子团的符号)12. 如图是过氧化氢在一定条件下发生分解反应的微观模拟图,请回答下列问题:
(1)、依据性质③,除去硫酸厂在生产过程中产生的二氧化硫气体,化学方程式为(2)、性质④,将氢氧化钠固体和某种盐混合研磨,能放出有刺激性气味的气体。推测这种盐的组成中含有。(写出原子团的符号)12. 如图是过氧化氢在一定条件下发生分解反应的微观模拟图,请回答下列问题: (1)、在 C 图中将相关粒子图形补充完整(用“
(1)、在 C 图中将相关粒子图形补充完整(用“ ”表示氢原子,用“
”表示氢原子,用“  ”表示氧原子) (2)、此化学变化中没有发生改变的粒子是(填名称)。13. 兴趣小组的同学为研究酸和碱反应的特点,将稀盐酸匀速、缓慢地滴入盛有氢氧化钠溶液的烧杯中,并测绘出烧杯内溶液的温度和pH的变化图象(如图所示),请回答问题:
”表示氧原子) (2)、此化学变化中没有发生改变的粒子是(填名称)。13. 兴趣小组的同学为研究酸和碱反应的特点,将稀盐酸匀速、缓慢地滴入盛有氢氧化钠溶液的烧杯中,并测绘出烧杯内溶液的温度和pH的变化图象(如图所示),请回答问题: (1)、在t1时刻,烧杯中存在的阴离子是(填写离子符号);(2)、t2时刻后,溶液温度降低的主要原因是。14. 某兴趣小组做完硫酸铜晶体的制备实验后剩余了大量的硫酸铜溶液,为了防止水中金属铜离子对人体造成危害,并从中回收铜,同学们设计了如下方案:
(1)、在t1时刻,烧杯中存在的阴离子是(填写离子符号);(2)、t2时刻后,溶液温度降低的主要原因是。14. 某兴趣小组做完硫酸铜晶体的制备实验后剩余了大量的硫酸铜溶液,为了防止水中金属铜离子对人体造成危害,并从中回收铜,同学们设计了如下方案:
当观察到现象时,说明过滤 1 可以进行了。在该方案中,稀盐酸的作用是。
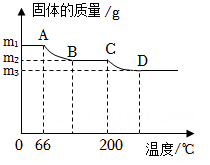
15. 某科学学习小组在实验过程中,向一定量的硫酸铜溶液中加入一定质量分数的氢氧化钡溶液直至过量,生成沉淀的质量与加入氢氧化钡溶液的质量关系如图所示。反应进行到b点时,溶液的pH值7(选填“>”“=”或“<”),C点溶液中的溶质是。 16. 有一包固体粉末X可能含有锌、铁、氧化铜中的一种或几种。现将m g该固体粉末加入到一定质量的稀盐酸中,充分反应后剩余ng固体。(1)、若固体粉末X中含有铁、氧化铜,则m n(填“> ”“=”或“<”)。(2)、若充分反应后溶液中含有四种阳离子,剩余固体为(填“ 纯净物”或“混合物”)。17. 春晚舞蹈“只此青绿”给中国文化赋予无限的想象力。古代服装和绘画中的青色来自于矿物颜料石青,化学式为:Cu3(CO3)2(OH)2。(1)、石青是由种元素组成。(2)、石青的化学式还可以表示为2CuCO3·Cu(OH)。已知CuCO3和Cu(OH)2都能受热分解,分别生成两种常见的氧化物(其中有一种氧化物相同),且Cu(OH)2的分解温度为66℃到68℃,CuCO3的分解温度为200℃到220℃,则图中BC段的固体物质有。
16. 有一包固体粉末X可能含有锌、铁、氧化铜中的一种或几种。现将m g该固体粉末加入到一定质量的稀盐酸中,充分反应后剩余ng固体。(1)、若固体粉末X中含有铁、氧化铜,则m n(填“> ”“=”或“<”)。(2)、若充分反应后溶液中含有四种阳离子,剩余固体为(填“ 纯净物”或“混合物”)。17. 春晚舞蹈“只此青绿”给中国文化赋予无限的想象力。古代服装和绘画中的青色来自于矿物颜料石青,化学式为:Cu3(CO3)2(OH)2。(1)、石青是由种元素组成。(2)、石青的化学式还可以表示为2CuCO3·Cu(OH)。已知CuCO3和Cu(OH)2都能受热分解,分别生成两种常见的氧化物(其中有一种氧化物相同),且Cu(OH)2的分解温度为66℃到68℃,CuCO3的分解温度为200℃到220℃,则图中BC段的固体物质有。
 18. 酸与碱的定义在科学史上不断发展,下列是按时间发展顺序排列的部分酸碱理论要点:
18. 酸与碱的定义在科学史上不断发展,下列是按时间发展顺序排列的部分酸碱理论要点:①酸碱电离理论:凡在水溶液中电离出的阳离子全部都是H+的物质叫酸;电离出的阴离子全部都是OH-的物质叫碱。
②酸碱溶剂理论:凡在溶剂中产生该溶剂特征阳离子的溶质叫酸;产生该溶剂特征阴离子的溶质叫碱。例如,液氨可电离出NH4+和NH2-两种离子,当液氨作为溶剂时,NH4+为特征阳离子,NH2-为特征阴离子。
③酸碱质子理论:凡能够给出质子(H+)的都是酸;凡能够接受质子(H+)的物质都是碱。
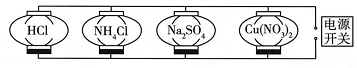
(1)、已知硫酸氢钠的电离方程式是:NaHSO4=Na++H++SO42- , 小金判断硫酸氢钠是种盐,小婺判断硫酸氢钠是一种酸。小婺判断所用的理论是(2)、根据以上酸碱理论,下列分析合理的是 (可多选)。A、根据酸碱电离理论,酸性物质不一定是酸,碱性物质不一定是碱 B、氯化铵在液氨中能产生NH4+ , 根据酸碱溶剂理论,氯化铵是酸 C、在酸碱溶剂理论中,某物质可能既是酸,又是碱 D、根据酸碱质子理论,酸是带正电的,而碱是带负电的 E、酸碱质子理论扩大了酸和碱的范围,不再具有局限性19. 生活中处处都要用到科学知识。(1)、吃松花蛋时,为消除蛋中因含碱性物质而引起的涩味,可加入少量 (选填 “苏打”、“食盐”或“食醋”);(2)、俗话说“梨树砍三刀,果枝压弯腰”,在初夏梨树的“坐果”期,有经验的果农会给梨树的茎做半环状剥皮,这样做可以促使更多的输送给果实。20. 胃舒平的有效成分是氢氧化铝,是治疗胃酸(盐酸)过多的常用药物。(1)、请用化学方程式表示治疗原理:;(2)、上述反应属于反应(选填基本反应类型)。21. 某科学兴趣小组同学设计了一个“彩灯游戏”,规则是:在“电源开关”处填入一种物质,使其与四条支路上的灯笼对应的物质均能发生反应,并产生不同的现象,四盏彩灯才会同时亮起。电源开关处的物质是(填化学式) , Na2SO4 , 处对应的现象是。
 22. 如图甲所示,烧杯中为一定量的碳酸钙和稀盐酸反应后的溶液,用胶头滴管逐滴滴入Na2CO3溶液,并用pH传感器测得烧杯内溶液的pH变化如图乙所示。
22. 如图甲所示,烧杯中为一定量的碳酸钙和稀盐酸反应后的溶液,用胶头滴管逐滴滴入Na2CO3溶液,并用pH传感器测得烧杯内溶液的pH变化如图乙所示。 (1)、胶头滴管逐滴滴入Na2CO3溶液的过程中,烧杯中可观察到的实验现象是。(2)、当加入amLNa2CO3溶液时,烧杯内溶液中的溶质是。23. 将稀硫酸逐滴加入到滴有酚酞试液的氢氧化钠溶液中,直至过量。如图是实验操作和反应的微观示意图,请回答下列问题:
(1)、胶头滴管逐滴滴入Na2CO3溶液的过程中,烧杯中可观察到的实验现象是。(2)、当加入amLNa2CO3溶液时,烧杯内溶液中的溶质是。23. 将稀硫酸逐滴加入到滴有酚酞试液的氢氧化钠溶液中,直至过量。如图是实验操作和反应的微观示意图,请回答下列问题: (1)、图中甲表示的微粒是(填符号)。(2)、为验证反应后的溶液中含有稀硫酸,可行的操作是 。A、取样,滴加少量紫色石蕊试液 B、取样,滴加少量CuSO4溶液 C、取样,加入少量Na2CO3粉末 D、取样,滴加少量Ba(NO3)2溶液24. 在牙膏中常用碳酸钙粉末做摩擦剂。小科在实验室以石灰石(杂质不反应也不溶于水)为原料制取碳酸钙。CaCO3 CaO+CO2↑
(1)、图中甲表示的微粒是(填符号)。(2)、为验证反应后的溶液中含有稀硫酸,可行的操作是 。A、取样,滴加少量紫色石蕊试液 B、取样,滴加少量CuSO4溶液 C、取样,加入少量Na2CO3粉末 D、取样,滴加少量Ba(NO3)2溶液24. 在牙膏中常用碳酸钙粉末做摩擦剂。小科在实验室以石灰石(杂质不反应也不溶于水)为原料制取碳酸钙。CaCO3 CaO+CO2↑ (1)、过滤操作需要下列玻璃仪器中的(可多选)
(1)、过滤操作需要下列玻璃仪器中的(可多选) (2)、为检测溶液M中的溶质是否反应完全,可取上层清液加入进行检验。25. 如图是某兴趣小组同学验证氢氧化钠与稀盐酸发生反应的实验。
(2)、为检测溶液M中的溶质是否反应完全,可取上层清液加入进行检验。25. 如图是某兴趣小组同学验证氢氧化钠与稀盐酸发生反应的实验。 (1)、实验过程中用玻璃棒搅拌的目的是:(2)、通过酚酞变色不能准确判断是否完全反应,于是同学们改用pH试纸,测得反应后的溶液的pH<7,说明此时稀盐酸过量,则此时溶液中的溶质除酚酞外的成分有(写化学式)26. “奥运五环”(如图)象征五大洲的团结。2022 年北京冬奥会开幕式上,有一个巨大奥运五环“破冰而出”的精彩表演。
(1)、实验过程中用玻璃棒搅拌的目的是:(2)、通过酚酞变色不能准确判断是否完全反应,于是同学们改用pH试纸,测得反应后的溶液的pH<7,说明此时稀盐酸过量,则此时溶液中的溶质除酚酞外的成分有(写化学式)26. “奥运五环”(如图)象征五大洲的团结。2022 年北京冬奥会开幕式上,有一个巨大奥运五环“破冰而出”的精彩表演。 (1)、表演中,要使总重为3×104牛的奥运五环缓缓升起,需要对它施加向上的拉力至少为牛。(2)、奥运五环在40秒的时间内要匀速提升12米,其上升的速度应为米/秒。(3)、小明自制奥运五.环时用化学变化显示颜色,他将酚酞试液滴入装有氨水(pH=10) 的环中,呈现的颜色是。27. 稀盐酸是实验室中一种口要的试剂,用途广泛.
(1)、表演中,要使总重为3×104牛的奥运五环缓缓升起,需要对它施加向上的拉力至少为牛。(2)、奥运五环在40秒的时间内要匀速提升12米,其上升的速度应为米/秒。(3)、小明自制奥运五.环时用化学变化显示颜色,他将酚酞试液滴入装有氨水(pH=10) 的环中,呈现的颜色是。27. 稀盐酸是实验室中一种口要的试剂,用途广泛. (1)、小金向盛有稀盐酸的烧杯中加入适量的某种固体与之反应。反应前后烧杯内溶液中主要离子种类及个数比变化如图(不考虑大小)。则加入的固体可能是 (写编号)A、铁 B、铝 C、氧化铜 D、氢氧化镁(2)、在稀盐酸的下列用途中,不能用稀硫酸代替的是 (填编号)。
(1)、小金向盛有稀盐酸的烧杯中加入适量的某种固体与之反应。反应前后烧杯内溶液中主要离子种类及个数比变化如图(不考虑大小)。则加入的固体可能是 (写编号)A、铁 B、铝 C、氧化铜 D、氢氧化镁(2)、在稀盐酸的下列用途中,不能用稀硫酸代替的是 (填编号)。①金属表面除锈②制造药物氯化锌
③除去NaCl中的少口NaOH④实验室制取CO2。
28. 小宁在中考实验考试时抽中了“用石灰石和稀盐酸制取二氧化碳”的实验。(1)、装置A中的仪器①是。(2)、实验室制取二氧化碳的反应方程式:。(3)、图A-E是实验室常用的装置,小宁使用的实验装置是。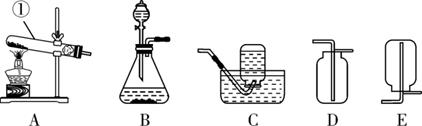 (4)、小宁想要研究反应后废液的成分,取废液的上层清液,逐滴加入碳酸钠溶液,观察到有气泡和沉淀产生并绘制了相关变化关系,需要纠正的是。
(4)、小宁想要研究反应后废液的成分,取废液的上层清液,逐滴加入碳酸钠溶液,观察到有气泡和沉淀产生并绘制了相关变化关系,需要纠正的是。①
 ②
② 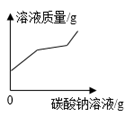 ③
③  ④。
④。  29. 小滨向Na2SO4溶液中滴入Ba(NO3)2溶液至恰好完全反应。(1)、从四大基本反应类型看,该反应属于。(2)、若反应前后溶液中存在的离子种类如图所示,其中“
29. 小滨向Na2SO4溶液中滴入Ba(NO3)2溶液至恰好完全反应。(1)、从四大基本反应类型看,该反应属于。(2)、若反应前后溶液中存在的离子种类如图所示,其中“ ”“
”“  ”“
”“  ”“
”“  ”表示不同种类的离子,则“
”表示不同种类的离子,则“  ”表示(填离子符号)。
”表示(填离子符号)。
 30. 如图所示:若关闭II阀打开I阀,紫色小花(用石蕊溶液染成)变红;若关闭I阀打开II阀,小花不变红。
30. 如图所示:若关闭II阀打开I阀,紫色小花(用石蕊溶液染成)变红;若关闭I阀打开II阀,小花不变红。 (1)、若甲瓶中未发生化学反应,则甲瓶中盛有的液体可能是;(2)、若甲瓶中发生化学反应,但无明显现象,则甲瓶中发生的反应方程式可能为。31. 自2026年1月1日起,我国将全面禁止生产含汞(水银)体温计和含汞血压计。使用电子体温计、血压计更能避免汞(剧毒)伤害的风险。在使用含汞体温计和含汞血压计时,如果发生被打碎液态金属汞流出,可以撒上硫磺粉来处理,其原理是常温下反应生成硫化汞。写出硫化汞的化学式 , 从物质分类的角度,硫化汞属于无机化合物中的。32. 小林和爸爸“周末”到乡村旅游时,亲身体会到科学就在我们身边。(1)、途中,小林发现许多农民在移栽果树,他们把果树的一些叶子去掉了,目的是减弱果树的作用,以提高成活率。林敏绘制了细胞图,其中属于植物细胞的是
(1)、若甲瓶中未发生化学反应,则甲瓶中盛有的液体可能是;(2)、若甲瓶中发生化学反应,但无明显现象,则甲瓶中发生的反应方程式可能为。31. 自2026年1月1日起,我国将全面禁止生产含汞(水银)体温计和含汞血压计。使用电子体温计、血压计更能避免汞(剧毒)伤害的风险。在使用含汞体温计和含汞血压计时,如果发生被打碎液态金属汞流出,可以撒上硫磺粉来处理,其原理是常温下反应生成硫化汞。写出硫化汞的化学式 , 从物质分类的角度,硫化汞属于无机化合物中的。32. 小林和爸爸“周末”到乡村旅游时,亲身体会到科学就在我们身边。(1)、途中,小林发现许多农民在移栽果树,他们把果树的一些叶子去掉了,目的是减弱果树的作用,以提高成活率。林敏绘制了细胞图,其中属于植物细胞的是 (2)、在旅游中听果农介绍钾肥是保障果树优质稳产的关键所在,根据你所学的知识,写出一种钾肥的名称33. 氯化钡是一种可溶性重金属盐,广泛应用于化工领域,其水溶液呈中性。工业上用毒重石(主要成分是BaCO3 , 所含杂质难溶于水,不与酸反应)制备氯化钡晶体。实验小组设计了如图所示的实验室中制备氯化钡晶体的流程。
(2)、在旅游中听果农介绍钾肥是保障果树优质稳产的关键所在,根据你所学的知识,写出一种钾肥的名称33. 氯化钡是一种可溶性重金属盐,广泛应用于化工领域,其水溶液呈中性。工业上用毒重石(主要成分是BaCO3 , 所含杂质难溶于水,不与酸反应)制备氯化钡晶体。实验小组设计了如图所示的实验室中制备氯化钡晶体的流程。 (1)、关于上述实验方案的相关内容,下列说法不正确的是(选填字母序号) 。
(1)、关于上述实验方案的相关内容,下列说法不正确的是(选填字母序号) 。A.氯化钡是一种有毒的重金属盐,使用时应注意安全
B.步骤②将滤渣进行水洗,既能提高氯化钡晶体的产率,又能减少 Ba2+对环境污染
C.可用重晶石(主要成分是 BaSO4)代替该实验流程中的毒重石,制备氯化钡晶体
D.滤液Ⅱ是不饱和溶液
(2)、滤液 Ⅰ中还有过量的盐酸,为防止浓缩时产生HCl气体造成污染,需要对滤液Ⅰ处理后再浓缩。处理滤液Ⅰ中过量的盐酸的方法:加入适量的(填物质名称) 。34. 某同学在实验室中以碳酸钡原料(含少量SiO2 , SiO2不参与反应)制备高纯碳酸钡的流程如图:
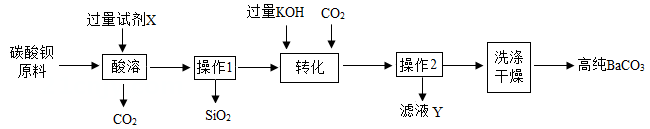 (1)、试剂x应选用 (填字母)。A、稀硫酸 B、盐酸(2)、操作1、操作2用到的玻璃仪器有 、烧杯、玻璃棒等。(3)、滤液Y中的溶质除有:KOH、K2CO3以外肯定含有的是(填化学式)35. 有一包白色固体,可能由BaCl2、NaOH,Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,实验小组进行试验。实验过程中所加试剂均足量,实验过程及现象如图所示。
(1)、试剂x应选用 (填字母)。A、稀硫酸 B、盐酸(2)、操作1、操作2用到的玻璃仪器有 、烧杯、玻璃棒等。(3)、滤液Y中的溶质除有:KOH、K2CO3以外肯定含有的是(填化学式)35. 有一包白色固体,可能由BaCl2、NaOH,Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,实验小组进行试验。实验过程中所加试剂均足量,实验过程及现象如图所示。 (1)、①和②的实验操作名称。(2)、白色沉淀C的化学式为。(3)、这包白色固体是由(填化学式)组成的。
(1)、①和②的实验操作名称。(2)、白色沉淀C的化学式为。(3)、这包白色固体是由(填化学式)组成的。