九年级科学2022年寒假每日一练:第一章填空题专练(优生加练)
试卷更新日期:2023-01-12 类型:复习试卷
一、填空题
-
1. 某固体混合物中可能含有氢氧化钠、硝酸钠、氯化钠、硫酸钠、碳酸钠。为了研究该混合物的成分,某同学按下列流程进行了实验(各步均恰好完全反应):

根据流程图回答问题:
(1)、反应④的化学方程式为。(2)、根据实验现象推断该混合物中一定含有的物质是。(填化学式)。(3)、该同学为了进步确定固体混合物的组成,取样品20.9g (其中含钠元素质量为6.9g),按上述流程图进行实验,产生11.65g白色沉淀A,产生2.2g气体W。通过计算,确定该混合物中还含有的物质是 , (填化学式),其质量为g。2. 如图所示是为了验证稀硫酸化学性质所做的三个实验,回答下列问题。 (1)、A实验最终能观察到的现象是。(2)、C实验中发生反应的化学方程式为。(3)、若要证明C实验所加的BaCl2溶液过量,小明的实验操作及现象是:取少量C中上层清液于试管中,滴加AgNO3溶液,如果产生白色沉淀,则证明C实验所加BaCl2溶液过量。你认为该同学的做法对吗?请你作出判断并说明理由。。3. 已知常用的强酸(盐酸、硫酸、硝酸)跟常用的强碱(氢氧化钠、氢氧化钾)反应生成的盐的水溶液显中性。 现将某蓝色晶体 A 溶入某一无色中性液体中,按下图所示过程进行实验:
(1)、A实验最终能观察到的现象是。(2)、C实验中发生反应的化学方程式为。(3)、若要证明C实验所加的BaCl2溶液过量,小明的实验操作及现象是:取少量C中上层清液于试管中,滴加AgNO3溶液,如果产生白色沉淀,则证明C实验所加BaCl2溶液过量。你认为该同学的做法对吗?请你作出判断并说明理由。。3. 已知常用的强酸(盐酸、硫酸、硝酸)跟常用的强碱(氢氧化钠、氢氧化钾)反应生成的盐的水溶液显中性。 现将某蓝色晶体 A 溶入某一无色中性液体中,按下图所示过程进行实验:
试按要求填空。
① 写出 B、C 溶液中溶质的化学式: B , C。
② 若 A 是纯净物,无色中性液体也是纯净物,则中性液体是(填化学式)。
③ 若 A 是纯净物,无色中性液体是只含有一种溶质的溶液,则其溶质是(填化学式)。
写出有色液体与 C 溶液反应的化学方程式。
4. 归纳是学习的重要方法,在学习酸、碱、盐后,绘制出如图所示的物质之间的反应关系,(图中短线连接的物质表示能相互反应),请填写下列空白: (1)、在图中空白方框中可填写指示剂或(填物质类别)(2)、验证反应①,可以选择下列_________(两种物质序号)进行反应A、Na2SO4 B、KNO3 C、Ba(OH)2 D、NaOH(3)、碱具有相似的化学性质的原因是,碱溶液中都含有(填微粒符号)5. 敞口放置的氢氧化钠溶液易吸收空气中的二氧化碳而变质,现向一定质量且部分变质的氢氧化钠溶液中逐滴加入稀盐酸,并振荡。如图表示反应过程中溶液质量随加入盐酸质量的变化而变化的情况。则:
(1)、在图中空白方框中可填写指示剂或(填物质类别)(2)、验证反应①,可以选择下列_________(两种物质序号)进行反应A、Na2SO4 B、KNO3 C、Ba(OH)2 D、NaOH(3)、碱具有相似的化学性质的原因是,碱溶液中都含有(填微粒符号)5. 敞口放置的氢氧化钠溶液易吸收空气中的二氧化碳而变质,现向一定质量且部分变质的氢氧化钠溶液中逐滴加入稀盐酸,并振荡。如图表示反应过程中溶液质量随加入盐酸质量的变化而变化的情况。则: (1)、图线BC段对应的实验现象是 , 在B点时溶液中的溶质是。(2)、在右图中画出产生气体的质量与加入盐酸的质量关系。6. 同学们从山上采集到一种石灰石,进行实验。取用8克石灰石样品,把40克稀盐酸分四次加入样品中(杂质既不与酸反应,也不溶于水),充分反应后经过过滤、干燥等操作,最后称量,得实验数据如表。
(1)、图线BC段对应的实验现象是 , 在B点时溶液中的溶质是。(2)、在右图中画出产生气体的质量与加入盐酸的质量关系。6. 同学们从山上采集到一种石灰石,进行实验。取用8克石灰石样品,把40克稀盐酸分四次加入样品中(杂质既不与酸反应,也不溶于水),充分反应后经过过滤、干燥等操作,最后称量,得实验数据如表。实验次数
第一次
第二次
第三次
第四次
加入稀盐酸的质量/g
10
10
10
10
剩余固体的质量/g
5.5
M
1.0
1.0
(1)、上表中m的值应为。(2)、列式计算实验所用的稀盐酸的质量分数。(3)、求第三次实验充分反应后,溶液的质量为克。7. 化学实验小组为验证氢氧化钙的化学性质进行了一系列实验。 (1)、按如图进行实验,写出甲实验中发生反应的化学方程式 。(2)、为确定两个实验后剩余物的成分,继续实验:
(1)、按如图进行实验,写出甲实验中发生反应的化学方程式 。(2)、为确定两个实验后剩余物的成分,继续实验:①将少量氧化铁加入甲实验后的溶液中,发现红棕色固体消失,溶液变为色。
②取乙实验所得上层清液于烧杯中,为确定溶质成分,下列实验方案可行的是(填序号)
A.将烧杯久置于空气中,杯内物质质量增加(忽略水的蒸发)
B.向烧杯内通入二氧化碳,变浑浊
C.向烧杯内加入足量稀盐酸,没有气泡产生
D.向烧杯内加入氯化铵并微热,产生有氨味的气体
8. 将锌粉和铜粉的混合物M克,同时放入 50 克、质量分数为 6.8%的硝酸银溶液中,充分反应后过滤,得到滤渣和滤液。现进行如下操作,请根据现象回答。(1)、向滤渣中滴加稀盐酸,若有气体产生,则滤渣中肯定含有。(2)、向滤液里滴加稀盐酸,若有白色沉淀产生,则M取值范围是。9. 向一定质量的Mg(NO3)2和Cu(NO3)2混合溶液中加入a克锌粉和铁粉的混合物,充分反应后过滤,得到不饱和的滤液和滤渣,将滤渣洗涤、干燥后再称量,发现质量仍为a克。则滤液中一定含有的溶质是;若忽略操作中的溶液损失,滤液中溶质的质量 (填“大于”、 “小于”或“等于”)原混合溶液中溶质的质量。10. 有一包固体样品可能是由NaOH、CaCO3、K2SO4、CuSO4、MgSO4中的一种或几种组成。某兴趣小组同学为了确定其成分,进行如图实验: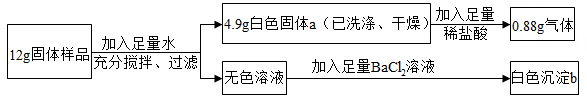 (1)、白色固体a的成分是 。(2)、固体样品中一定没有。11. 某白色固体中可能含有氯化钠、碳酸钠、硫酸钠、硫酸铜、碳酸钡、氯化钡中的几种物质,为了鉴定该白色固体的组成,拓展性学习小组的同学们进行可如下探究实验:
(1)、白色固体a的成分是 。(2)、固体样品中一定没有。11. 某白色固体中可能含有氯化钠、碳酸钠、硫酸钠、硫酸铜、碳酸钡、氯化钡中的几种物质,为了鉴定该白色固体的组成,拓展性学习小组的同学们进行可如下探究实验:Ⅰ.称取14克固体于烧杯中,加入足量水充分溶解,过滤得到白色沉淀8.6克和无色溶液。
Ⅱ.中所得8.6克白色沉淀中加入足量稀盐酸,沉淀部分溶解并有无色气体产生,测得剩余白色沉淀质量为4.66克。
Ⅲ.把I中所得滤液分成两份,第一份溶液中加入足量的稀硫酸,既没有产生气泡,也没有产生沉淀,第二份溶液中加入足量的氯化钡溶液,没有产生沉淀。
根据上述实验,回答下列问题:
(1)、根据以上实验现象 , 白色固体中一定含有的物质是;(2)、仅根据第Ⅲ步实验现象可以得出结论 ,溶液中一定不存在的离子是。12. 图为纯铜片A的系列变化,据图回答问题: (1)、若方法1中的X物质为常见气体,且发生置换反应,则X是(填化学式);(2)、铜片A、铜片B、铜片C的质量分别为、、 , 其中方法1和方法2均完全反应,则、、的大小关系为。13. 有一包固体,可能由硝酸铜、硫酸钠、氯化钠、碳酸钠、氢氧化钠中的一种或几种组成。为了探究该固体的组成,某化学小组设计并开展以下实验:
(1)、若方法1中的X物质为常见气体,且发生置换反应,则X是(填化学式);(2)、铜片A、铜片B、铜片C的质量分别为、、 , 其中方法1和方法2均完全反应,则、、的大小关系为。13. 有一包固体,可能由硝酸铜、硫酸钠、氯化钠、碳酸钠、氢氧化钠中的一种或几种组成。为了探究该固体的组成,某化学小组设计并开展以下实验:已知,步骤Ⅰ中固体全部消失,溶液呈蓝色。有气泡产生。步骤Ⅱ、Ⅲ中均可观察到有白色沉淀生成。请回答下列问题:
 (1)、原固体中一定含有的物质是。(2)、步骤Ⅲ所得蓝色滤液中一定含有的离子是。14. 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH、NaCl中的一种或几种。取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示。由此推断白色固体中肯定有 , 肯定没有 , 可能有。
(1)、原固体中一定含有的物质是。(2)、步骤Ⅲ所得蓝色滤液中一定含有的离子是。14. 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH、NaCl中的一种或几种。取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示。由此推断白色固体中肯定有 , 肯定没有 , 可能有。 15. 以下是质量分数相同的稀盐酸与Zn、Fe金属反应生成氢气的四个关系图,图中纵坐标y均表示生成氢气的质量。
15. 以下是质量分数相同的稀盐酸与Zn、Fe金属反应生成氢气的四个关系图,图中纵坐标y均表示生成氢气的质量。
根据下面的描述选择对应的图像(填写字母)
(1)、等量的Zn和Fe分别跟足量的稀盐酸反应,横坐标X表示所用金属质量的图。(2)、足量的Zn和Fe分别跟等质量的稀盐酸反应,横坐标X表示反应时间的图。(3)、等量的Zn和Fe分别跟足量的稀盐酸反应,横坐标X表示反应时间的图。(4)、等量Zn和Fe分别跟足量的稀盐酸反应,横坐标X表示稀盐酸质量的图。16. 在托盘天平(灵敏度极高)两边各放盛有等质量、等质量分数足量稀盐酸的烧杯,天平平衡,向左烧杯中缓慢加入一定质量的镁粉,同时向右烧杯中加入一定质量的铁粉,测量加入的金属质量m和相应的烧杯内物质质量变化量ΔM,画出ΔM—m曲线,并在坐标轴内画出曲线oac和obc,回答下列问题:①从向左右烧杯加入金属开始观察,当左右烧杯加入的金属粉末质量相同且观察到反应不再进行后停止观察,则指针变化情况为;
②m1:m2= , 曲线oac表示的是(选填“左边”或“右边”)烧杯中△M与m的变化关系
 17. 小蛟和小川用一只弹簧测力计,一根长度为lm、质量为1.2kg质量均匀分布的圆柱形螺紋钢AB,一只金属筐,制成了如下图所示的机械装置。制作时,将金属筐系于螺纹钢上的B端,当悬挂螺纹钢的钢索在螺纹钢上的悬吊点移至O点时,螺纹钢在水平位置平衡,测得OB=4cm,则金属筐的质量为kg。称重时,将重物放入金属筐中,用弹簧测力计竖真向下掉住螺纹钢的A端,使之再次在水平位置平衡,此时弹簧测力计示数为15N,则重物的质量是kg。若在她们制作的装置中仅将弹簧测力计换成质量为1kg的“秤砣”,制成杆秤,从O点开始,沿OA每隔1cm标出对应的质量刻度,则该杆秤的最小刻度值为kg。
17. 小蛟和小川用一只弹簧测力计,一根长度为lm、质量为1.2kg质量均匀分布的圆柱形螺紋钢AB,一只金属筐,制成了如下图所示的机械装置。制作时,将金属筐系于螺纹钢上的B端,当悬挂螺纹钢的钢索在螺纹钢上的悬吊点移至O点时,螺纹钢在水平位置平衡,测得OB=4cm,则金属筐的质量为kg。称重时,将重物放入金属筐中,用弹簧测力计竖真向下掉住螺纹钢的A端,使之再次在水平位置平衡,此时弹簧测力计示数为15N,则重物的质量是kg。若在她们制作的装置中仅将弹簧测力计换成质量为1kg的“秤砣”,制成杆秤,从O点开始,沿OA每隔1cm标出对应的质量刻度,则该杆秤的最小刻度值为kg。 18. 一小球从弧形轨道AOB上的A点由静止开始滑下(不计空气阻力)。(1)、如图甲所示,如果弧形轨道光滑,小球(选填(能”或“不能”)到达B点。(2)、如图乙所示,如果由于轨道不光滑,小球仅能滑到C点。当由C点返回后,仅能滑到D点,已知A、C高度差为hl , C、D高度差为h2 , 则h1h2(选填“>”“=”或“<”)。
18. 一小球从弧形轨道AOB上的A点由静止开始滑下(不计空气阻力)。(1)、如图甲所示,如果弧形轨道光滑,小球(选填(能”或“不能”)到达B点。(2)、如图乙所示,如果由于轨道不光滑,小球仅能滑到C点。当由C点返回后,仅能滑到D点,已知A、C高度差为hl , C、D高度差为h2 , 则h1h2(选填“>”“=”或“<”)。 19. 如图甲所示,在粗糙的斜面底部固定一个可伸缩的轻质弹簧,现将质量为m的物块左侧由高度为ha的A点沿斜面向下压缩弹簧至高度为hb的B点并由静止释放,物块沿斜面向上滑动,最终静止在斜面上高度为hd的D点:
19. 如图甲所示,在粗糙的斜面底部固定一个可伸缩的轻质弹簧,现将质量为m的物块左侧由高度为ha的A点沿斜面向下压缩弹簧至高度为hb的B点并由静止释放,物块沿斜面向上滑动,最终静止在斜面上高度为hd的D点:若换成表面光滑、其他条件完全相同的斜面,仍将质量为m的木块左侧从A点沿斜面向下压缩弹簧至B点由静止释放(如图乙所示),物块沿斜面向上滑至高度为hc的最高处C后。在斜面上的BC两点间来回滑动。
已知斜面上AB的长度为S1 ,AD的长度为S2 ,AC的长度为S3 , 则:

 (1)、甲图中,物块离开弹簧后,沿斜面向上滑动最终静止在D点的过程中受到的摩擦力方向为。(选填“向上”,“向下”或“先向下后向上”)(2)、甲图中物块沿斜面向上滑动时受到的摩擦力大小为。(用字母表示)(3)、乙图中,若把物块换成材料相同,质量为2m的大物块,仍将弹簧压缩到B点后重复上述过程,则大物块沿斜面向上滑动到的最高位置与C点相比将。(“变高”“变低”或“不变”)20.(1)、如图所示,湖水中有两艘小船,绳子的一端拴在甲船上,乙船上固定着滑轮,绳子绕过滑轮,站在甲船上的人用100N的力拉绳子的自由端。如果在20s内甲船向右匀速移动了10m,同时乙船向左匀速移动了4m,则人对绳子的力做功的功率是 W;
(1)、甲图中,物块离开弹簧后,沿斜面向上滑动最终静止在D点的过程中受到的摩擦力方向为。(选填“向上”,“向下”或“先向下后向上”)(2)、甲图中物块沿斜面向上滑动时受到的摩擦力大小为。(用字母表示)(3)、乙图中,若把物块换成材料相同,质量为2m的大物块,仍将弹簧压缩到B点后重复上述过程,则大物块沿斜面向上滑动到的最高位置与C点相比将。(“变高”“变低”或“不变”)20.(1)、如图所示,湖水中有两艘小船,绳子的一端拴在甲船上,乙船上固定着滑轮,绳子绕过滑轮,站在甲船上的人用100N的力拉绳子的自由端。如果在20s内甲船向右匀速移动了10m,同时乙船向左匀速移动了4m,则人对绳子的力做功的功率是 W; (2)、生活中我们经常用摩擦力的知识来分析拔河比赛的输赢情况。如图,小明和爸爸妈妈通过一个轻质滑轮组进行拔河比赛。已知爸爸与地面之间的摩擦力最大可达600牛。为了胜过爸爸,妈妈与地面间的摩擦力至少应达到 牛.
(2)、生活中我们经常用摩擦力的知识来分析拔河比赛的输赢情况。如图,小明和爸爸妈妈通过一个轻质滑轮组进行拔河比赛。已知爸爸与地面之间的摩擦力最大可达600牛。为了胜过爸爸,妈妈与地面间的摩擦力至少应达到 牛. 21. 小宁用如图所示的装置探究杠杆的机械效率,杠杆的质量分布均匀,右端固定在O点,杠杆可绕O点在竖直平面内转动,且AC=BC=OA;他将重为G的钩码悬挂在A点,在B点竖直向上匀速拉动弹簧测力计,测力计的示数为F1 , 此次杠杆的机械效率为η1;若保持弹簧测力计位置不变,将钩码挂在C点,缓慢拉动弹簧测力计将钩码提升相同的高度(不计摩擦),弹簧测力计的示数F2 , 此次杠杆的机械效率为η2。则 F1F2 , η1η2(选填“>”或“<”或“=”)。
21. 小宁用如图所示的装置探究杠杆的机械效率,杠杆的质量分布均匀,右端固定在O点,杠杆可绕O点在竖直平面内转动,且AC=BC=OA;他将重为G的钩码悬挂在A点,在B点竖直向上匀速拉动弹簧测力计,测力计的示数为F1 , 此次杠杆的机械效率为η1;若保持弹簧测力计位置不变,将钩码挂在C点,缓慢拉动弹簧测力计将钩码提升相同的高度(不计摩擦),弹簧测力计的示数F2 , 此次杠杆的机械效率为η2。则 F1F2 , η1η2(选填“>”或“<”或“=”)。 22. 小科同学设计的“风力测试仪”在校科技节上备受师生们的青睐,“风力测试仪”的原理如图所示。电源电压U=6V,R0为保护电阻,AB为长L=40cm、阻值为R=100的均匀电阻丝。OP为质量、电阻均不计的金属细杆,下端连接一个重为G=2N的球P。闭合开关S,无风时,OP下垂并与电阻丝的接触点O,O为电阻丝AB的中点;无风时,电流表示数为0.1A;有风时,球P受风力的作用,使金属细杆OP绕悬挂点O偏转,最终处于稳定状态。已知悬挂点O与电阻丝上O点的距离为h=10cm,金属细杆OP始终与电阻丝AB接触良好且无摩擦,求:
22. 小科同学设计的“风力测试仪”在校科技节上备受师生们的青睐,“风力测试仪”的原理如图所示。电源电压U=6V,R0为保护电阻,AB为长L=40cm、阻值为R=100的均匀电阻丝。OP为质量、电阻均不计的金属细杆,下端连接一个重为G=2N的球P。闭合开关S,无风时,OP下垂并与电阻丝的接触点O,O为电阻丝AB的中点;无风时,电流表示数为0.1A;有风时,球P受风力的作用,使金属细杆OP绕悬挂点O偏转,最终处于稳定状态。已知悬挂点O与电阻丝上O点的距离为h=10cm,金属细杆OP始终与电阻丝AB接触良好且无摩擦,求: (1)、R0的阻值为Ω;(2)、风力F与电流I关系式为。23. 如图,甲,乙为两只相同电表,当闭合S1 , S2时,甲,乙两表示数之比为4:3,则两表均为“表,电路总功率为P1;同时更换两电表种类,调整开关状态,使两表均有正常示数,此时电路总功率为P2 , 则P1:P2为.
(1)、R0的阻值为Ω;(2)、风力F与电流I关系式为。23. 如图,甲,乙为两只相同电表,当闭合S1 , S2时,甲,乙两表示数之比为4:3,则两表均为“表,电路总功率为P1;同时更换两电表种类,调整开关状态,使两表均有正常示数,此时电路总功率为P2 , 则P1:P2为. 24. 如图所示,物体A在水平桌面上,绳重及绳和滑轮、滑轮与轴间的摩擦不计,动滑轮重力为2N。当B物体重力为8N时,它恰好能匀速下降。
24. 如图所示,物体A在水平桌面上,绳重及绳和滑轮、滑轮与轴间的摩擦不计,动滑轮重力为2N。当B物体重力为8N时,它恰好能匀速下降。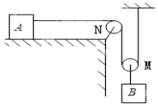 (1)、物体A所受的摩擦力为。(2)、若用一个水平向左的力F拉物体A,使B以2m/s的速度匀上升,则F的功率为。25. 如图所示的电路总电压不变。只闭合开关S3 , 滑动变阻器的滑片P在最左端时,电路消耗总功率为10W,电流表的示数为I1;只断开开关S1 , 滑片P移至最右端时,电流表的示数为I2 , 电压表的示数为U1;只闭合开关S1 , 滑片P仍在最右端时,电压表示数为U2。若I1:I2=5:3,U1:U2=2:3。则上述三个状态中,电路消耗总功率的最小值是W。
(1)、物体A所受的摩擦力为。(2)、若用一个水平向左的力F拉物体A,使B以2m/s的速度匀上升,则F的功率为。25. 如图所示的电路总电压不变。只闭合开关S3 , 滑动变阻器的滑片P在最左端时,电路消耗总功率为10W,电流表的示数为I1;只断开开关S1 , 滑片P移至最右端时,电流表的示数为I2 , 电压表的示数为U1;只闭合开关S1 , 滑片P仍在最右端时,电压表示数为U2。若I1:I2=5:3,U1:U2=2:3。则上述三个状态中,电路消耗总功率的最小值是W。 26. 如图甲电路,滑动变阻器铭牌上标有“? 1 A”,电流表所用的量程为0~3 A,两个电压表的量程均为0~15 V。当只闭合开关S时,滑动变阻器滑片在最右端时,滑动变阻器的功率为P1 , 向左端逐渐调节滑片直至灯泡正常发光,此时滑动变阳器接人阻值为最大阻值的0.2倍,滑动变阻器的功率为P2 , P1:P2=64:45,电流表与两电压表示数变化如图乙,则灯泡的额定功率为W。闭合三个开关,将滑动变阻器滑片调至最右端后,电流表示数为0.9A。若任意闭合开关,保证电路中有电流且电路安全,则整个电路最大功率与最小功率的比为。
26. 如图甲电路,滑动变阻器铭牌上标有“? 1 A”,电流表所用的量程为0~3 A,两个电压表的量程均为0~15 V。当只闭合开关S时,滑动变阻器滑片在最右端时,滑动变阻器的功率为P1 , 向左端逐渐调节滑片直至灯泡正常发光,此时滑动变阳器接人阻值为最大阻值的0.2倍,滑动变阻器的功率为P2 , P1:P2=64:45,电流表与两电压表示数变化如图乙,则灯泡的额定功率为W。闭合三个开关,将滑动变阻器滑片调至最右端后,电流表示数为0.9A。若任意闭合开关,保证电路中有电流且电路安全,则整个电路最大功率与最小功率的比为。 27. 如图甲所示电路,电源电压保持不变,当闭合开关S,调节滑动变阻器从阻值最大变化到最小,两个电阻的“U-I”关系图象如图乙所示。则电源电压为V,定值电阻R1的阻值为Ω,整个电路的最大功率为W。
27. 如图甲所示电路,电源电压保持不变,当闭合开关S,调节滑动变阻器从阻值最大变化到最小,两个电阻的“U-I”关系图象如图乙所示。则电源电压为V,定值电阻R1的阻值为Ω,整个电路的最大功率为W。 28. 如图甲所示电路中, 电源电压保持不变, 闭合开关 s,滑动变阻器滑片从 b 点向左移动到某点的过程中,两个电压表示数随电流表示数变化的图像如图乙所示, 则电源电压为V。 当滑片在 a 点时, 整个电路消耗的电功率为W。
28. 如图甲所示电路中, 电源电压保持不变, 闭合开关 s,滑动变阻器滑片从 b 点向左移动到某点的过程中,两个电压表示数随电流表示数变化的图像如图乙所示, 则电源电压为V。 当滑片在 a 点时, 整个电路消耗的电功率为W。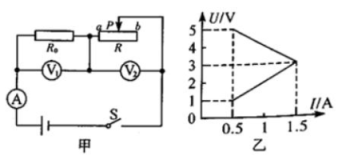 29. 如图甲所示,R1=R2 , 断开开关S时,电路消耗的总功率为P1 , 若将开关S与电源的位置对换后,闭合S,电路消耗总功率为P2 , 则P1:P2= , 将甲图所示电路改变为乙图所示的电路,若R1=4Ω,电源电压为8V,小灯泡的额定功率为4W,闭合开关灯泡正常发光,则小灯泡的额定电压是V。
29. 如图甲所示,R1=R2 , 断开开关S时,电路消耗的总功率为P1 , 若将开关S与电源的位置对换后,闭合S,电路消耗总功率为P2 , 则P1:P2= , 将甲图所示电路改变为乙图所示的电路,若R1=4Ω,电源电压为8V,小灯泡的额定功率为4W,闭合开关灯泡正常发光,则小灯泡的额定电压是V。 30. 2022年冬季奥林匹克运动会主办城市是北京,北京成为第一个举办过夏季奥林匹克运动会和冬季奥林匹克运动会以及亚洲运动会三项国际赛事的城市。在某场馆建设中,有甲、乙、丙三种场景,回答下列问题:
30. 2022年冬季奥林匹克运动会主办城市是北京,北京成为第一个举办过夏季奥林匹克运动会和冬季奥林匹克运动会以及亚洲运动会三项国际赛事的城市。在某场馆建设中,有甲、乙、丙三种场景,回答下列问题: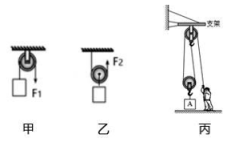 (1)、在甲、乙两场景中,甲、乙两物体在F1、F2作用下匀速上升,若F1=F2 , 不计摩擦及绳与滑轮的重,则G甲:G乙=。(2)、在丙场景中,工人站在水平地面上,竖直向下拉动绳子自由端,使物体A在5s 内匀速上升了1m。已知物体A重400N,动滑轮重为100N,不计摩擦及绳重,则拉力的功率为瓦,滑轮组的机械效率为。31. 我国空间站水、气整合循环系统利用“萨巴蒂尔反应”,将CO2转化为H2O,配合水电解系统实现O2和H2的再生,而电能来自太阳能电池板的光电转换,反应流程如图所示。请根据图示回答下列问题:
(1)、在甲、乙两场景中,甲、乙两物体在F1、F2作用下匀速上升,若F1=F2 , 不计摩擦及绳与滑轮的重,则G甲:G乙=。(2)、在丙场景中,工人站在水平地面上,竖直向下拉动绳子自由端,使物体A在5s 内匀速上升了1m。已知物体A重400N,动滑轮重为100N,不计摩擦及绳重,则拉力的功率为瓦,滑轮组的机械效率为。31. 我国空间站水、气整合循环系统利用“萨巴蒂尔反应”,将CO2转化为H2O,配合水电解系统实现O2和H2的再生,而电能来自太阳能电池板的光电转换,反应流程如图所示。请根据图示回答下列问题: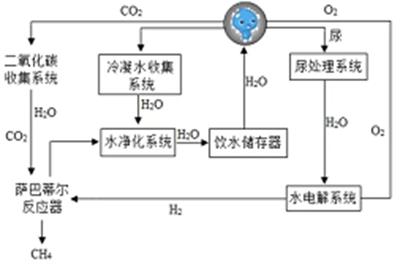 (1)、在空间站内,CO2和H2O都是航天员的代谢产物,当血液流经肾脏时,经过肾小球的滤过作用和 的重吸作用形成尿液,尿液中含有大量的水。(2)、写出水电解系统中发生反应的化学方程式。(3)、在流程图所示的物质转化中,进入水电解系统的水的质量(选填“大于”、“等于”或“小于”)萨巴蒂尔反应系统中生成水的质量。32. 在临床常用C-14尿素【CO(NH2)2】呼气试验来检测幽门螺杆菌。用同位素标记尿素,口服后测定呼气中标记的二氧化碳的量,间接反映尿素酶的量,该试验的原理是:若胃内有幽门螺杆菌,口服有同位素标记的尿素溶液在尿素酶的作用下分解为有标记的二氧化碳和氨气,经胃肠道吸收后随呼吸排出,收集呼出的气体即可计算有标记的二氧化碳的量,如无幽门螺杆菌感染,则无同位素标记的二氧化碳呼出。
(1)、在空间站内,CO2和H2O都是航天员的代谢产物,当血液流经肾脏时,经过肾小球的滤过作用和 的重吸作用形成尿液,尿液中含有大量的水。(2)、写出水电解系统中发生反应的化学方程式。(3)、在流程图所示的物质转化中,进入水电解系统的水的质量(选填“大于”、“等于”或“小于”)萨巴蒂尔反应系统中生成水的质量。32. 在临床常用C-14尿素【CO(NH2)2】呼气试验来检测幽门螺杆菌。用同位素标记尿素,口服后测定呼气中标记的二氧化碳的量,间接反映尿素酶的量,该试验的原理是:若胃内有幽门螺杆菌,口服有同位素标记的尿素溶液在尿素酶的作用下分解为有标记的二氧化碳和氨气,经胃肠道吸收后随呼吸排出,收集呼出的气体即可计算有标记的二氧化碳的量,如无幽门螺杆菌感染,则无同位素标记的二氧化碳呼出。
 (1)、在整个测定过程中,"C-14"随血液循环首先进入图甲心脏四腔中的(选填血管内血流方向数字)(2)、如图乙所示曲线分别表示血液流经肺部后血液中氧和二氧化碳含量的变化情况,表示氧化碳变化的是曲线。(填“A”或“B”)33. 人工肺又名氧合器或气体交换器,通过人工肺(ECMO)可以有效提高新冠肺炎患者的血氧饱和度,降低死亡率。右下图为人工肺的工作原理示意图,人工肺的主体部分由中空纤维膜制成,可在病人自身肺功能出现衰竭时使用。请分析回答:
(1)、在整个测定过程中,"C-14"随血液循环首先进入图甲心脏四腔中的(选填血管内血流方向数字)(2)、如图乙所示曲线分别表示血液流经肺部后血液中氧和二氧化碳含量的变化情况,表示氧化碳变化的是曲线。(填“A”或“B”)33. 人工肺又名氧合器或气体交换器,通过人工肺(ECMO)可以有效提高新冠肺炎患者的血氧饱和度,降低死亡率。右下图为人工肺的工作原理示意图,人工肺的主体部分由中空纤维膜制成,可在病人自身肺功能出现衰竭时使用。请分析回答: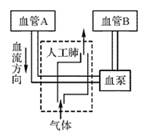 (1)、血液流经ECMO前后的主要变化是。(2)、图中血泵代替患者的。(3)、制造人工肺的膜材料要求较高,所用膜材料应该只允许通过。(4)、使用人工肺存在细菌感染的风险。由于各种管路及装置直接与血液系统相连,细菌可能通过管路进入血液引发感染,导致患者血液中会明显增加。34. 如图所示为人体体温调节示意图,据图回答有关问题:
(1)、血液流经ECMO前后的主要变化是。(2)、图中血泵代替患者的。(3)、制造人工肺的膜材料要求较高,所用膜材料应该只允许通过。(4)、使用人工肺存在细菌感染的风险。由于各种管路及装置直接与血液系统相连,细菌可能通过管路进入血液引发感染,导致患者血液中会明显增加。34. 如图所示为人体体温调节示意图,据图回答有关问题: (1)、图中T—E—N—F—A途径表示(选填“激素调节”或“神经调节”),体温调节中枢位于中。(2)、有病人体温在24 h内都处于39.5 ℃,若a、c分别表示产生和散失的热量,则这24 h内ac(选填“>”“<”或“=”);经过诊断,医生决定给病人注射退烧药,通过肌肉注射的药液首先进入病人心脏的部位是。35. 如图是表示人体与外界环境之间的物质交换模式图,“数字”代表人体的某些结构,“字母”代表人体内某些物质,“→”代表物质交换的方向。请分析作答:
(1)、图中T—E—N—F—A途径表示(选填“激素调节”或“神经调节”),体温调节中枢位于中。(2)、有病人体温在24 h内都处于39.5 ℃,若a、c分别表示产生和散失的热量,则这24 h内ac(选填“>”“<”或“=”);经过诊断,医生决定给病人注射退烧药,通过肌肉注射的药液首先进入病人心脏的部位是。35. 如图是表示人体与外界环境之间的物质交换模式图,“数字”代表人体的某些结构,“字母”代表人体内某些物质,“→”代表物质交换的方向。请分析作答: (1)、进入[2]中的[C]通过作用,进入血液。(2)、在循环系统中,[D]血液流动的方向是一定的,心脏、静脉中防止血液倒流的瓣膜有(请写全)。(3)、除图示途径外,代谢废物还可以通过(器官名称)排出体外。(4)、“生物的形态、结构与功能相适应”“生物的形态、结构、生理与环境相适应”是常见的生物学现象,也是生物学的基本原理。例如:沙漠中仙人掌的叶呈针状,有利于减少水分的散失。请你依照上例,说说人体循环系统中的一种适应现象。
(1)、进入[2]中的[C]通过作用,进入血液。(2)、在循环系统中,[D]血液流动的方向是一定的,心脏、静脉中防止血液倒流的瓣膜有(请写全)。(3)、除图示途径外,代谢废物还可以通过(器官名称)排出体外。(4)、“生物的形态、结构与功能相适应”“生物的形态、结构、生理与环境相适应”是常见的生物学现象,也是生物学的基本原理。例如:沙漠中仙人掌的叶呈针状,有利于减少水分的散失。请你依照上例,说说人体循环系统中的一种适应现象。