九年级科学2022年寒假每日一练:第二章选择题专练(优生加练)
试卷更新日期:2023-01-12 类型:复习试卷
一、单选题
-
1. 现有相同质量的金属锌和铁,放入足量的等质量分数的稀硫酸中,生成氢气的质量与反应时间的关系如图所示,下列结论合理的是( )
 A、A代表铁,B代表锌 B、B代表铁,A代表锌 C、金属活动性A>B D、相对原子质量A>B2. 将锌粉持续加入100g含有和两种溶质的混合溶液中,充分反应。当加入锌粉的质量为6.5g时,溶液质量最小;当加入锌粉的质量为13.0g时,恰好完全反应。下列是反应中的相关量随加入锌的质量变化的关系图,其中正确的是( )A、
A、A代表铁,B代表锌 B、B代表铁,A代表锌 C、金属活动性A>B D、相对原子质量A>B2. 将锌粉持续加入100g含有和两种溶质的混合溶液中,充分反应。当加入锌粉的质量为6.5g时,溶液质量最小;当加入锌粉的质量为13.0g时,恰好完全反应。下列是反应中的相关量随加入锌的质量变化的关系图,其中正确的是( )A、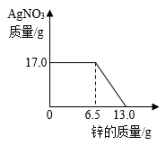 B、
B、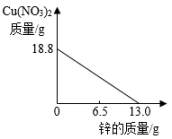 C、
C、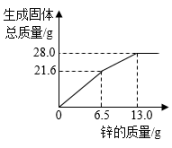 D、
D、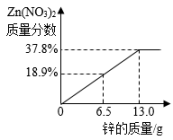 3. 某混合物X由Al2O3 , Fe2O3 , Cu,SiO2中的一种或几种组成。分别对X进行如下实验,有关说法错误的是( )
3. 某混合物X由Al2O3 , Fe2O3 , Cu,SiO2中的一种或几种组成。分别对X进行如下实验,有关说法错误的是( ) A、由I可知,X中一定存在Fe2O3、Cu B、由II和III可得出结论,混合物中无Al2O3 C、1.92g固体为SiO2和Cu的混合物 D、原混合物中Fe2O3和Cu的质量比为1:14. 将锌粉持续加入到100g含有AgNO3和Cu(NO3)2两种溶质的混合溶液中,充分反应。当加入锌粉的质量为6.5g时,溶液质量最小;当加入锌粉的质量为13.0g时,恰好完全反应。下列是反应中的相关量随加入锌的质量变化的关系图,其中正确的是( )A、
A、由I可知,X中一定存在Fe2O3、Cu B、由II和III可得出结论,混合物中无Al2O3 C、1.92g固体为SiO2和Cu的混合物 D、原混合物中Fe2O3和Cu的质量比为1:14. 将锌粉持续加入到100g含有AgNO3和Cu(NO3)2两种溶质的混合溶液中,充分反应。当加入锌粉的质量为6.5g时,溶液质量最小;当加入锌粉的质量为13.0g时,恰好完全反应。下列是反应中的相关量随加入锌的质量变化的关系图,其中正确的是( )A、 B、
B、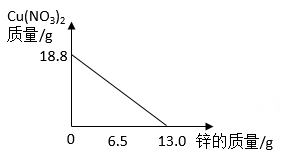 C、
C、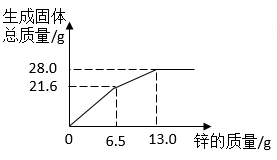 D、
D、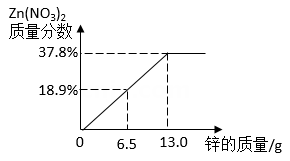 5. 小敏称取等质量的铜粉和铁粉,分别加入到25毫升溶质质量分数为12%的硝酸银溶液中(如图所示),充分反应。下列情况可能出现的是( )
5. 小敏称取等质量的铜粉和铁粉,分别加入到25毫升溶质质量分数为12%的硝酸银溶液中(如图所示),充分反应。下列情况可能出现的是( )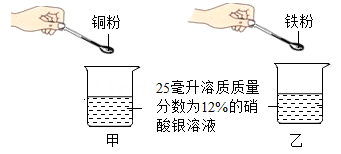 A、铁和铜都有剩余,甲、乙生成银的质量比为7:8 B、铁和铜都没有剩余,甲、乙生成银的质量比为1:1 C、铁有剩余,铜没有剩余,甲、乙生成银的质量比为15:16 D、铜有剩余,铁没有剩余,甲、乙生成银的质量比为15:146. 将等质量的锌、铁、镁三种金属分别加入三杯质量和溶质质量分数均相同的稀盐酸中,产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是( )
A、铁和铜都有剩余,甲、乙生成银的质量比为7:8 B、铁和铜都没有剩余,甲、乙生成银的质量比为1:1 C、铁有剩余,铜没有剩余,甲、乙生成银的质量比为15:16 D、铜有剩余,铁没有剩余,甲、乙生成银的质量比为15:146. 将等质量的锌、铁、镁三种金属分别加入三杯质量和溶质质量分数均相同的稀盐酸中,产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是( )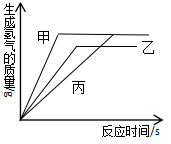 A、反应后金属镁和铁有剩余 B、反应后乙杯中的溶质可能只有一种 C、参加反应的锌和铁的质量比可能为8: 7 D、反应后,在甲杯中滴入硝酸银溶液有沉淀产生,说明盐酸可能有剩余7. 实验小组按如图流程进行实验(每步均充分反应)。反应结束后,将烧杯内物质进行过滤,向滤渣中加入稀盐酸,无明显现象。下列说法正确的是( )
A、反应后金属镁和铁有剩余 B、反应后乙杯中的溶质可能只有一种 C、参加反应的锌和铁的质量比可能为8: 7 D、反应后,在甲杯中滴入硝酸银溶液有沉淀产生,说明盐酸可能有剩余7. 实验小组按如图流程进行实验(每步均充分反应)。反应结束后,将烧杯内物质进行过滤,向滤渣中加入稀盐酸,无明显现象。下列说法正确的是( ) A、本实验不可判断铁、铜、镁的金属活动性顺序 B、两支试管内的物质混合前后,固体总质量一定增加 C、滤渣中一定有Cu,一定没有Mg,可能有Fe D、滤液中的溶质一定有FeCl2、MgCl2、CuCl28. 下列图像不能正确反映对应变化关系的是( )A、
A、本实验不可判断铁、铜、镁的金属活动性顺序 B、两支试管内的物质混合前后,固体总质量一定增加 C、滤渣中一定有Cu,一定没有Mg,可能有Fe D、滤液中的溶质一定有FeCl2、MgCl2、CuCl28. 下列图像不能正确反映对应变化关系的是( )A、 向硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入锌粉至过量
B、
向硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入锌粉至过量
B、 向等质量的镁粉、锌粉和铁粉中,分别加入相同质量分数的稀盐酸
C、
向等质量的镁粉、锌粉和铁粉中,分别加入相同质量分数的稀盐酸
C、 向盐酸和氯化钙的混合溶液中逐滴加入纯碱溶液至过量
D、
向盐酸和氯化钙的混合溶液中逐滴加入纯碱溶液至过量
D、 将氢气通入足量的灼热氧化铜固体中,铜元素质量分数的变化
9. 向盛有 10g 49%稀硫酸的烧杯中加入 5.6g 的铁粉,充分反应后有固体残留, t1时迅速倒入一定量的硫酸铜溶液。整个过程烧杯中溶液的质量随时间的变化如图所示,下列分析正确的是( )
将氢气通入足量的灼热氧化铜固体中,铜元素质量分数的变化
9. 向盛有 10g 49%稀硫酸的烧杯中加入 5.6g 的铁粉,充分反应后有固体残留, t1时迅速倒入一定量的硫酸铜溶液。整个过程烧杯中溶液的质量随时间的变化如图所示,下列分析正确的是( ) A、a→b 点,溶液的 pH 一直增大 B、m=12.7g C、c 点时,烧杯中有 4 种物质 D、d点固体,加入盐酸有气泡产生10. 为探究锌、铜、铁三种金属的活动性顺序及其相关性质,某学习小组做了如甲图所示实验。实验结束后,将试管①、试管②内的物质全部倒入同一洁净烧杯中,充分反应后如乙图所示。将烧杯乙中的物质过滤,得到滤渣和滤液。下列有关说法正确的是( )
A、a→b 点,溶液的 pH 一直增大 B、m=12.7g C、c 点时,烧杯中有 4 种物质 D、d点固体,加入盐酸有气泡产生10. 为探究锌、铜、铁三种金属的活动性顺序及其相关性质,某学习小组做了如甲图所示实验。实验结束后,将试管①、试管②内的物质全部倒入同一洁净烧杯中,充分反应后如乙图所示。将烧杯乙中的物质过滤,得到滤渣和滤液。下列有关说法正确的是( ) A、滤渣中最多有三种物质 B、若滤液呈无色,滤液中的溶质可能有两种 C、若滤液中含有硫酸铜,滤渣中可能有两种物质 D、滤液的质量可能小于甲图中向两试管中加入的FeSO4溶液和稀硫酸的质量之和11. 一个烧杯中盛放有一定质量的氧化铜,向烧杯中加入一定量的稀硫酸。一段时间后发现烧杯中无固体残留,再向烧杯中加入14g铁粉,充分反应后,将烧杯中物质进行过滤,经洗涤干燥后称得滤渣质量为m,忽略外界环境和实验操作等因素对滤渣质量称量的影响,则以下判断正确的是( )A、m 可能大于 16g B、若 m=14g,则反应产物中一定有氢气 C、若 m=14g,滤渣中一定不含铁 D、若 m=16g,则过滤所得的滤液中一定只含一种溶质12. 向硝酸银和硝酸镁的混合溶液中加入一定量锌粉和铁粉的混合物,充分反应后过滤,得滤渣和滤液,向滤液中加入适量的稀盐酸,无沉淀出现,则下列说法中正确的是( )A、滤渣中一定有银、铁,可能有锌,滤液中一定有Mg+、Zn2+ , 可能有Fe2+ B、滤渣中一定有银、铁,可能有锌,滤液中一定有Mg2+、Zn2+、Fe2+ , 可能有Ag+ C、滤渣中一定有银,可能有锌、铁,滤液中一定有Mg2+、Zn2+ , 可能有Fe2+ D、滤渣中一定有银,可能有锌铁,滤液中一定有Mg2+ , 可能有Zn2+、Fe2+、Ag+13. 将ag锌粒加入一定质量的MgSO4、CuSO4和AgNO3的混合溶液中,充分反应后过滤,将滤渣洗涤、烘干后称量质量为bg,向滤液和滤渣中分别加入稀盐酸,下列有关现象和结论,不合理的是( )A、如果滤液中产生白色沉淀,则滤液的颜色为蓝色 B、滤渣的质量可能等于所加锌粒的质量 C、如果滤渣中有气体生成,则滤渣中一定含有4种金属 D、反应后所得滤液中至少含有两种金属离子14. 在5.6g铁粉中,先逐滴加入一定量的Cu(NO3)2溶液,充分反应后再逐滴加入AgNO3溶液,剩余固体质量与所加溶液总质量的关系如图所示。下列说法正确的是( )
A、滤渣中最多有三种物质 B、若滤液呈无色,滤液中的溶质可能有两种 C、若滤液中含有硫酸铜,滤渣中可能有两种物质 D、滤液的质量可能小于甲图中向两试管中加入的FeSO4溶液和稀硫酸的质量之和11. 一个烧杯中盛放有一定质量的氧化铜,向烧杯中加入一定量的稀硫酸。一段时间后发现烧杯中无固体残留,再向烧杯中加入14g铁粉,充分反应后,将烧杯中物质进行过滤,经洗涤干燥后称得滤渣质量为m,忽略外界环境和实验操作等因素对滤渣质量称量的影响,则以下判断正确的是( )A、m 可能大于 16g B、若 m=14g,则反应产物中一定有氢气 C、若 m=14g,滤渣中一定不含铁 D、若 m=16g,则过滤所得的滤液中一定只含一种溶质12. 向硝酸银和硝酸镁的混合溶液中加入一定量锌粉和铁粉的混合物,充分反应后过滤,得滤渣和滤液,向滤液中加入适量的稀盐酸,无沉淀出现,则下列说法中正确的是( )A、滤渣中一定有银、铁,可能有锌,滤液中一定有Mg+、Zn2+ , 可能有Fe2+ B、滤渣中一定有银、铁,可能有锌,滤液中一定有Mg2+、Zn2+、Fe2+ , 可能有Ag+ C、滤渣中一定有银,可能有锌、铁,滤液中一定有Mg2+、Zn2+ , 可能有Fe2+ D、滤渣中一定有银,可能有锌铁,滤液中一定有Mg2+ , 可能有Zn2+、Fe2+、Ag+13. 将ag锌粒加入一定质量的MgSO4、CuSO4和AgNO3的混合溶液中,充分反应后过滤,将滤渣洗涤、烘干后称量质量为bg,向滤液和滤渣中分别加入稀盐酸,下列有关现象和结论,不合理的是( )A、如果滤液中产生白色沉淀,则滤液的颜色为蓝色 B、滤渣的质量可能等于所加锌粒的质量 C、如果滤渣中有气体生成,则滤渣中一定含有4种金属 D、反应后所得滤液中至少含有两种金属离子14. 在5.6g铁粉中,先逐滴加入一定量的Cu(NO3)2溶液,充分反应后再逐滴加入AgNO3溶液,剩余固体质量与所加溶液总质量的关系如图所示。下列说法正确的是( ) A、所加溶液质量为Mg时,生成Cu的质量为m1g B、bc段发生的是Cu和AgNO3溶液的反应 C、m3的值为21.6 D、e点溶液中不含Cu(NO3)215. 某溶液含有Cu(NO3)2和AgNO3 , 现向混合溶液中加入一定量的锌粉,参加反应的锌质量与溶液中金属离子种类的关系如图所示。下列说法错误的是( )
A、所加溶液质量为Mg时,生成Cu的质量为m1g B、bc段发生的是Cu和AgNO3溶液的反应 C、m3的值为21.6 D、e点溶液中不含Cu(NO3)215. 某溶液含有Cu(NO3)2和AgNO3 , 现向混合溶液中加入一定量的锌粉,参加反应的锌质量与溶液中金属离子种类的关系如图所示。下列说法错误的是( ) A、ab间(不含两点)的溶液中金属离子为Zn2+、Ag+、Cu2+ B、cd间(不含两点)的溶液中金属离子为Zn2+、Cu2+ C、当参加反应的锌质量为m3时,溶液中金属离子为Zn2+ D、当参加反应的锌质量分别为m1、m2时,溶液中Cu(NO3)2的溶质质量分数相等16. 将等质量的镁、铁、锌,分别放入三份质量分数相同的稀盐酸中,反应生成的氢气质量与反应时间的关系如图所示。根据图中信息,下列判断正确的是( )
A、ab间(不含两点)的溶液中金属离子为Zn2+、Ag+、Cu2+ B、cd间(不含两点)的溶液中金属离子为Zn2+、Cu2+ C、当参加反应的锌质量为m3时,溶液中金属离子为Zn2+ D、当参加反应的锌质量分别为m1、m2时,溶液中Cu(NO3)2的溶质质量分数相等16. 将等质量的镁、铁、锌,分别放入三份质量分数相同的稀盐酸中,反应生成的氢气质量与反应时间的关系如图所示。根据图中信息,下列判断正确的是( ) A、图线 y 表示镁的反应情况 B、镁一定过量 C、锌一定过量 D、镁消耗稀盐酸的质量最大17. 小陈向装有硫酸铜溶液的烧杯中加入一定量铁粉,测得烧杯中溶液质量随加入铁粉质量的变化关系如图,则以下分析正确的是 ( )
A、图线 y 表示镁的反应情况 B、镁一定过量 C、锌一定过量 D、镁消耗稀盐酸的质量最大17. 小陈向装有硫酸铜溶液的烧杯中加入一定量铁粉,测得烧杯中溶液质量随加入铁粉质量的变化关系如图,则以下分析正确的是 ( ) A、点a时的溶液中暂无金属铜生成 B、当加入铁粉质量为m1时,溶液变为无色透明 C、点b时过滤出烧杯中的固体,加入稀盐酸后会产生气泡 D、若纵坐标表示烧杯内物质的总质量,所得图像不变18. 在一定量AgNO3和Cu(NO3)2的混合溶液中加入铁粉,充分反应后,下图描述的相关变化曲线错误的是( )A、
A、点a时的溶液中暂无金属铜生成 B、当加入铁粉质量为m1时,溶液变为无色透明 C、点b时过滤出烧杯中的固体,加入稀盐酸后会产生气泡 D、若纵坐标表示烧杯内物质的总质量,所得图像不变18. 在一定量AgNO3和Cu(NO3)2的混合溶液中加入铁粉,充分反应后,下图描述的相关变化曲线错误的是( )A、 B、
B、 C、
C、 D、
D、 19. 有等质量的镁和铁,前者放入质量分数为10%的稀硫酸中,后者放入质量分数为10%的稀盐酸中,产生氢气的质量随时间变化曲线如图所示。
19. 有等质量的镁和铁,前者放入质量分数为10%的稀硫酸中,后者放入质量分数为10%的稀盐酸中,产生氢气的质量随时间变化曲线如图所示。下列说法错误的是( )
 A、镁和铁中至少有一种剩余 B、消耗的稀硫酸和稀盐酸质量相等 C、消耗铁的质量一定大于消耗镁的质量 D、这个实验不能证明镁的金属活动性比铁强20. 有一包金属粉末,可能由Mg、Zn、Fe、Al、Ag这几种金属中的一种或几种组成。取该样品2.4g,加入100g稀硫酸恰好完全反应,只得到0.2gH2和无色溶液。下列说法正确的是( )A、样品中一定只含有Mg B、样品中一定不含有Ag,可能含有Fe C、该粉末中最多含有3种金属 D、100g稀硫酸中含H2SO4质量为19.6g21. 下列图像能正确反映所对应叙述关系的是( )A、向pH=3的溶液中不断加水
A、镁和铁中至少有一种剩余 B、消耗的稀硫酸和稀盐酸质量相等 C、消耗铁的质量一定大于消耗镁的质量 D、这个实验不能证明镁的金属活动性比铁强20. 有一包金属粉末,可能由Mg、Zn、Fe、Al、Ag这几种金属中的一种或几种组成。取该样品2.4g,加入100g稀硫酸恰好完全反应,只得到0.2gH2和无色溶液。下列说法正确的是( )A、样品中一定只含有Mg B、样品中一定不含有Ag,可能含有Fe C、该粉末中最多含有3种金属 D、100g稀硫酸中含H2SO4质量为19.6g21. 下列图像能正确反映所对应叙述关系的是( )A、向pH=3的溶液中不断加水 B、一定量的稀硫酸与锌粒反应
B、一定量的稀硫酸与锌粒反应  C、向H2SO4和CuSO4混合液中滴加NaOH溶液
C、向H2SO4和CuSO4混合液中滴加NaOH溶液 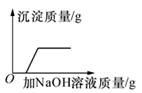 D、煅烧一定质量的石灰石
D、煅烧一定质量的石灰石 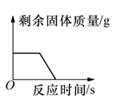 22. 三份完全相同的稀盐酸分别与一定质量的锌、铁、镁充分反应,产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是( )
22. 三份完全相同的稀盐酸分别与一定质量的锌、铁、镁充分反应,产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是( ) A、曲线X、Y、Z分别表示铁、锌、镁的反应情况 B、三份稀盐酸可能都被完全反应 C、三种金属的质量关系一定是m镁<m锌<m铁 D、反应结束后锌和镁一定都没有剩余,铁可能有剩余23. 现把足量的稀盐酸分为两等份,分别与等质量金属X、Y反应(生成的盐中金属元素的化合价均为正二价),生成气体的质量与时间的关系如图所示。则下列说法中,错误的是( )
A、曲线X、Y、Z分别表示铁、锌、镁的反应情况 B、三份稀盐酸可能都被完全反应 C、三种金属的质量关系一定是m镁<m锌<m铁 D、反应结束后锌和镁一定都没有剩余,铁可能有剩余23. 现把足量的稀盐酸分为两等份,分别与等质量金属X、Y反应(生成的盐中金属元素的化合价均为正二价),生成气体的质量与时间的关系如图所示。则下列说法中,错误的是( ) A、金属X、Y的活动性关系:X>Y B、金属完全反应时消耗稀盐酸的质量:X=Y C、X、Y的相对原子质量大小关系:X< Y D、t3时烧杯中溶液的质量:X< Y24. “假黄金”黄铜(铜锌合金)的颜色酷似黄金,不法分子常常用“假黄金”以假乱真,牟取暴利。科学小组为探究某黄铜中锌的含量,向10.0g黄铜样品中加稀盐酸,测得实验数据如图所示。下列分析正确的是( )
A、金属X、Y的活动性关系:X>Y B、金属完全反应时消耗稀盐酸的质量:X=Y C、X、Y的相对原子质量大小关系:X< Y D、t3时烧杯中溶液的质量:X< Y24. “假黄金”黄铜(铜锌合金)的颜色酷似黄金,不法分子常常用“假黄金”以假乱真,牟取暴利。科学小组为探究某黄铜中锌的含量,向10.0g黄铜样品中加稀盐酸,测得实验数据如图所示。下列分析正确的是( ) A、A点时,溶液中的溶质为ZnCl2和CuCl2 B、C点时,盐酸恰好完全参与反应 C、该黄铜中锌的质量分数为44% D、所用稀盐酸的溶质质量分数为3.65%25. 相同质量的Mg、Fe、Zn三种金属,分别与足量的、质量相同、质量分数相同的稀H2SO4充分反应,生成氢气与消耗稀H2SO4的质量关系如图,所得的结论与事实相符的是 ( )
A、A点时,溶液中的溶质为ZnCl2和CuCl2 B、C点时,盐酸恰好完全参与反应 C、该黄铜中锌的质量分数为44% D、所用稀盐酸的溶质质量分数为3.65%25. 相同质量的Mg、Fe、Zn三种金属,分别与足量的、质量相同、质量分数相同的稀H2SO4充分反应,生成氢气与消耗稀H2SO4的质量关系如图,所得的结论与事实相符的是 ( ) A、三种金属消耗稀H2SO4的质量:Mg<Fe<Zn B、三种金属的失去电子总数量:Mg>Fe>Zn C、三种金属的活动性顺序:Mg=Fe=Zn D、三种金属与稀H2SO4反应后溶液的质量:Mg>Fe>Zn26. 如图所示,将一小块金属钠放入CuSO4溶液中,金属钠立即熔化成小球,并在液面上快速游动,发出“哧哧”的声音,直到消失,同时杯底出现蓝色沉淀,溶液仍为蓝色。下列说法错误的是( )
A、三种金属消耗稀H2SO4的质量:Mg<Fe<Zn B、三种金属的失去电子总数量:Mg>Fe>Zn C、三种金属的活动性顺序:Mg=Fe=Zn D、三种金属与稀H2SO4反应后溶液的质量:Mg>Fe>Zn26. 如图所示,将一小块金属钠放入CuSO4溶液中,金属钠立即熔化成小球,并在液面上快速游动,发出“哧哧”的声音,直到消失,同时杯底出现蓝色沉淀,溶液仍为蓝色。下列说法错误的是( ) A、可推测出金属钠的密度比杯中溶液的密度小、熔点比较低 B、发生了置换反应、复分解反应 C、由此实验可得结论:金属钠能将CuSO4溶液中的Cu置换出来 D、若向反应结束后的烧杯中滴入无色酚酞试液,则试液不变红色27. 向一定质量的Mg(NO3)2和Cu(NO3)2混合溶液中加入a克锌粉和铁粉的混合物,充分反应后过滤,得到不饱和的滤液和滤渣,将滤渣洗涤、干燥后再称量,得到的固体质量仍为a克。下列分析合理的是( )
A、可推测出金属钠的密度比杯中溶液的密度小、熔点比较低 B、发生了置换反应、复分解反应 C、由此实验可得结论:金属钠能将CuSO4溶液中的Cu置换出来 D、若向反应结束后的烧杯中滴入无色酚酞试液,则试液不变红色27. 向一定质量的Mg(NO3)2和Cu(NO3)2混合溶液中加入a克锌粉和铁粉的混合物,充分反应后过滤,得到不饱和的滤液和滤渣,将滤渣洗涤、干燥后再称量,得到的固体质量仍为a克。下列分析合理的是( )①滤渣中可能有铜 ②向滤渣中加稀盐酸,可能有气泡产生
③滤液中一定有Mg(NO3)2、Zn(NO3)2和Fe(NO3)2 , 可能有Cu(NO3)2
④若忽略过滤操作中溶液损失,滤液中溶质的质量一定大于原混合溶液溶质的质量
A、①② B、①③ C、②③ D、②④28. 烧杯中盛有等质量的锌粉和铁粉,向其中不断加入氯化铜溶液,测得烧杯中剩余固体的质量与加入氯化铜溶液质量的关系如图所示。下列相关说法正确的是( ) A、ab段发生的是铁与氯化铜的反应 B、向b点所得固体中加入稀盐酸,无气泡产生 C、c点所得溶液呈浅绿色 D、d点所得溶液中的溶质有2种29. 用等质量的锌、铁、镁三种金属分别与三份溶质质量分数相同的稀盐酸充分反应。产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是( )
A、ab段发生的是铁与氯化铜的反应 B、向b点所得固体中加入稀盐酸,无气泡产生 C、c点所得溶液呈浅绿色 D、d点所得溶液中的溶质有2种29. 用等质量的锌、铁、镁三种金属分别与三份溶质质量分数相同的稀盐酸充分反应。产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是( ) A、反应后可能没有剩余的金属是锌和铁 B、反应后不一定有剩余的金属是镁 C、根据图像分析,金属镁产生氢气最多 D、曲线X、Y、Z分别表示锌、铁、镁的反应情况30. 相同质量的Mg、Fe、Zn三种金属,分別与足量的、质量相同、质量分数相同的稀H2SO4充分反应,生成氢气与消耗稀H2SO4的质量关系如图,所得的结论与事实相符的是:( )
A、反应后可能没有剩余的金属是锌和铁 B、反应后不一定有剩余的金属是镁 C、根据图像分析,金属镁产生氢气最多 D、曲线X、Y、Z分别表示锌、铁、镁的反应情况30. 相同质量的Mg、Fe、Zn三种金属,分別与足量的、质量相同、质量分数相同的稀H2SO4充分反应,生成氢气与消耗稀H2SO4的质量关系如图,所得的结论与事实相符的是:( ) A、三种金属消耗稀H2SO4的质量:Mg<Fe<Zn B、三种金属的失去电子总数量:Mg>Fe>Zn C、三种金属的活动性顺序:Mg=Fe=Zn D、三种金属与稀H2SO4反应后溶液的质量:Mg>Fe>Zn31. 把一定质量的甲、乙、丙、丁四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下表。下列说法不正确的是( )
A、三种金属消耗稀H2SO4的质量:Mg<Fe<Zn B、三种金属的失去电子总数量:Mg>Fe>Zn C、三种金属的活动性顺序:Mg=Fe=Zn D、三种金属与稀H2SO4反应后溶液的质量:Mg>Fe>Zn31. 把一定质量的甲、乙、丙、丁四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下表。下列说法不正确的是( )物质
甲
乙
丙
丁
反应前的质量(g)
4.0
2.0
3.0
2.0
反应后的质量(g)
1.2
X
2.4
5.4
A、X=2.0,乙可能是催化剂 B、甲和丙是反应物 C、参加反应的甲、丙质量比是1:2 D、丁一定是化合物32. 如图所示的四个图像,能正确反映对应变化关系的是( )A、镁在氧气中燃烧 B、向二氧化锰中加入过氧化氢溶液
B、向二氧化锰中加入过氧化氢溶液  C、向一定量铁粉和铜粉的混合物中加入硫酸铜溶液
C、向一定量铁粉和铜粉的混合物中加入硫酸铜溶液 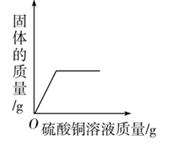 D、等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
D、等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应  33. 向质量均为m的锌粉和铁粉中分别滴加100g同浓度的稀硫酸,反应过程中产生气体的质量与所加稀硫酸的质量关系如图所示,下列叙述正确的是( )
33. 向质量均为m的锌粉和铁粉中分别滴加100g同浓度的稀硫酸,反应过程中产生气体的质量与所加稀硫酸的质量关系如图所示,下列叙述正确的是( ) A、a表示的是锌和稀硫酸反应的情况 B、反应后均得到无色溶液 C、由图可知,锌比铁的化学活动性强 D、反应结束后两种金属均有剩余,所得溶液的质量相等34. 某溶液含有 Cu(NO3)2 和 AgNO3 , 现向其中加入一定量的锌粉进行处理,并绘制参加反应的锌与溶液中溶质种类的关系图(如图所示),下列说法中不正确的是( )
A、a表示的是锌和稀硫酸反应的情况 B、反应后均得到无色溶液 C、由图可知,锌比铁的化学活动性强 D、反应结束后两种金属均有剩余,所得溶液的质量相等34. 某溶液含有 Cu(NO3)2 和 AgNO3 , 现向其中加入一定量的锌粉进行处理,并绘制参加反应的锌与溶液中溶质种类的关系图(如图所示),下列说法中不正确的是( )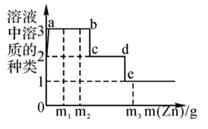 A、Cu 的活动性比 Ag 强,只用盐酸无法探究两者活动性强弱 B、当溶质种类为1种时,金属单质种类可能为2种 C、c~d 间(不含两点)的溶液中金属离子为 Zn2+、Cu2+ D、从 m1 变化到 m2 时,溶液中硝酸铜的质量分数不变35. 某同学实验时,用氢气还原16g氧化铜,反应一段时间后,停止加热,冷却后称量剩余固体质量为14.4g,则下列结论正确的是( )A、有1.6g水生成 B、有1.4g铜生成 C、实际用去氢气的质量大于0.2g D、有80%的氧化铜参加反应
A、Cu 的活动性比 Ag 强,只用盐酸无法探究两者活动性强弱 B、当溶质种类为1种时,金属单质种类可能为2种 C、c~d 间(不含两点)的溶液中金属离子为 Zn2+、Cu2+ D、从 m1 变化到 m2 时,溶液中硝酸铜的质量分数不变35. 某同学实验时,用氢气还原16g氧化铜,反应一段时间后,停止加热,冷却后称量剩余固体质量为14.4g,则下列结论正确的是( )A、有1.6g水生成 B、有1.4g铜生成 C、实际用去氢气的质量大于0.2g D、有80%的氧化铜参加反应