陕西省商洛市2022-2023学年高三上学期12月联考化学试题
试卷更新日期:2023-01-10 类型:月考试卷
一、单选题
-
1. 化学与生产、生活、科技等密切相关。下列说法正确的是( )A、我国出土的青铜器是由铁和铜的合金制成的器具 B、苏打水呈弱酸性,能中和胃酸,有助于平衡人体内的酸碱度 C、我国山水画所用的炭黑与卫星所用的碳纤维互为同位素 D、离子交换法适宜软化硬水(指含有较多可溶性钙镁化合物的水)2. 化学用语是学习化学知识的基本工具。下列化学用语表示正确的是( )A、的电子式:
 B、含17个中子的硫元素的原子符号:
C、乙烯的结构式:
D、甲烷的比例模型:
B、含17个中子的硫元素的原子符号:
C、乙烯的结构式:
D、甲烷的比例模型: 3. 分类是学习化学知识的一种重要手段。下列说法正确的是( )A、既属于金属氧化物,又属于酸性氧化物 B、大苏打()是一种可溶性碱,且溶液的碱性较强 C、判断几元酸的标准是分子中含有氢原子的个数 D、铝热反应为放热反应,属于离子反应4. 用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是( )
3. 分类是学习化学知识的一种重要手段。下列说法正确的是( )A、既属于金属氧化物,又属于酸性氧化物 B、大苏打()是一种可溶性碱,且溶液的碱性较强 C、判断几元酸的标准是分子中含有氢原子的个数 D、铝热反应为放热反应,属于离子反应4. 用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是( )



A.制取二氧化硫
B.实验室制取乙酸乙酯
C.干燥气体
D.分离溴水中的
A、A B、B C、C D、D5. 根据图示合成路线分析,下列有关说法错误的是( ) A、a中所有原子不可能共面 B、b中含有一种官能团 C、c的分子式为 D、d的一氯代物有两种6. 下列离子方程式书写正确的是( )A、向碳酸氢钠溶液中滴加少量澄清石灰水: B、向硫酸铝溶液中滴加过量的稀氨水: C、硫化亚铁溶于稀硝酸: D、氯气溶于水:7. 已知:X、Y、Z、W为原子序数依次增大的短周期主族元素,Y和Z的价电子数之和等于W的原子序数,X、Y的核外电子总数等于Z的价电子总数,乙为地壳中含量最多的元素。由X、Y、Z、W组成的化合物结构如图,下列说法正确的是( )
A、a中所有原子不可能共面 B、b中含有一种官能团 C、c的分子式为 D、d的一氯代物有两种6. 下列离子方程式书写正确的是( )A、向碳酸氢钠溶液中滴加少量澄清石灰水: B、向硫酸铝溶液中滴加过量的稀氨水: C、硫化亚铁溶于稀硝酸: D、氯气溶于水:7. 已知:X、Y、Z、W为原子序数依次增大的短周期主族元素,Y和Z的价电子数之和等于W的原子序数,X、Y的核外电子总数等于Z的价电子总数,乙为地壳中含量最多的元素。由X、Y、Z、W组成的化合物结构如图,下列说法正确的是( ) A、Y位于第三周期ⅢA族 B、W的最高正价为价,其最高价含氧酸为强酸 C、仅由X、Z形成的某种化合物具有漂白性 D、非金属性:8. 下列实验操作、实验现象、解释或结论对应且均正确的一组是( )
A、Y位于第三周期ⅢA族 B、W的最高正价为价,其最高价含氧酸为强酸 C、仅由X、Z形成的某种化合物具有漂白性 D、非金属性:8. 下列实验操作、实验现象、解释或结论对应且均正确的一组是( )选项
实验操作
实验现象
解释或结论
A
向淀粉水解液中滴加碘水
溶液变为蓝色
淀粉没有发生水解
B
向蔗糖中加入浓硫酸,搅拌
产生膨胀的海绵体固体,并生成有刺激性气味的气体
浓硫酸仅体现吸水性和脱水性
C
将钠粒放入硫酸铜溶液中
有蓝色沉淀产生
金属性:Na<Cu
D
将灼热的铜丝伸入乙醇中
灼热的铜丝由黑变红
乙醇具有还原性
A、A B、B C、C D、D9. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、滴加紫色石蕊试液显红色的溶液中: B、硫化钠溶液中: C、无色透明溶液中: D、水电离出的的溶液中:10. 锌与不同密度的硝酸反应时,主要还原产物的百分比与硝酸的密度的关系如图所示。下列说法正确的是(已知:常温下,50%的硝酸密度约为)( ) A、氮与氧只能形成三种氧化物 B、锌与密度为的硝酸反应时,n(消耗)∶n(消耗) C、常温下,50%的硝酸的物质的量浓度约为 D、还原产物中的百分比随硝酸密度增大而升高11. 在下,向的恒容密闭容器里按充入气体A,B,发生反应:。时达到平衡,测得部分数据如表所示:
A、氮与氧只能形成三种氧化物 B、锌与密度为的硝酸反应时,n(消耗)∶n(消耗) C、常温下,50%的硝酸的物质的量浓度约为 D、还原产物中的百分比随硝酸密度增大而升高11. 在下,向的恒容密闭容器里按充入气体A,B,发生反应:。时达到平衡,测得部分数据如表所示:物质及状态
平衡时的物质的量分数
40%
20%
平衡时的物质的量/
4
下列说法正确的是( )
A、 B、起始时,充入的物质的量为 C、时,该反应的化学平衡常数 D、平衡时,的物质的量浓度为12. 某种熔融碳酸盐燃料电池(以为电解质,该熔融盐不能传导),一极通入甲烷,另一极通入和的混合气体,该电池工作原理如图。下列说法错误的是( ) A、电极电势: B、该电池在常温下不能正常工作 C、负极上的电极反应式为 D、该电池排出的尾气依次经燃烧、除水处理后剩余的气体可通入b极循环使用13. 某稀硫酸和稀硝酸的混合溶液体积为 , 向其中逐渐加入铁粉,产生气体体积(已折合成标准状况下)随加入铁粉的质量变化如图新示。下列说法正确的是( )(已知:硝酸只被还原为气体,忽略反应过程中溶液体积的变化)
A、电极电势: B、该电池在常温下不能正常工作 C、负极上的电极反应式为 D、该电池排出的尾气依次经燃烧、除水处理后剩余的气体可通入b极循环使用13. 某稀硫酸和稀硝酸的混合溶液体积为 , 向其中逐渐加入铁粉,产生气体体积(已折合成标准状况下)随加入铁粉的质量变化如图新示。下列说法正确的是( )(已知:硝酸只被还原为气体,忽略反应过程中溶液体积的变化) A、当加入铁粉时,反应后溶液中的溶质为和 B、混合溶液中的物质的量浓度为 C、转移电子的物质的量之比 D、该混合溶液最多能溶解铜粉14. 设为阿伏加德罗常数的值。下列说法错误的是( )A、标准状况下,中所含质子总数为 B、的溶液中所含个数可能为 C、标准状况下,中所含共用电子对的总数为 D、常温下,与足量浓硫酸反应,转移电子的数目为
A、当加入铁粉时,反应后溶液中的溶质为和 B、混合溶液中的物质的量浓度为 C、转移电子的物质的量之比 D、该混合溶液最多能溶解铜粉14. 设为阿伏加德罗常数的值。下列说法错误的是( )A、标准状况下,中所含质子总数为 B、的溶液中所含个数可能为 C、标准状况下,中所含共用电子对的总数为 D、常温下,与足量浓硫酸反应,转移电子的数目为二、综合题
-
15. 已知是一种易溶于水的白色或微红色晶体。某化学兴趣小组利用如图所示装置(夹持及加热装置省路)米制备该晶体。已知:多孔球泡能增大气体与液体的接触面积。
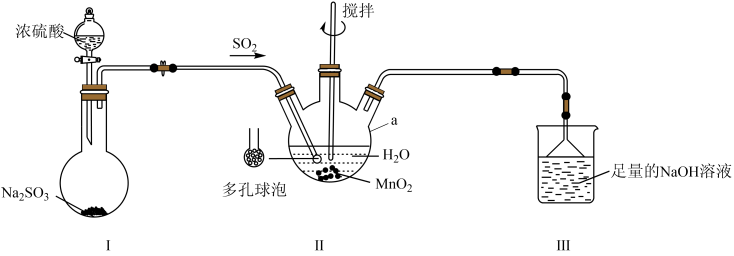 (1)、仪器a名称为 , 图中为了提高装置B中的反应速率采取了的措施有(填两条)。(2)、分液漏斗在使用前需检查。(3)、装置A中发生反应的化学方程式为。(4)、装置B中发生反应的氧化剂和还原剂的物质的量之比:n(氧化剂):(还原剂)= , 从反应后的溶液中得到的操作为过滤、、、过滤、洗涤、干燥。(5)、装置C中倒置漏斗的作用为 , 用离子方程式表示装置C中溶液的作用:。16. 化合物G在化工合成中具有重要的作用。一种合成G的路线如下:
(1)、仪器a名称为 , 图中为了提高装置B中的反应速率采取了的措施有(填两条)。(2)、分液漏斗在使用前需检查。(3)、装置A中发生反应的化学方程式为。(4)、装置B中发生反应的氧化剂和还原剂的物质的量之比:n(氧化剂):(还原剂)= , 从反应后的溶液中得到的操作为过滤、、、过滤、洗涤、干燥。(5)、装置C中倒置漏斗的作用为 , 用离子方程式表示装置C中溶液的作用:。16. 化合物G在化工合成中具有重要的作用。一种合成G的路线如下:
回答下列问题:
(1)、A,B中官能团的名称依次为、。(2)、E的结构简式为。(3)、的反应类型为;的反应类型为。(4)、A,B,C,D,E中,属于手性分子的有种。(提示:与四个互不相同的原子或原子团相连的碳原子叫手性碳原子,含手性碳原子的分子叫手性分子)(5)、在D的同分异构体中,同时满足下列条件的结构有种(不考虑立体异构体)。其中有两个相同的取代基与苯环直接相连的同分异构体的结构简式为(任填一种)。①含有羟基和酯基,且水解产物之一为;
②结构中含有苯环,有三个取代基与苯环直接相连,且每个取代基均只含有两个碳原子。
(6)、以环己醇为原料合成 , 参照题干设计合成路线。(无机试剂任选) 17. 一种用富含纤维素的木屑水解液浸取锰阳极泥(含、、、等)制备的工艺流程如下。
, 参照题干设计合成路线。(无机试剂任选) 17. 一种用富含纤维素的木屑水解液浸取锰阳极泥(含、、、等)制备的工艺流程如下。
已知:部分锰的氧化物的部分性质如表。
锰的氧化物
部分性质
难溶于水、弱酸、弱碱、硝酸、冷硫酸
不溶于水,溶于无机酸
不溶于水、醋酸和氯化铵溶液,溶于其他无机酸;在酸溶液中发生自身氧化还原反应,产物为和
(1)、若“酸解”时使用了浓度为的稀硫酸,则配制稀硫酸需量取98%的浓(密度为)的体积为mL。(2)、木屑“酸解”的最终产物X的化学式为;“浸出”时,被X还原为时生成 , 该反应中 , 利用“浸出”得到“滤渣1”利用了“滤渣1”不溶于的特性。(3)、“复分解”时发生反应的离子方程式为;向“滤液”中加入足量熟石灰并加热,产生的气体电子式为 , 该气体用水吸收后,再加入(填流程名称)循环利用。(4)、在空气中热解时,生成各氧化物的锰元素所占百分比与热解温度关系如图所示。欲使尽可能多地转化为 , 需采取的操作有热解、酸溶、过滤、洗涤、干燥,由图可知,“热解”宜在℃下进行,其中用蒸馏水洗涤固体的具体操作为;用硫酸酸溶时发生反应的化学方程式为。 18. 氮氧化物常指和 , 是常见的空气污染物,科学处理及综合利用它们是环境科学研究的热点。(1)、选择性催化还原技术()是针对汽车尾气中的一项处理工艺。在中主要发生的化学反应如下:
18. 氮氧化物常指和 , 是常见的空气污染物,科学处理及综合利用它们是环境科学研究的热点。(1)、选择性催化还原技术()是针对汽车尾气中的一项处理工艺。在中主要发生的化学反应如下:Ⅰ.尿素的水解:尿素液被喷入尾气管,在高温条件下,完全水解为和。
Ⅱ.催化还原:在催化剂作用下与反应,生成和水。
Ⅲ.的催化氧化。
尿素的水解反应的化学方程式为;反应:为放热反应,则该反应中反应物的总键能(填“大于”或“小于”)生成物的总键能。
(2)、用催化还原可在一定程度上消除氮氧化物的污染,发生反应。在恒温条件下,向容积为的恒容密闭容器中分别通入和 , 测得随时间变化的有关实验数据如表所示:时间/
0
10
20
30
40
50
0.5
0.35
0.25
0.17
0.10
0.10
①内,的平均反应速率。
②时,的正反应速率(填“大于”、“小于”或“等于”)的逆反应速率。
③在上述条件下,的平衡转化率为。
④下列能说明该反应达到平衡状态的是(填序号)。
A.的分压保持不变
B.单位时间,消耗 , 同时生成
C.外界条件不变时,气体组分的总质量不随时间改变
D.外界条件不变时,气体总分子数不再变化
(3)、研究表明酸性复合吸收剂可有效脱硝。复合吸收剂组成一定时,温度对脱硝的影响如图所示。
①温度高于后,去除率下降的原因是。
②废气中的与反应的离子方程式为 , 当处理(标准状况下)某废气(的体积分数为 , 设其他物质均不参与反应)时,需消耗浓度为的溶液的体积为(填含a、c的表达式)L。