西藏拉萨市名校2022-2023学年高二上学期期末考试化学试卷
试卷更新日期:2023-01-05 类型:期末考试
一、单选题(每小题6分,共42分)
-
1. 下列关于化学与生产、生活的认识不正确的是( )A、淀粉和纤维素水解均生成葡萄糖 B、镀锌铁比纯铁耐用 C、CO2、CH4、N2等均是造成温室效应的气体 D、合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺2. 用NA表示阿伏加德罗常数的值,下列说法正确的是( )A、25℃时pH=13的NaOH溶液中含有H+的数目为0.1 NA B、标准状况下,11.2 L苯所含原子数为6 NA C、18g 18O2 中含有2 NA个氧原子 D、5.6g Fe与足量的稀硫酸反应失去电子数为0.2 NA3. N2H4是一种高效清洁的火箭燃料,0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放 出133.5 kJ热量。下列热化学方程式正确的是( )A、
 N2H4(g) +
N2H4(g) +  O2(g)=
O2(g)= N2(g) + H2O(g) ΔH= +267 kJ·mol-1
B、N2H4(g) + O2(g)=N2(g) + 2H2O(g) ΔH= -534 kJ·mol-1
C、N2H4(g) + O2(g)=N2(g) + 2H2O(g) ΔH= +534 kJ·mol-1
D、N2H4(g) + O2(g) N2(g) + 2H2O(l) ΔH= -133.5 kJ·mol-1
4. t ℃时,在体积不变的密闭容器中发生反应:X(g)+2Y(g) 2Z(g),各组分在不同时刻的浓度如下表:
N2(g) + H2O(g) ΔH= +267 kJ·mol-1
B、N2H4(g) + O2(g)=N2(g) + 2H2O(g) ΔH= -534 kJ·mol-1
C、N2H4(g) + O2(g)=N2(g) + 2H2O(g) ΔH= +534 kJ·mol-1
D、N2H4(g) + O2(g) N2(g) + 2H2O(l) ΔH= -133.5 kJ·mol-1
4. t ℃时,在体积不变的密闭容器中发生反应:X(g)+2Y(g) 2Z(g),各组分在不同时刻的浓度如下表:物 质
X
Y
Z
初始浓度/(mol·L-1)
0.1
0.2
0
2 min末浓度/(mol·L-1)
0.08
a
b
平衡浓度/(mol·L-1)
0.05
0.05
0.1
下列说法正确的是( )
A、平衡时,X的转化率为50% B、t ℃时,该反应的平衡常数为40 C、平衡后增大体系的压强,v(正)增大,v(逆)减小,平衡向正反应方向移动 D、前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.04mol·L-1·min-15. 25 ℃时,下列各组离子在指定溶液中一定能大量共存的是 ( )A、pH=1的溶液中:Na+、K+、Ba2+、CO32- B、c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3- C、0.1 mol/L NH4Cl溶液中:K+、Na+、NO3-、Cl- D、0.1 mol/L FeCl3溶液中:Fe2+、NH4+、SCN-、SO42-6. 关于以下图所示的原电池,以下说法正确的选项是 A、电子从锌电极通过电流计流向铜电极 B、盐桥中的阴离子向硫酸铜溶液中迁移 C、锌电极发生还原反应,铜电极发生氧化反应 D、铜电极上发生的电极反应是2H++2e-=H2↑7. 下列溶液中各微粒的浓度关系不正确的是( )A、0.1mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) B、0.1mol·L-1 NH4Cl溶液中: c(NH4+)+c(NH3•H2O)=c(Cl-) C、0.1mol·L-1 NaHSO3溶液中: c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-) D、0.1mol·L-1 Na2CO3溶液中: c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
A、电子从锌电极通过电流计流向铜电极 B、盐桥中的阴离子向硫酸铜溶液中迁移 C、锌电极发生还原反应,铜电极发生氧化反应 D、铜电极上发生的电极反应是2H++2e-=H2↑7. 下列溶液中各微粒的浓度关系不正确的是( )A、0.1mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) B、0.1mol·L-1 NH4Cl溶液中: c(NH4+)+c(NH3•H2O)=c(Cl-) C、0.1mol·L-1 NaHSO3溶液中: c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-) D、0.1mol·L-1 Na2CO3溶液中: c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)二、非选择题(每空2分)
-
8. 在2 L的密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s)
0
1
2
3
4
5
n(NO)(mol)
0.020
0.010
0.008
0.007
0.007
0.007
(1)、写出该反应的平衡常数表达式:K=。已知:K300℃>K350℃ , 则该反应是热反应。
(2)、下图表示NO2的变化的曲线是。用O2表示从0~2 s内该反应的平均速率v=。 (3)、能说明该反应已达到平衡状态的是。
(3)、能说明该反应已达到平衡状态的是。a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)、为使该反应的反应速率增大,且平衡向正反应方向移动的是。a.准时分别出NO2气体 b.适当上升温度 c.增大O2的浓度 d.选择高效催化剂
9. 某学生用0.1 mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:(A)移取20.00 mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3 cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)、正确操作的顺序是(用序号字母填写)。(2)、上述(B)操作的目的是。(3)、上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)。(4)、实验中用左手控制(填仪器及部位),眼睛注视 , 直至滴定终点。判断到达终点的现象是。(5)、滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是。10.(1)、氯化铝水溶液呈性,(填“酸”、“中”、“碱”)原因是:(用离子方程式表示)。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是(2)、硫化钠溶于水时发生水解,其水解的离子方程为: , 在配制硫化钠溶液时可以加入少量的以抑制其水解。(3)、将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+)c(CH3COO-)(填“>”、“=”或“<”,下同)。(4)、pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 , 溶液中c(Na+)c(CH3COO-)。11. 电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: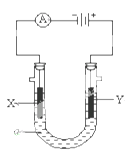 (1)、若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
(1)、若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则① Y电极上的电极反应式为
② 电解池中X极上的电极反应式为。在X 极附近观察到的现象是。
(2)、如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则① X电极的材料是 , 电极反应式是。
② Y电极的材料是 , 电极反应式是。(说明:杂质发生的电极反应不必写出)