辽宁省鞍山市普通高中2022-2023学年高一上学期第三次月考化学试题
试卷更新日期:2023-01-03 类型:月考试卷
一、单选题
-
1. 下列有关叙述正确的是( )A、固体不导电,所以不是电解质 B、既有单质参加,又有单质生成的反应一定是氧化还原反应 C、不加入还原剂也能实现 D、根据树状分类法可知,硫酸钠属于钠盐、硫酸盐、正盐2. 下列是某同学对KHSO4的物质类型进行的分析,其中错误的是( )A、根据元素组成知它是化合物 B、因它含有钾离子与酸根离子,故KHSO4是钾盐 C、KHSO4可以称为硫酸氢盐 D、因为它含有与酸相同的元素氢,故KHSO4也可称为酸3. 为除去括号内的杂质,所选用的试剂或方法正确的是( )A、Cl2(HCl):通过饱和碳酸氢钠溶液的洗气瓶 B、FeCl3(FeCl2):通入足量的氯气 C、CO2(CO):用点燃的方法除去 D、Na2CO3溶液(Na2SO4):加入过量Ba(OH)2溶液4. 离子反应是中学化学中重要的反应类型,下列离子方程式书写正确的是( )A、铁与稀硫酸反应: B、氢氧化铜与硫酸溶液的反应: C、碳酸钙与盐酸反应: D、硫酸铜溶液和氢氧化钡溶液:5. 下列各组离子一定能大量存在的是( )A、在无色溶液中:、、、 B、在含大量的溶液中:、、、 C、在烧碱溶液中:、、、 D、滴加紫色石蕊试液显红色的溶液中:、、、6. 在下列反应中H2O的作用与反应中H2O的作用不同的是( )A、 B、 C、 D、7. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、11.2L二氧化碳气体和9g水中所含的分子数均为0.5NA B、25℃,101KPa下,22.4L氧气的分子数为NA C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA D、1mol任何物质均含有NA个原子8. 下列实验操作或记录正确的是( )A、常温常压下测得1mol N2和CO的混合气体质量为28 g B、用量筒测得排水法收集制得的氢气体积为50.28mL C、用托盘天平称得2.50 gCuSO4·5H2O,受热充分失水后,固体质量减轻0.90g D、欲配制0.10mol•L-1的硫酸920mL,需量取密度为1.84g•cm-3、质量分数为98%的浓硫酸的体积为5.0mL9. 下列有关Na2CO3和NaHCO3比较中,正确的是( )A、向碳酸钠中加入少量水后,温度下降;向碳酸氢钠中加入少量水后,温度上升 B、相同条件下在水中的溶解度:Na2CO3<NaHCO3 C、相同条件下与等浓度的盐酸反应的剧烈程度:Na2CO3>NaHCO3 D、等质量的碳酸钠和碳酸氢钠与足量盐酸反应放出气体的量:Na2CO3<NaHCO310. 下列有关离子检验的描述正确的是( )A、向某溶液中加入盐酸有气泡产生,说明该物质一定存在 B、向某溶液中加入BaCl2溶液,生成白色沉淀,加稀硝酸后沉淀不溶解,原溶液中存在Ag+ C、某化合物在灼烧时透过蓝色钴玻璃片看到紫色火焰,说明该物质一定含有K+ D、向溶液中滴加硝酸银溶液,有白色沉淀生成,则说明该溶液中一定存在Cl-11. 下列关于钠的说法中错误的是( )A、金属钠与Ca(HCO3)2溶溶液反应时,既有白色沉淀又有气体逸出 B、大量的钠着火时可以用沙子扑灭,少量的钠应保存在煤油中 C、钠在自然界中都以化合物的形式存在,实验后剩余的金属钠要放回原试剂瓶 D、将一小块钠投入装有硫酸铜溶液的试管里,试管底部有红色物质生成12. 下列有关叙述正确的是( )A、HClO能杀死病菌,所以氯气可用于自来水消毒 B、工业上将氯气通入澄清石灰水中以制备漂白粉 C、漂白粉中含有HClO,所以漂白粉能使染料等有色物质褪色 D、漂白粉、84消毒液的主要成分都是盐,很稳定,保存时不需要密封13. 某研究小组探究NaClO溶液的性质,设计了下列实验方案,依据实验现象,有关判断错误的( )
装置图
试剂X
实验现象
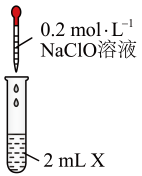
①
0.2mol•L-1盐酸
产生黄绿色气体
②
0.2mol•L-1淀粉-KI溶液
溶液变蓝
③
0.2mol•L-1FeSO4(H+)和KSCN混合溶液
溶液变红
④
0.2mol•L-1AlCl3溶液
产生白色沉淀
(已知含有Fe3+的盐溶液遇到KSCN溶液变成红色)A.实验①中发生的反应:HClO+HCl=Cl2↑+H2O
A、实验②中发生的反应:ClO-+2I-+H2O=Cl-+I2+2OH- B、实验③条件下氧化性强弱:Fe3+>ClO- C、实验④中说明ClO-与Al3+不能大量共存14. 还原铁粉和水蒸气反应的装置如图所示,下列有关该实验的说法正确的是( ) A、湿棉花的主要作用是冷却试管,防止炸裂 B、装置中反应的化学方程式是 C、肥皂液的主要作用是检验生成的是H2 D、肥皂液中有气泡产生即可点燃肥皂液15. 下列有关铁及其化合物的说法中正确的是( )A、和都可以通过化合反应制取 B、细铁丝在空气里剧烈燃烧,火星四射,生成黑色固体 C、向饱和溶液中滴加过量氨水,可制取胶体 D、若某铁的氧化物可表示为 , 则该氧化物中
A、湿棉花的主要作用是冷却试管,防止炸裂 B、装置中反应的化学方程式是 C、肥皂液的主要作用是检验生成的是H2 D、肥皂液中有气泡产生即可点燃肥皂液15. 下列有关铁及其化合物的说法中正确的是( )A、和都可以通过化合反应制取 B、细铁丝在空气里剧烈燃烧,火星四射,生成黑色固体 C、向饱和溶液中滴加过量氨水,可制取胶体 D、若某铁的氧化物可表示为 , 则该氧化物中二、填空题
-
16. 有以下7种生活中常见的物质:①;②氧化钠;③漂白粉;④;⑤食盐水;⑥NaOH。回答下列问题:(1)、以上物质中属于电解质的是(填序号,下同);属于碱的是;属于盐的是。(2)、①在水中电离的方程为。(3)、②与稀盐酸反应的离子方程式为。(4)、写出④转化成①的化学方程式。(5)、现设计实验由大理石()、水、氯气来制取③:大理石()③溶液③,请写出在制取③的实验过程中发生的化学方程式:。17. 钠是活泼金属的代表,钠和钠的化合物是中学化学的基础知识。请回答下列有关问题。(1)、某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。据此他判断汤汁中含有元素;(2)、钠有两种氧化物,其中能用于呼吸面具和潜水艇中作为氧气来源的氧化物是;(3)、厨房中用的食盐和纯碱外观相似。某同学为区分这两种物质,各取少量置于玻璃杯中,滴加食醋,有气体产生的是(填化学式)(4)、固体碳酸钠中含有碳酸氢钠杂质,除去此杂质的简单方法是。(5)、胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打,能治疗胃酸过多,请写出其反应的离子方程式:。18. 铁与空气接触时表面会形成氧化物,如一块低碳钢可以被三种氧化物膜所覆盖与金属接触的一侧是FeO,与空气接触的一侧是 , 而中间则是。(1)、中国古代“四大发明”之一最早的指南针“司南”,其具有磁性作用是因为主要含有上述物质中的(填化学式)。(2)、的一种用途是。(3)、FeO可作化妆品中的色素,它还能进行一系列转化:。
①时应加入的试剂是。
②“速力菲”(主要有效成分是)是一种常见的补铁药物,欲验证该药物超过保质期后已变质,可进行的操作是:除去药物表面包装的糖衣后将药物粉碎、加水溶解静置、取少许溶液于试管中,向其中加入 , 若出现现象,则证明该药物已变质。
③在中滴加NaOH溶液的实验现象是 , 发生反应的化学方程式是。
19. 氧化还原反应是一类重要的化学反应,在工农业生产、日常生活中都有广泛的用途。请回答下列问题。
(1)、Ⅰ.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:。、、、四种物质中的一种物质(甲)能使上述还原过程发生。物质(甲)为(填化学式)。
(2)、反应中若产生5molNO分子,则转移电子的数目是。(3)、Ⅱ.亚硝酸钠()像食盐一样有咸味但有很强的毒性,误食会使人中毒。已知亚硝酸钠能发生如下反应:。用双线桥法标出该反应中电子转移的方向及数目: , 被氧化的原子与被还原的原子数目之比为。
(4)、自来水中的对人类健康会产生危害碱性条件下Al粉还原 , 产物是 , 发生的反应可表示如下,完成方程式并配平。_Al+_+____