辽宁省丹东市五校2023届高三上学期第一次联考化学试题
试卷更新日期:2023-01-03 类型:月考试卷
一、单选题
-
1. 化学与人类社会的生产、生活有着密切联系。下列叙述错误的是( )A、歼-20飞机上用到的氮化镓材料属于合金材料 B、“火树银花合,星桥铁锁开”,其中的“火树银花”涉及到焰色试验 C、维生素C具有还原性,可用作食品抗氧化剂 D、国画《千里江山图》的绿色来自孔雀石颜料,孔雀石的主要成分是碱式碳酸铜2. 设为阿伏加德罗常数的值,下列说法正确的是( )A、0.1mol/L的溶液中数为 B、标准状况下,2.24LCO和混合气体中所含碳原子数约为 C、3.9g钾在加热条件下与氧气完全反应转移电子数为 D、0.1mol和0.3mol在一定条件下充分反应生成的分子数为3. 下列组合正确的是( )
选项
强电解质
弱电解质
酸性氧化物
碱性氧化物
A
Ca(OH)2
乙醇
N2O3
Na2O
B
CaSO4
HClO
Mn2O7
CaO
C
NaHCO3
氨水
SO2
Al2O3
D
HCl
HF
CO2
Na2O2
A、A B、B C、C D、D4. 下列有关化学用语表示正确的是( )A、N2的结构式:N≡N B、二氧化硅的分子式:SiO2 C、中子数为18的氯原子:Cl D、氯化铵的电子式: 5. 下列有关物质性质的比较,结论正确的是( )A、溶解度:Na2CO3<NaHCO3 B、热稳定性:HCl<PH3 C、沸点:C2H5SH<C2H5OH D、碱性:LiOH<Be(OH)26. 化学是一门以实验为基础的学科,化学实验是化学学习的重要内容.根据你掌握的知识判断,下列实验操作的描述中,正确的是( )A、从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶 B、用稀盐酸洗涤盛放过石灰水的试剂瓶 C、酒精灯不慎碰倒起火时可用水扑灭 D、各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量7. 下列离子方程式正确的是( )A、Na2S2O3溶液中加入稀盐酸:2S2O+2H+=SO+3S↓+H2O B、向100 mL 0.1 mol·L-1 FeI2溶液通入0.01 mol Cl2:2Fe2++Cl2=2Fe3++2Cl- C、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO沉淀完全: 2Al3++3SO+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ D、磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO=9Fe3++NO↑+14H2O8. 由原子序数依次增大的五种短周期元素X、Y、Z、W、M组成的化合物是从生物体中得到的一种物质,其结构如图所示,X是短周期中原子半径最小的元素,Z、M同主族,Z、W的原子序数之和等于M的原子序数。下列有关说法错误的是( )
5. 下列有关物质性质的比较,结论正确的是( )A、溶解度:Na2CO3<NaHCO3 B、热稳定性:HCl<PH3 C、沸点:C2H5SH<C2H5OH D、碱性:LiOH<Be(OH)26. 化学是一门以实验为基础的学科,化学实验是化学学习的重要内容.根据你掌握的知识判断,下列实验操作的描述中,正确的是( )A、从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶 B、用稀盐酸洗涤盛放过石灰水的试剂瓶 C、酒精灯不慎碰倒起火时可用水扑灭 D、各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量7. 下列离子方程式正确的是( )A、Na2S2O3溶液中加入稀盐酸:2S2O+2H+=SO+3S↓+H2O B、向100 mL 0.1 mol·L-1 FeI2溶液通入0.01 mol Cl2:2Fe2++Cl2=2Fe3++2Cl- C、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO沉淀完全: 2Al3++3SO+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ D、磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO=9Fe3++NO↑+14H2O8. 由原子序数依次增大的五种短周期元素X、Y、Z、W、M组成的化合物是从生物体中得到的一种物质,其结构如图所示,X是短周期中原子半径最小的元素,Z、M同主族,Z、W的原子序数之和等于M的原子序数。下列有关说法错误的是( ) A、X分别与Y、Z、W、M均可形成微粒 B、最简单氢化物的沸点:W>Z>M>Y C、原子半径:Y>Z>W>M D、X、Y、Z、W四种元素可组成含有极性键和非极性键的离子化合物9. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、SO2 CaSO3CaSO4 B、Fe3O4(s) Fe(s)Fe(NO3)3(aq) C、MgO(s)MgSO4(aq)Mg(s) D、Fe FeSO4(aq)Fe(OH)2FeO10. 某温度下,在恒容密闭容器中发生反应 , 有关数据如下:
A、X分别与Y、Z、W、M均可形成微粒 B、最简单氢化物的沸点:W>Z>M>Y C、原子半径:Y>Z>W>M D、X、Y、Z、W四种元素可组成含有极性键和非极性键的离子化合物9. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、SO2 CaSO3CaSO4 B、Fe3O4(s) Fe(s)Fe(NO3)3(aq) C、MgO(s)MgSO4(aq)Mg(s) D、Fe FeSO4(aq)Fe(OH)2FeO10. 某温度下,在恒容密闭容器中发生反应 , 有关数据如下:时间段/
产物Z的平均生成速率/
0~2
0.20
0~4
0.15
0~6
0.10
下列说法错误的是( )
A、时,Z的浓度大于 B、时,加入 , 此时 C、时,Y的体积分数约为33.3% D、时,X的物质的量为11. pH=0的某X溶液中,除H+外,还可能存在Al3+、Fe2+、、Ba2+、Cl-、、、中的若干种,现取适量X溶液进行如下一系列实验:
下列有关判断错误的是( )
A、生成气体A的离子方程式为3Fe2++4H++=3Fe3++NO↑+2H2O B、生成沉淀G的离子方程式为AlO+CO2+2H2O=Al(OH)3↓+ C、溶液X中一定没有的离子仅为、Ba2+ D、溶液X中一定含有的离子是H+、Fe2+、、、Al3+12. 下列有关物质的分离与提纯的做法正确的是( )A、用NaOH溶液除去镁粉中含有的少量铝粉 B、加热蒸发结晶操作中,至晶体全部析出时,停止加热 C、苯萃取碘水中的碘,下层为含碘的苯溶液 D、SO2中混有HCl可采用Na2SO3饱和溶液除去13. 某废催化剂含SiO2、ZnS、CuS及少量的Fe3O4.某实验小组以该废催化剂为原料,制备锌和铜的硫酸盐的结晶水合物,设计实验流程如下:
下列说法正确的是( )
A、步骤①操作中,生成的气体需用NaOH溶液或CuSO4溶液吸收 B、步骤②操作中,应先加6%H2O2 , 然后不断搅拌下缓慢加入1.0mol·L-1H2SO4 C、滤渣1成分是SiO2和CuS,滤渣2成分只有SiO2 D、检验滤液1中是否含有Fe2+ , 可以选用KSCN溶液和新制的氯水14. 用如图所示装置进行实验,仪器a、b、c中分别盛有试剂1、2、3,其中能达到实验目的的是( )
选项
试剂1
试剂2
试剂3
实验目的
A
浓盐酸
MnO2
饱和食盐水
制备氯气
B
盐酸
Na2CO3
Na2SiO3溶液
验证碳的非金属性比硅强
C
盐酸
Na2SO3
品红试液
验证SO2具有漂白性
D
稀硫酸
溶液X
澄清石灰水
验证X溶液中是否有CO32-
A、A B、B C、C D、D15. 1,2-丙二醇(CH2OHCHOHCH3)单分子解离反应相对能量如图所示。路径包括碳碳键断裂解离和脱水过程。下列说法正确的是( ) A、解离过程中,断裂a处碳碳键比b处碳碳键所需能量高 B、1,2-丙二醇单分子脱水过程均为吸热反应 C、从能量的角度分析,TS1、TS2、TS3、TS4四种路径中TS4路径的速率最慢 D、脱水生成的四种产物中,丙烯醇[CH3C(OH)=CH2]最稳定
A、解离过程中,断裂a处碳碳键比b处碳碳键所需能量高 B、1,2-丙二醇单分子脱水过程均为吸热反应 C、从能量的角度分析,TS1、TS2、TS3、TS4四种路径中TS4路径的速率最慢 D、脱水生成的四种产物中,丙烯醇[CH3C(OH)=CH2]最稳定二、综合题
-
16. 用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如图所示:
 (1)、为了加快浸取速率,可采取的措施是(答一条即可)。(2)、滤渣I中的主要成分是MnO2、S、SiO2 , 请写出“浸取”反应中生成S的离子方程式:。(3)、研究发现,若先除铁再浸取,则浸取速率明显变慢,可能的原因是。(4)、“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3 , 则加入的试剂A可以是 (填化学式);“赶氨”时,最适宜的操作方法是。(5)、“沉锰”(除Mn2+)过程中有关反应的离子方程式为。(6)、滤液II经蒸发结晶得到的盐主要是(填化学式)。17. 某化学兴趣小组为了制取并探究氨的性质,按下列装置(部分夹持装置已略去)进行实验。[制取氨的反应原理:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。]
(1)、为了加快浸取速率,可采取的措施是(答一条即可)。(2)、滤渣I中的主要成分是MnO2、S、SiO2 , 请写出“浸取”反应中生成S的离子方程式:。(3)、研究发现,若先除铁再浸取,则浸取速率明显变慢,可能的原因是。(4)、“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3 , 则加入的试剂A可以是 (填化学式);“赶氨”时,最适宜的操作方法是。(5)、“沉锰”(除Mn2+)过程中有关反应的离子方程式为。(6)、滤液II经蒸发结晶得到的盐主要是(填化学式)。17. 某化学兴趣小组为了制取并探究氨的性质,按下列装置(部分夹持装置已略去)进行实验。[制取氨的反应原理:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。] (1)、利用上述原理,实验室制取氨应选用下图中(填字母)发生装置进行实验。
(1)、利用上述原理,实验室制取氨应选用下图中(填字母)发生装置进行实验。 (2)、B装置中的干燥剂可选用(填“碱石灰”或“浓硫酸”)。(3)、气体通过C、D装置时,试纸颜色会发生变化的是(填“C”或“D”)。(4)、当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是。(5)、F装置中倒置漏斗的作用是。(6)、氨的用途很广。如可用氨处理二氧化氮:8NH3+6NO2=7N2+12H2O,该反应中氨体现 (填“氧化性”或“还原性”)。请你列举出氨的另一种用途:。18. 叠氮化钠()常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
(2)、B装置中的干燥剂可选用(填“碱石灰”或“浓硫酸”)。(3)、气体通过C、D装置时,试纸颜色会发生变化的是(填“C”或“D”)。(4)、当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是。(5)、F装置中倒置漏斗的作用是。(6)、氨的用途很广。如可用氨处理二氧化氮:8NH3+6NO2=7N2+12H2O,该反应中氨体现 (填“氧化性”或“还原性”)。请你列举出氨的另一种用途:。18. 叠氮化钠()常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:①制取氨气:打开装置导管上的旋塞,加热。
②制备NaNH2:加热装置中的金属钠,使其熔化并充分反应后,再停止加热装置并关闭旋塞。
③制取NaN3:向装置中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却后,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,____,晾干。
已知:I.NaN3是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
II. NaNH2熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:
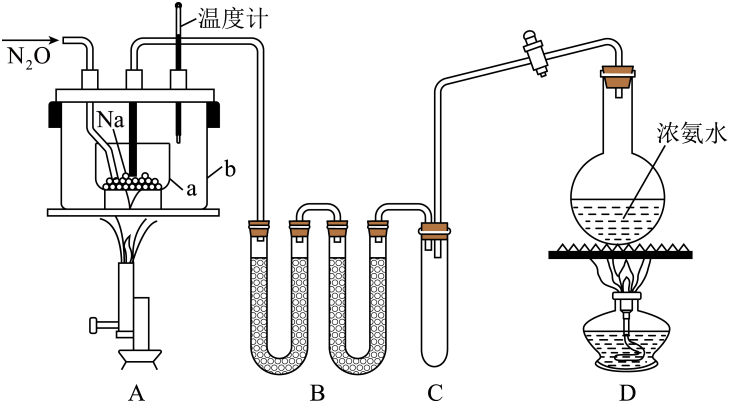 (1)、步骤②加热前,应当采取的操作是;(2)、步骤③中最适宜的加热方式为(填“水浴加热”或“油浴加热”)。(3)、图中仪器a用的是(填“银坩埚”“瓷坩埚”或“石英坩埚”)。(4)、步骤④中用划线处代表的操作是。(5)、用如图所示装置测定产品纯度
(1)、步骤②加热前,应当采取的操作是;(2)、步骤③中最适宜的加热方式为(填“水浴加热”或“油浴加热”)。(3)、图中仪器a用的是(填“银坩埚”“瓷坩埚”或“石英坩埚”)。(4)、步骤④中用划线处代表的操作是。(5)、用如图所示装置测定产品纯度
①仪器F的名称为;其中反应的离子方程式为。
②管q的作用为。
③若G的初始读数为V1mL、末读数为V2mL,本实验条件下气体摩尔体积为VmL·mol-1 , 则产品中NaN3的质量分数为。
19. 丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图。 (1)、丙烷脱氢制丙烯为强吸热过程。
(1)、丙烷脱氢制丙烯为强吸热过程。①为达到反应所需温度,需向原料气中掺入水蒸气,则K(主反应)(填“增大”、“减小”或“不变”)。
②温度升高,副反应更容易发生的主要原因是。
(2)、下图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)。
①104Pa时,图中表示丙烯的曲线是(填“i”、“ii”、“iii”或“iv”)。
②在恒温恒压条件下,下列叙述能说明主反应达到化学平衡状态的是
A.H2的生成速率等于C3H6的消耗速率
B.H2和C3H6的体积分数相等
C.混合气体的密度不再改变
(3)、利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。
已知:CO和H2的燃烧热分别为ΔH=-283.0kJ·mol−1、ΔH=-285.8 kJ·mol−1。
①图中催化剂为。
②298K时,该工艺总反应的热化学方程式为。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是。