江西省2022-2023学年高二上学期12月统一调研测试(联考)化学试题
试卷更新日期:2023-01-03 类型:月考试卷
一、单选题
-
1. 北溪天然气管道被炸,至少泄漏8万吨天然气,据专业人员介绍修复管道至少需要1年以上时间。损坏的管道在海水中主要发生吸氧腐蚀。下列叙述错误的是( )
 A、吸氧腐蚀属于电化学腐蚀 B、负极反应式为 C、正极反应式为 D、浓度越大,吸氧腐蚀速率越大2. 理论比容量指单位质量的负极材料提供的电量(已知:1个电子带电量为)。下列金属作负极时理论比容量最大的是( )A、锂 B、钠 C、铝 D、锌3. 《金匮要略》中记载:“白矾,别名矾石、明矾、巴石等,药用白矾均为加工制品,天然产出者即钾明矾,……外用解毒杀虫,燥湿止痒;内服止血等”。钾明矾又称为“明矾”,成分是。下列有关叙述错误的是( )A、加热明矾水溶液,溶液pH降低 B、明矾溶液中 C、明矾溶液中能大量存在、、、 D、在明矾溶液中加入臭碱溶液会生白色沉淀和臭鸡蛋味气体4. 已知:和存在平衡: , 在298K时,平衡常数:。华南理工大学顾成课题组最近开发一种新材料,通过新材料吸附力高效分离和。获得相同的吸附量(如)时,需要的时间至少是的2.5倍。下列叙述正确的是( )A、时,上述平衡常数K可能保持不变 B、达到平衡后增大 , 则的平衡转化率增大 C、相同条件下,上述材料对吸附速率大于 D、298K时、、依次为1.0、2.0、2.0,则反应正向进行5. 北京科技大学徐睿教授等与浙江大学陆俊教授合作,首次探究了在完全无水环境下电池体系的充放电机理。采用作为正极催化剂,调控电化学氧化还原路径,将放电产物调节为。工作原理如图所示。下列说法错误的是( )
A、吸氧腐蚀属于电化学腐蚀 B、负极反应式为 C、正极反应式为 D、浓度越大,吸氧腐蚀速率越大2. 理论比容量指单位质量的负极材料提供的电量(已知:1个电子带电量为)。下列金属作负极时理论比容量最大的是( )A、锂 B、钠 C、铝 D、锌3. 《金匮要略》中记载:“白矾,别名矾石、明矾、巴石等,药用白矾均为加工制品,天然产出者即钾明矾,……外用解毒杀虫,燥湿止痒;内服止血等”。钾明矾又称为“明矾”,成分是。下列有关叙述错误的是( )A、加热明矾水溶液,溶液pH降低 B、明矾溶液中 C、明矾溶液中能大量存在、、、 D、在明矾溶液中加入臭碱溶液会生白色沉淀和臭鸡蛋味气体4. 已知:和存在平衡: , 在298K时,平衡常数:。华南理工大学顾成课题组最近开发一种新材料,通过新材料吸附力高效分离和。获得相同的吸附量(如)时,需要的时间至少是的2.5倍。下列叙述正确的是( )A、时,上述平衡常数K可能保持不变 B、达到平衡后增大 , 则的平衡转化率增大 C、相同条件下,上述材料对吸附速率大于 D、298K时、、依次为1.0、2.0、2.0,则反应正向进行5. 北京科技大学徐睿教授等与浙江大学陆俊教授合作,首次探究了在完全无水环境下电池体系的充放电机理。采用作为正极催化剂,调控电化学氧化还原路径,将放电产物调节为。工作原理如图所示。下列说法错误的是( )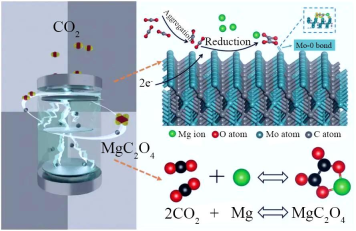 A、放电时,能降低正极反应活化能 B、放电时,副产物可能有、MgO和C C、充电时,转移4mol电子时理论上生成 D、充电时,极与直流电源正极连接6. 设为阿伏加德罗常数的值。下列叙述正确的是( )A、溶液含的数目为 B、60g甲酸甲酯()在稀硫酸中水解生成分子数为 C、溶液含数目为 D、电解法精炼粗银中,阴极净增21.6g时转移电子数为7. 在双氧水中滴加KI溶液实验结果如下(反应中的数目不变),研究人员提出反应机理:①;②。能量变化如图所示。下列说法正确的是( )
A、放电时,能降低正极反应活化能 B、放电时,副产物可能有、MgO和C C、充电时,转移4mol电子时理论上生成 D、充电时,极与直流电源正极连接6. 设为阿伏加德罗常数的值。下列叙述正确的是( )A、溶液含的数目为 B、60g甲酸甲酯()在稀硫酸中水解生成分子数为 C、溶液含数目为 D、电解法精炼粗银中,阴极净增21.6g时转移电子数为7. 在双氧水中滴加KI溶液实验结果如下(反应中的数目不变),研究人员提出反应机理:①;②。能量变化如图所示。下列说法正确的是( ) A、②反应速率最小,它是控速反应 B、总反应的焓变()大于0 C、是总反应的催化剂 D、上述反应只断裂和形成了极性键8. 已知HF是一种弱酸,电离过程放出热量。常温下,向HF溶液滴加NaOH溶液至时pH=3.45。下列叙述正确的是( )A、常温下,加水稀释HF溶液,保持不变 B、微热HF溶液(不考虑HF挥发),HF电离程度增大 C、HF溶液中 D、常温下,HF的电离常数的数量级为9. 下列操作、现象和结论都正确的是( )
A、②反应速率最小,它是控速反应 B、总反应的焓变()大于0 C、是总反应的催化剂 D、上述反应只断裂和形成了极性键8. 已知HF是一种弱酸,电离过程放出热量。常温下,向HF溶液滴加NaOH溶液至时pH=3.45。下列叙述正确的是( )A、常温下,加水稀释HF溶液,保持不变 B、微热HF溶液(不考虑HF挥发),HF电离程度增大 C、HF溶液中 D、常温下,HF的电离常数的数量级为9. 下列操作、现象和结论都正确的是( )选项
操作与现象
结论
A
在Cu和稀硫酸中滴加溶液,铜继续溶解
作该反应的催化剂
B
电解含、的硝酸盐溶液,优先析出红色固体
氧化性:
C
在浊液中滴加溶液生成粉红色沉淀
D
测定浓度相同的、NaCN溶液pH,后者较大
A、A B、B C、C D、D10. 中国人从月球“挖”来“嫦娥石”,它的主要成分是磷酸盐。(磷灰石)是磷酸盐之一。磷灰石在水中存在平衡: , 常温下,磷灰石的溶度积。取磷灰石溶于水中(保持大量固体)得到混合物W(不考虑水解)。下列有关W叙述错误的是( )A、加入少量盐酸,增大 B、加入少量蒸馏水,减小 C、W中 D、对W加热,磷灰石的溶解度和都会增大11. 已知:、广泛用于化工合成作硫化剂、氯化剂。与氯气在一定条件下反应如图所示。已知键的键能为。下列叙述正确的是( ) A、 B、 C、 D、与氯气一步生成放出的热量比两步的多12. 常温下,向溶液中滴加同浓度的NaOH溶液,水电离的与NaOH溶液体积的关系如图所示。下列说法错误的是( )
A、 B、 C、 D、与氯气一步生成放出的热量比两步的多12. 常温下,向溶液中滴加同浓度的NaOH溶液,水电离的与NaOH溶液体积的关系如图所示。下列说法错误的是( )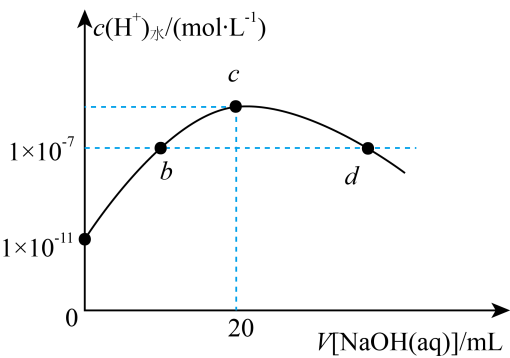 A、b点溶液显酸性 B、c点溶液中 C、d点溶液中 D、常温下,的水解常数约为
A、b点溶液显酸性 B、c点溶液中 C、d点溶液中 D、常温下,的水解常数约为二、多选题
-
13. 中科院合肥研究院科学家制备了共生的碳包覆非晶态铁和四氧化三铁纳米颗粒,实现高效电还原和合成尿素,实现资源回收和利用。模拟装置如图所示。下列说法错误的是( )
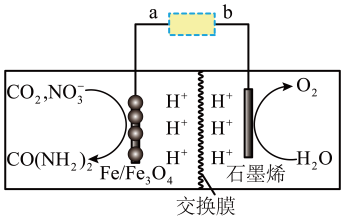 A、石墨烯极为阴极,a极为正极 B、电子流向:极,石墨烯→b C、阴极反应式为 D、电路上转移8mol电子时理论上有通过交换膜向左迁移14. 的能量变化如图1所示。下列说法正确的是( )
A、石墨烯极为阴极,a极为正极 B、电子流向:极,石墨烯→b C、阴极反应式为 D、电路上转移8mol电子时理论上有通过交换膜向左迁移14. 的能量变化如图1所示。下列说法正确的是( ) A、催化剂能使、减小值相等 B、图2中能表示和CO(g)逆反应平衡常数与温度关系的为曲线Ⅰ C、在较低温度下,该反应能自发进行 D、催化剂能提高反应物分子总能量
A、催化剂能使、减小值相等 B、图2中能表示和CO(g)逆反应平衡常数与温度关系的为曲线Ⅰ C、在较低温度下,该反应能自发进行 D、催化剂能提高反应物分子总能量三、综合题
-
15. 是钠离子电池的电极材料。某小组设计以黄铜矿(主要成分是 , 含少量、等)为原料制备二硒化三铜的流程如下:

请回答下列问题:
(1)、滤渣2的主要成分是(填化学式)。(2)、从绿色化学角度考虑,R宜选择(填化学式)。(3)、其他条件相同,“液浸”中金属浸出率与温度、硫酸铁溶液浓度的关系如图所示(浸出率指单位时间内金属溶解的质量,在此浓度下,硫酸铁溶液不影响细菌活性)。根据图示,(填“<”“>”或“=”)。其他条件相同时,温度高于℃时金属浸出率随着温度升高而降低的主要原因可能是。 (4)、“液浸”中,参与反应的离子方程式为。(5)、已知:硒代硫酸是弱酸,推测:溶液呈性(填“酸”“碱”或“中”)性。(6)、“沉铁”中,存在平衡 , 已知:常温下, , 。该反应的平衡常数K为。(7)、常作钠离子电池的正极材料,如果放电时生成 , 则正极反应式为。16. 是广泛用于中学化学实验的一种试剂,某小组用纯碳酸钡制备氯化钡晶体并测定产品纯度。(1)、实验一:制备。
(4)、“液浸”中,参与反应的离子方程式为。(5)、已知:硒代硫酸是弱酸,推测:溶液呈性(填“酸”“碱”或“中”)性。(6)、“沉铁”中,存在平衡 , 已知:常温下, , 。该反应的平衡常数K为。(7)、常作钠离子电池的正极材料,如果放电时生成 , 则正极反应式为。16. 是广泛用于中学化学实验的一种试剂,某小组用纯碳酸钡制备氯化钡晶体并测定产品纯度。(1)、实验一:制备。取足量于烧杯中,加入适量盐酸,充分反应,碳酸钡过量。过滤,得滤液M。
常温下,滤液M的pH7(填“>”“<”或“=”)。
(2)、取少量溶液,经蒸干得到固体,它是(填化学式)。(3)、将滤液M经蒸发浓缩、、过滤、洗涤、干燥得到产品。(4)、实验二:测定产品纯度。方案1 重量法。取wg样品溶于蒸馏水,滴加足量的溶液和盐酸,过滤洗涤、干燥,得到固体质量为mg。
方案2 滴定法。实验步骤如下:
步骤1:取xg样品配成250mL溶液;准确量取25.00mL配制的溶液于锥形瓶;
步骤2:向锥形瓶中加入溶液(过量)使完全沉淀;
步骤3:向其中加入硝基苯,用力振荡,使沉淀表面被有机物覆盖;
步骤4:加入指示剂溶液,用溶液滴定过量的至终点,消耗溶液体积为。已知:常温下, , 。
方案1中,测定产品纯度为。如果用滤纸包裹在电炉中烘干,因温度过高,导致炭黑将部分还原成BaS,则测得结果(填“偏高”“偏低”或“无影响”)。
(5)、方案2中,滴定终点的现象是。硝基苯覆盖沉淀的作用是。(6)、方案2中,测得样品中氯元素质量分数为%。若取消步骤3,测定结果(填“偏高”“偏低”或“无影响”)。17. (肼)是一种燃料,也是重要还原剂。(1)、肼常作火箭发射的燃料。已知:与足量完全反应生成气体和水蒸气时放出akJ热量;。写出与反应的热化学方程式:。发射火箭时,发射场产生大量红棕色烟雾,用化学平衡移动原理和化学用语解释这一现象:。(2)、酸碱质子理论认为:凡是能接受质子的分子或离子则为碱,接受质子的能力越强,碱性越强。已知: , 。由此可知,、、碱性由强到弱的顺序为。(3)、是二元弱碱,在水中第一步电离方程式为。(4)、溶液中、、、离子浓度由大到小排序为。(5)、浙江大学吴浩斌课题组最近设计肼燃料电池,如图所示。
①交换膜类型是。
②负极反应式为。
③标准状况下,参与电极反应,理论上转移mol电子。
18. 1776年,法国化学家LaVoisier首次确定硫元素。自然界天然的硫单质主要存在于火山区,发生反应如下(a、b均大于0):ⅰ.;
ⅱ.。回答下列问题:
(1)、根据上述信息,) kJ/mol。推测ab或(填“>”“<”或“=”)。(2)、一定温度下,在恒容密闭容器中充入适量的、和气体,仅发生上述反应。下列叙述正确的是(填字母)。A.混合气体密度不再随时间变化时达到平衡状态
B.增大硫单质的质量,逆反应速率会增大
C.达到平衡后,适当升温,的平衡转化率减小
D.平衡后充入少量惰性气体(不反应),平衡向左移动
(3)、一定温度下,向2L密闭容器中充入和 , 仅发生反应①,达到平衡后,测得。温度保持不变,压缩容器至1L且保持体积不变,达到新平衡时mol/L。(4)、在恒容密闭容器中充入一定量和气体,测得的平衡转化率与温度、投料比关系如图所示。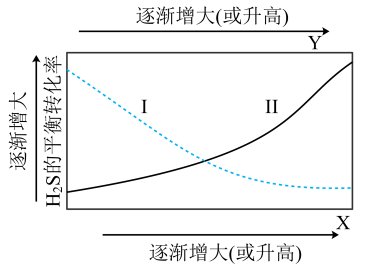
①代表的平衡转化率随温度变化的曲线为。
②解释曲线Ⅱ变化趋势:。
(5)、一定温度下,向密闭容器中充入、和 , 达到平衡时测得平衡体系中有和 , 平衡时总压强为21kPa。该温度下,反应②的平衡常数。(不要求带单位,可用分数表示,提示:用分压计算的平衡常数为 , 分压等于总压×物质的量分数)。