河南省洛阳市名校2022-2023学年高二上学期12月联考化学试题
试卷更新日期:2023-01-03 类型:月考试卷
一、单选题
-
1. 发明创造为人类文明进步做出了巨大贡献。下列装置工作时,涉及的能量转化主要是化学能与电能之间的转化的是( )




A.新型太阳能路灯
B.“长征五号”遥四运火箭发射
C.铅酸蓄电池
D.煤气灶载
A、A B、B C、C D、D2. 在刚刚过去的炎热的夏天,湖泊水位大幅下降,这其中有水分蒸发的原因。在水蒸发形成水蒸气的过程中,其焓变和熵变的大小正确的是( )A、 B、 C、 D、3. 下列物质中,属于弱电解质的有( )①②冰醋酸③④溶液⑤⑥⑦
A、3种 B、4种 C、5种 D、6种4. 已知有如下热化学方程式,下列判断错误的是( )①
②
③
④
A、 B、 C、 D、5. 下列关于工业合成氨的叙述正确的是( )A、及时从反应体系中分离出氨气,有利于平衡向正反应方向移动 B、催化剂能缩短反应达到平衡状态所用的时间,而压强无此作用 C、工业合成氨的反应是熵增的放热反应,在任何温度下都能自发进行 D、高温、高压都能缩短反应达到平衡状态所用的时间,而只有高温有利于提高合成氨的产率6. 下列化学用语表示正确的是( )A、在水中的电离方程式: B、在水中的水解方程式: C、表示燃烧热的热化学方程式: D、可逆反应的平衡常数:7. 设为阿伏加德罗常数的值。下列说法正确的是( )A、25℃时,1L pH=3的溶液中,的数目为 B、的溶液中含有、、的总数目为 C、25℃时,pH=13的NaOH溶液中,水电离出的的数目为 D、99℃时,1LpH=7的NaOH溶液中,的数目为8. 陈述Ⅰ和陈述Ⅱ均正确且具有因果关系的是( )选项
陈述Ⅰ
陈述Ⅱ
A
来源丰富,易于制取和储存
用液态作火箭发动机燃料
B
NaClO水解使溶液呈碱性
用“84”消毒液给日常用品消毒
C
比更难溶于水
用除去水垢中的
D
活性炭具有强氧化性
用活性炭除冰箱异味
A、A B、B C、C D、D9. 常温下,下列各组离子一定能在指定溶液中大量共存的是( )A、使酚酞变红的溶液: B、水电离的的溶液: C、与反应能放出的溶液: D、的溶液:10. 用如图所示实验装置进行相应的实验,能达到实验目的的是( )

 A、图甲:电解熔融制备Al B、图乙:测量盐酸和氢氧化钠反应的反应热 C、图丙:蒸干氯化铝溶液制备无水氯化铝 D、图丁:验证电解NaCl溶液的阳极产物11. 常温下,某一元强酸HX溶液与某一元强碱MOH溶液按2∶5的体积比混合后,测得溶液中c(M+)=c(X-),则混合前,该强酸的pH与强碱的pH之和约为(已知:不考虑溶液混合时体积和温度的变化,lg2≈0.3)( )A、13.3 B、13.6 C、13.9 D、14.212. 下列叙述及对应图示错误的是( )
A、图甲:电解熔融制备Al B、图乙:测量盐酸和氢氧化钠反应的反应热 C、图丙:蒸干氯化铝溶液制备无水氯化铝 D、图丁:验证电解NaCl溶液的阳极产物11. 常温下,某一元强酸HX溶液与某一元强碱MOH溶液按2∶5的体积比混合后,测得溶液中c(M+)=c(X-),则混合前,该强酸的pH与强碱的pH之和约为(已知:不考虑溶液混合时体积和温度的变化,lg2≈0.3)( )A、13.3 B、13.6 C、13.9 D、14.212. 下列叙述及对应图示错误的是( )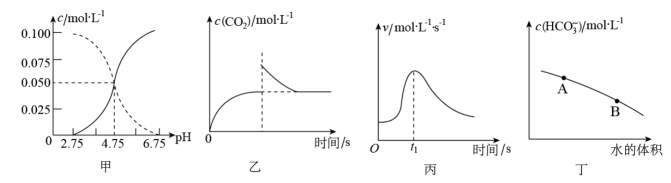 A、图甲是某温度下的醋酸与醋酸钠混合溶液中、与pH的关系曲线,的溶液中: B、图乙是恒温密闭容器中发生反应时,随反应时间变化的曲线,时刻改变的条件可能是缩小容器的体积 C、图丙是铁条与盐酸反应的反应速率随反应时间变化的曲线,时刻溶液的温度最高 D、图丁是在的溶液中加水稀释,随着加入水的体积的增大,溶液中的变化曲线,的水解程度:A点小于B点13. 电化学降解的原理如图所示,下列说法正确的是( )
A、图甲是某温度下的醋酸与醋酸钠混合溶液中、与pH的关系曲线,的溶液中: B、图乙是恒温密闭容器中发生反应时,随反应时间变化的曲线,时刻改变的条件可能是缩小容器的体积 C、图丙是铁条与盐酸反应的反应速率随反应时间变化的曲线,时刻溶液的温度最高 D、图丁是在的溶液中加水稀释,随着加入水的体积的增大,溶液中的变化曲线,的水解程度:A点小于B点13. 电化学降解的原理如图所示,下列说法正确的是( ) A、N为电源的正极 B、电池工作时,通过质子交换膜从左侧移向右侧 C、Pt电极上的反应式为 D、每生成 , 左右两侧溶液质量变化差为18g14. 温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:
A、N为电源的正极 B、电池工作时,通过质子交换膜从左侧移向右侧 C、Pt电极上的反应式为 D、每生成 , 左右两侧溶液质量变化差为18g14. 温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:t/min
2
4
7
9
n(Y)/mol
1.2
1.1
1.0
1.0
下列说法正确的是( )
A、反应0~4min的平均速率v(Z)=0.25mol·L-1·min-1 B、T1时,反应的平衡常数K1=1.2 C、其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0 D、其他条件不变,9min后,向容器中再充入1.6molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大二、填空题
-
15. 磷能形成次磷酸、亚磷酸等多种含氧酸,请根据所学知识回答下列问题:(1)、已知溶液中存在的含磷微粒只有、。
①属于酸。
②写出将的NaOH溶液逐滴加入10mL溶液中至过量时发生反应的离子方程式:。
(2)、亚磷酸是二元中强酸,常温下,其电离平衡常数为、 , 。①常温下,的溶液呈(填“酸”或“碱”)性,该溶液中含磷微粒的浓度由大到小的顺序为。
②常温下,向的溶液中滴加NaOH溶液至 , 此时溶液中的(填精确值)。
③常温下,将NaOH溶液滴加到亚磷酸溶液中,混合溶液的pH随或变化的关系如图所示。

表示的是曲线(填“Ⅰ”或“Ⅱ”),。
16. CO可直接作为燃料电池的燃料,某CO燃料电池的结构如图1所示。 (1)、电池工作时,电子由电极(填“A”或“B”,下同)流向电极。(2)、电极B的电极反应式为 , 该电池中可循环利用的物质为。(3)、纳米级由于具有优良的催化性能而受到关注,采用CO燃料电池为电源,用离子交换膜控制电解液中的制备纳米 , 其装置如图2所示。
(1)、电池工作时,电子由电极(填“A”或“B”,下同)流向电极。(2)、电极B的电极反应式为 , 该电池中可循环利用的物质为。(3)、纳米级由于具有优良的催化性能而受到关注,采用CO燃料电池为电源,用离子交换膜控制电解液中的制备纳米 , 其装置如图2所示。
①电极A应连接(填“C”或“D”),穿过阴离子交换膜的离子为。
②当反应生成14.4g时,图2左侧溶液(填“增加”或“减少”)的质量为g。
17. 消除氮氧化物的污染是当前科学研究的热点,根据所学知识回答下列问题:(1)、已知①;②的燃烧热为 , 则反应的(用含a、b的代数式表示)。(2)、已知和可以相互转化,反应。在温度一定时,平衡体系中的体积分数随压强的变化情况如图所示。
①A、C两点的正反应速率的关系为(填“>”、“<”或“=”)。
②A、B、C、D、E各状态,的是状态。
③E→A所需时间为x,DC所需时间为y,则x(填“>”、<"或“=”)y。
(3)、在一定条件下,可还原氮氧化物,消除氮氧化物污染。工业上,常用和在催化剂作用下合成。在催化剂作用下,时,发生反应,平衡混合气中的物质的量分数随温度和压强变化的关系如图所示。
①该反应的平衡常数(填“<”、“=”或“>”)。
②500℃、压强为时,的转化率为%(保留三位有效数字),。[为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数)]
三、综合题
-
18. 铁镍矿是一种重要的金属材料,主要用于制备铁镍合金,还用于制备镍氢电池的材料。某铁镍矿石的主要成分是四氧化三铁和硫酸镍,还含有铜、钙、镁、硅的氧化物。由该铁镍矿石制备高纯度的氢氧化镍的工艺流程如图:

回答下列问题:
(1)、为提高镍的浸出率,可采取的措施有。(2)、“酸溶”时,所加入的试剂A是硫酸,“废渣1”的主要成分的化学式为。(3)、“除铁”时的作用是。(4)、“除铜”时,所用的试剂B为 , 反应的离子方程式为。(5)、“除钙、镁”过程中形成的“废渣3”的化学式为。(6)、已知常温下 , 该流程在“沉镍”过程中,需调节溶液pH约为时,才刚好沉淀完全(离子沉淀完全的浓度 , )。(7)、某化学镀镍试剂的化学式为(Ni为+2价,x、y均为正整数)。为测定该镀镍试剂的组成,进行如下实验:Ⅰ.称量28.7g该镀镍试剂,配制成100mL溶液A;
Ⅱ.准确量取10.00mL溶液A,用的EDTA()标准溶液滴定其中的(离子方程式为),消耗EDTA标准溶液25.00mL;
Ⅲ.另取10.00mL溶液A,加入足量的溶液,得到白色沉淀4.66g。
①配制100L溶液A时,需要的仪器除药匙、托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要。
②该镀镍试剂的化学式为。