广东省广州市2022-2023学年九年级上学期期末模拟化学试题
试卷更新日期:2023-01-03 类型:期末考试
一、单选题
-
1. 下列变化属于化学变化的是( )A、用研钵研碎胆矾晶体 B、干冰升华 C、煤和石油的形成 D、石油蒸馏制得汽油、柴油2. 空气是一种宝贵的资源,下列生产生活中用到的气体不是来自空气的是( )A、作为燃料电池燃料的H2 B、手于生产氮肥的N2 C、用于医疗急救的O2 D、用于飞艇的He3. 下列化学方程式书写正确的是( )A、P+O2P2O5 B、2H2O22H2↑+O2↑ C、4Fe+3O22Fe2O3 D、CH4+2O2CO2+2H2O4. 下列物质中,属于纯净物的是( )A、乙醇汽油 B、石灰石 C、木炭 D、臭氧5. 物质的性质决定其用途,下列因果关系不成立的是( )A、碳具有还原性,可冶炼金属 B、氧气具有氧化性,可作为燃料 C、石灰石煅烧能分解,可用于制备生石灰 D、氮气的化学性质不活泼,可用于填充灯泡6. 实验室中利用过氧化氢、氯酸钾、高锰酸钾都可以制取氧气,其原因是( )A、都属于氧化物 B、都含有氧气 C、都含有氧分子 D、都含有氧元素7. 下列反应没有明显现象的是( )A、向块状生石灰滴加少量水 B、CO气体通过灼热的氧化铜 C、干燥石蕊纸花放入装CO2的集气瓶 D、用打磨过的铝片放入CuSO4溶液中8. 下图表示广州市家用燃料使用的发展历程(括号内表示主要成分),下列说法正确的是( )
 A、煤、石油、天然气都是不可再生能源 B、液化石油气是煤加工后得到的一种产品 C、在化学反应中只有燃料的燃烧才能放出热量 D、煤中主要含有碳元素,还含有氢、硫等元素,煤是清洁燃料9. 下列实验不能达到相应实验目的是( )A、验证生石灰溶解放热
A、煤、石油、天然气都是不可再生能源 B、液化石油气是煤加工后得到的一种产品 C、在化学反应中只有燃料的燃烧才能放出热量 D、煤中主要含有碳元素,还含有氢、硫等元素,煤是清洁燃料9. 下列实验不能达到相应实验目的是( )A、验证生石灰溶解放热 B、验证CO2的密度比空气的大
B、验证CO2的密度比空气的大 C、探究水的组成
C、探究水的组成 D、验证二氧化碳与水反应
D、验证二氧化碳与水反应 10. 下列反应中,属于分解反应的是( )A、SO2+H2O=H2SO3 B、ZnCO3ZnO+CO2↑ C、2Mg+CO2C+2MgO D、NaOH+HCl=NaCl+H2O11. 下列几种粒子的结构示意图中表示阴离子的是( )
10. 下列反应中,属于分解反应的是( )A、SO2+H2O=H2SO3 B、ZnCO3ZnO+CO2↑ C、2Mg+CO2C+2MgO D、NaOH+HCl=NaCl+H2O11. 下列几种粒子的结构示意图中表示阴离子的是( )
A、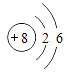 B、
B、 C、
C、 D、
D、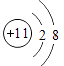 12. 水是生命之源,下列有关水的说法不存在科学性错误的是( )A、水是由氢气和氧气组成的化合物 B、用肥皂水可以使硬水转化为软水 C、生活中可以用煮沸的方法降低水的硬度 D、通过过滤可以除去水中所有的杂质13. 下列关于宏观事实的微观解释,正确的是( )A、水结成冰:水分子停止运动 B、H2O和H2O2的化学性质不同:分子种类不同 C、温度计内汞柱液面上升:汞分子间间隔变大 D、石墨常温下稳定:碳原子最外层电子达到稳定结构14. 下列物质都是由离子构成的是( )A、过氧化氢、干冰 B、金刚石、石墨 C、汞、氨 D、氯化钠、硫酸铜15. 煤和燃油的燃烧是造成空气污染的重要原因,下列排放物能形成酸雨的是( )A、SO2、NO2 B、CO、CO2 C、烟尘 D、未充分燃烧的汽油16. 汽车尾气中含有氮的氧化物,常用尿素溶液来处理,其化学方程式为: , 则X的化学式是( )A、NO2 B、NO C、N2 D、NH317. 有X,Y,Z三种金属片,分别放入稀硫酸中,X,Z表面有气泡产生,Y没有明显现象X放入ZCln溶液,没有明显现象。判断这三种金属的活动性由强到弱的顺序是( )
12. 水是生命之源,下列有关水的说法不存在科学性错误的是( )A、水是由氢气和氧气组成的化合物 B、用肥皂水可以使硬水转化为软水 C、生活中可以用煮沸的方法降低水的硬度 D、通过过滤可以除去水中所有的杂质13. 下列关于宏观事实的微观解释,正确的是( )A、水结成冰:水分子停止运动 B、H2O和H2O2的化学性质不同:分子种类不同 C、温度计内汞柱液面上升:汞分子间间隔变大 D、石墨常温下稳定:碳原子最外层电子达到稳定结构14. 下列物质都是由离子构成的是( )A、过氧化氢、干冰 B、金刚石、石墨 C、汞、氨 D、氯化钠、硫酸铜15. 煤和燃油的燃烧是造成空气污染的重要原因,下列排放物能形成酸雨的是( )A、SO2、NO2 B、CO、CO2 C、烟尘 D、未充分燃烧的汽油16. 汽车尾气中含有氮的氧化物,常用尿素溶液来处理,其化学方程式为: , 则X的化学式是( )A、NO2 B、NO C、N2 D、NH317. 有X,Y,Z三种金属片,分别放入稀硫酸中,X,Z表面有气泡产生,Y没有明显现象X放入ZCln溶液,没有明显现象。判断这三种金属的活动性由强到弱的顺序是( )
A、X>Y>Z B、Z>X>Y C、X>Z>Y D、Y>X>Z18. 过氧化钠(Na2O2)用于潜水艇作制氧剂,它与人体呼出的二氧化碳气体发生化学反应,除了生成氧气之外,同时还生成的一种物质是( )A、NaCl B、NaOH C、Na2CO3 D、NaNO319. 下列根据实验目的所设计的实验方案正确的是( )选项
实验目的
实验设计
A
除去CO2中的CO
将混合气体点燃
B
测定某无色气体是否为CO2
取样滴加紫色石蕊溶液,观察溶液颜色变化
C
区分两瓶无色液体氨水和石灰水
取样滴加无色酚酞溶液,观察溶液颜色变化
D
探究燃烧的条件之一是需要可燃物
用棉花分别蘸酒精和水,放在酒精灯火焰上加热片刻,观察现象
A、A B、B C、C D、D20. 下列图像能正确反应对应关系的是( )A、 加热高锰酸钾和氯酸钾混合物制取氧气
B、
加热高锰酸钾和氯酸钾混合物制取氧气
B、 木炭在盛有足量氧气的密闭容器内充分燃烧
C、
木炭在盛有足量氧气的密闭容器内充分燃烧
C、 利用红磷燃烧测定空气中氧气的含量(打开止水夹前)
D、
利用红磷燃烧测定空气中氧气的含量(打开止水夹前)
D、 甲烷和过量的氧气在密闭容器中充分反应
甲烷和过量的氧气在密闭容器中充分反应
二、填空题
-
21. 碳世界丰富多彩,根据如图回答下列问题:
 (1)、图C的名称 , 木炭、焦炭、活性炭这些物质的结构与类似。(2)、C60属于(填“单质”、“化合物”),它是由(填“分子”或“原子”)构成。(3)、B物质常用作电极,是因为它具有。(4)、上述三种物质的物理性质不同的原因是。(5)、图D中向盛有红棕色NO2气体的烧瓶中投入若干块木炭,连接好装置,稍待片刻,能看到的现象是: , 原因是。22. 如图是某密闭容器中物质变化过程的微观示意图:
(1)、图C的名称 , 木炭、焦炭、活性炭这些物质的结构与类似。(2)、C60属于(填“单质”、“化合物”),它是由(填“分子”或“原子”)构成。(3)、B物质常用作电极,是因为它具有。(4)、上述三种物质的物理性质不同的原因是。(5)、图D中向盛有红棕色NO2气体的烧瓶中投入若干块木炭,连接好装置,稍待片刻,能看到的现象是: , 原因是。22. 如图是某密闭容器中物质变化过程的微观示意图: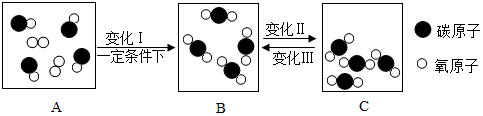 (1)、上述反应过程中,属于氧化物的物质的化学式。(2)、从微观的角度描述变化I的变化过程。(3)、变化I过程中,参加反应的单质与化合物的最简质量比是。(4)、变化II表示的宏观事实是。23. 人类目前所消耗的能量主要来自化石燃料。(1)、石油加热炼制得到的产品中,常用作汽车燃料的是。(2)、若厨房失火时,要移走“液化石油气罐”,这是利用了原理灭火。(3)、天然气的主要成分是 , 它属于(选填可再生、不可再生)能源。(4)、生物柴油由碳、氢、氧三种元素组成,在普通柴油中添加20%的生物柴油,能减少约70%的二氧化氮排放,可减少的形成,但不能缓解日益加剧的。开发使用生物柴油的优点还能。(5)、若燃气灶的火焰呈黄色,需要调大灶具的进风量,目的是。24. 下表是元素周期表(部分)的简化版。请结合表中信息按要求填空。
(1)、上述反应过程中,属于氧化物的物质的化学式。(2)、从微观的角度描述变化I的变化过程。(3)、变化I过程中,参加反应的单质与化合物的最简质量比是。(4)、变化II表示的宏观事实是。23. 人类目前所消耗的能量主要来自化石燃料。(1)、石油加热炼制得到的产品中,常用作汽车燃料的是。(2)、若厨房失火时,要移走“液化石油气罐”,这是利用了原理灭火。(3)、天然气的主要成分是 , 它属于(选填可再生、不可再生)能源。(4)、生物柴油由碳、氢、氧三种元素组成,在普通柴油中添加20%的生物柴油,能减少约70%的二氧化氮排放,可减少的形成,但不能缓解日益加剧的。开发使用生物柴油的优点还能。(5)、若燃气灶的火焰呈黄色,需要调大灶具的进风量,目的是。24. 下表是元素周期表(部分)的简化版。请结合表中信息按要求填空。3 Li7
4 Be9
5 B11
6 Cl2
7 N14
8 O16
9 F19
10 Ne20
11 Na23
12 Mg24
13 Al27
14 Si28
15 P31
16 S32
17 Cl35.5
18 Ar40
(1)、在元素周期表中,S 和处于同一族。(2)、原子序数为 12 的元素名称是 , 中子数为 , 在化学反应中容易电子,形成的粒子符号是。该元素与氮元素结合,形成的化合物的化学式为。(3)、上表中出现的金属中,活动性最强的金属单质是(填写名称)。(4)、铝片在常温下表面被氧气氧化生成氧化物,其中铝元素和氧元素质量比为。25. 某实验过程如下:取a g铜粉置于密闭容器中,称得容器和固体的总质量为b g,煅烧使铜粉与O2充分反应;冷却后打开容器,让空气进入,待容器内的气体组成恢复到反应前,称得容器和固体的总质量为c g;取出所有固体,称得固体为dg。(1)、铜粉在加热过程中发生的化学反应方程式: , 加热过程中,能观察到的实验现象为。(2)、c的质量为(用含有字母a、b、d的式子表示)。26. 请设计实验方案,比较Al、Fe、Ag三种金属的活动性顺序强弱。试剂:稀盐酸、硫酸铜溶液、硫酸铝溶液、硝酸银溶液、铁粉、银丝、铝片、铜粉
实验步骤
实验现象
结论
铁的活动性比铝弱
铁的活动性比银强
由上述实验可得出金属活动性顺序为:Al>Fe>Ag。
三、综合题
-
27. 实验室有如图所示装置,回答下列问题:
 (1)、连接装置时,需根据导管的高度调节处的高度,再确定处的高度。 (填“甲”或“乙”)(2)、结束实验的操作作是:先 , 再 。28. 下图是实验室制备气体的部分装置
(1)、连接装置时,需根据导管的高度调节处的高度,再确定处的高度。 (填“甲”或“乙”)(2)、结束实验的操作作是:先 , 再 。28. 下图是实验室制备气体的部分装置 (1)、加热混有二氧化锰的氯酸钾制备一瓶氧气用于性质实验
(1)、加热混有二氧化锰的氯酸钾制备一瓶氧气用于性质实验①该方法制得O2的化学方程式是。
②可选用(填序号)装置组合。首先检查装置的气密性,方法是:把导管口放入水中,然后 , 观察到有气泡冒出,说明装置气密性良好。
③若要制取9.6克的氧气,则至少需要氯酸钾质量为克。
(2)、氢气被认为是理想的清洁、高能燃料①实验室用锌与稀硫酸制取氢气并验证其可燃性,可选用(填序号)与E装置组合,在E导管口点燃。实验过程是:组装仪器→检查装置气密性→装入药品制备氢气→→点燃。
②电解水也可制得H2。装置如图F,管中产生的是氢气。
③氢气的生产方法是制约其作为清洁能源广泛使用的原因之一,科学家根据生产方法提出“绿色”氢气和“有污染”的氢气的概念,下列方法可获得“绿色”氢气的是。
A.用矿石生产锌和硫酸,再相互反应 B.在催化剂作用下,利用太阳能光解水
C.利用煤燃烧发电,再电解水 D.利用风能、水力发电,再电解水
29. 化学是以实验为基础的科学,某班三个兴趣小组的同学进行了以下实验。(1)、(实验1)甲组同学利用下图微型装置探究燃烧条件。(整套装置气密性良好)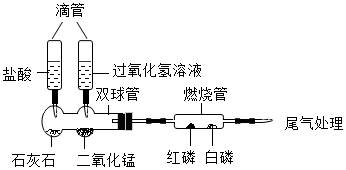
实验步骤如下:
挤压左滴管并微热燃烧管,白磷、红磷均不燃烧。
挤压右滴管并微热燃烧管,白磷燃烧而红磷不燃烧。由该步现象说明燃烧需要的条件之一为。写出该步骤中双球管内发生的反应方程式。
(2)、(实验2)乙组同学进行以下实验。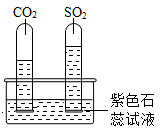
水槽中滴入紫色石蕊试液,将收集满两种气体的试管同时倒立于其中,片刻后实验现象如图所示,试管内紫色石蕊试液都变成色;从实验还可得出结论:相同条件下的溶解性:SO2(填“>”或“<”)CO2。
(3)、将点燃的镁条伸入集满CO2、SO2的集气瓶中,均能剧烈燃烧。观察到一定量镁条在SO2中燃烧生成一种白色固体与淡黄色固体单质,请写出该反应的方程式。(4)、(实验3)丙组同学借助氧气传感器探究微粒的运动。收集一塑料瓶氧气进行以下三步实验:
①敞口放置;②双手贴在塑料瓶外壁上;③将塑料瓶的瓶口朝下、三步实验中确保塑料瓶外形不变,
实验测得氧气的体积分数随时间变化的曲线依次为下图中的MN段、NP段和PQ段。

最能够说明氧分子不断运动的曲线是____。
A、MN段 B、NP段 C、PQ段(5)、MN段和NP段相比较,说明。(6)、随着实验的进行,传感器测出氧气的体积分数约为五分之一时不再变化,原因是。30. 小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:【提出猜想】除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂。
【完成实验】按下表进行实验:测定分解温度(分解温度越低,催化效果越好)。
实验编号
实验药品
分解温度
①
KClO3
580℃
②
KClO3、MnO2(质量比1:1)
350℃
③
KClO3、CuO(质量比l:1)
370℃
④
KClO3、Fe2O3(质量比1:1)
390℃
【分析数据、得出结论】
(1)、由实验与实验④对比,证明猜想合理。(2)、实验所用的三种金属氧化物,催化效果最好的是(3)、若要证明Fe2O3是KClO3分解的催化剂,除了证明Fe2O3在化学反应前后质量不变,还需要证明(4)、如表是二氧化锰用量与一定质量氯酸钾制取氧气反应速率关系的实验数据。二氧化锰与氯酸钾的质量比
1:40
1:20
1:10
1:5
1:3
1:2
生成1L氧气所需的时间(s)
124
79
50
54
75
93
据如表可知二氧化锰与氯酸钾的质量比为时,反应速率最快。