上海市金山区2022-2023学年高三上学期12月一模质量调研 化学试卷
试卷更新日期:2022-12-30 类型:高考模拟
一、选择题(共40分,每小题2分。每小题只有一个正确答案)
-
1. 下列有热量放出的过程是( )A、浓硫酸稀释 B、冰融化 C、石灰石高温分解 D、断开H2中的H-H键
-
2. 反应COCl2+4NH3=CO(NH2)2+2NH4Cl可除去COCl2(
 )污染。下列说法 正确的是( ) A、COCl2是极性分子 B、NH3电子式:
)污染。下列说法 正确的是( ) A、COCl2是极性分子 B、NH3电子式: C、COCl2中含有非极性键
D、中子数为18的Cl原子:18Cl
C、COCl2中含有非极性键
D、中子数为18的Cl原子:18Cl
-
3. 以下事实可以判断元素的非金属性氧强于氮的是A、相对原子质量:O>N B、空气中含量:N2>O2 C、沸点:H2O>NH3 D、NH3在O2中燃烧生成N2
-
4. 环碳(C18)中碳原子是单键和三键交替连接的,结构如图所示。下列说法正确的是( )
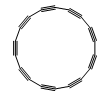 A、C18与C60互为同系物 B、12C18和14C18互为同位素 C、C18和金刚石互为同分异构体 D、环碳中碳原子均达8电子稳定结构
A、C18与C60互为同系物 B、12C18和14C18互为同位素 C、C18和金刚石互为同分异构体 D、环碳中碳原子均达8电子稳定结构 -
5. 丹参醇具有抗心律失常作用,其合成路线中的一步反应如下。有关说法正确的是( )
 A、Y的分子式为C9H14O B、Y不能发生消除反应 C、X所有原子位于同一平面 D、X和Y可用KMnO4(H+)鉴别
A、Y的分子式为C9H14O B、Y不能发生消除反应 C、X所有原子位于同一平面 D、X和Y可用KMnO4(H+)鉴别 -
6. NaCl是化学工业的最基本原料之一,下列说法符合工业生产实际的是( )A、电解饱和食盐水制金属钠 B、在食盐中加入KIO3制加碘食盐 C、将CO2通入氨化的饱和食盐水中,析出Na2CO3晶体 D、采用电解饱和食盐水在阳极上同时获得Cl2和烧碱
-
7. 实验室用盐酸和二氧化锰制备Cl2 , 有关说法正确的是( )A、增大盐酸的浓度能加快反应速率 B、用稀盐酸则反应速率较慢 C、增加MnO2的用量可显著加快反应速率 D、升高温度则减慢反应速率
-
8. 实验室用无水乙醇和浓硫酸制取乙烯的操作,错误的是( )A、先注入无水乙醇再慢慢倒入浓硫酸 B、放入几片碎瓷片 C、加热,使温度慢慢升到170℃ D、用排水法收集乙烯
-
9. 关于前四周期主族元素6C、12Mg、17Cl、32Ge的判断正确的是( )A、原子半径:r(Ge)>r(Cl)>r(Mg)>r(C) B、热稳定性:CH4>GeH4 C、酸性:H2GeO3>HClO4 D、Ge位于第四周期VIA族
-
10. 有关铝及其化合物的说法正确的是( )A、铝片可与冷水剧烈反应 B、铝热反应放出的热量使生成的铁熔化 C、氧化铝是碱性氧化物 D、氢氧化铝能溶于稀氨水
-
11. 实验室从I2的CCl4溶液中分离出I2的主要步骤:用浓NaOH(aq)反萃取、分液、酸化、过滤等。下列说法正确的是( )A、反萃取时的离子方程式:I2+2OH-=I-+IO3-+H2O B、反萃取时,倒转振荡过程中要适时旋开活塞放气 C、分液时,先放出CCl4 , 再从下口放出水溶液 D、过滤时,可用玻璃棒搅拌以加快I2的分离
-
12. 为提纯下列物质(括号内是杂质),所选用的除杂试剂和分离方法都正确的是( )
选项
被提纯的物质
除杂试剂
分离方法
A
NaBr(aq)(NaI)
氯水、CCl4
萃取、分液
B
NH4Cl(aq)(FeCl3)
NaOH(aq)
过滤
C
CO2(CO)
CuO粉末
通过灼热的CuO粉末
D
CH3COOC2H5(CH3COOH)
C2H5OH、浓硫酸
加热蒸馏
A、A B、B C、C D、D -
13. 锰酸钾(K2MnO4)在浓的强碱溶液中可稳定存在,碱性减弱时易发生反应:
3MnO42-+2H2O=2MnO4-+MnO2↓+4OH- , 下列用Cl2氧化K2MnO4制备KMnO4的实验原理和装置不能达到实验目的的是( )




A.制取Cl2
B.净化Cl2
C.使K2MnO4→KMnO4
D.分离MnO2
A、A B、B C、C D、D -
14. 如图所示为某储氢合金的吸氢过程,已知储氢合金在吸氢时放热。下列说法正确的是( )
 A、H2以分子形式存在于储氢合金中 B、储氢合金在吸氢时体系能量升高 C、β相金属氢化物的释氢过程不破坏化学键 D、利用储氢合金可制备超高纯H2
A、H2以分子形式存在于储氢合金中 B、储氢合金在吸氢时体系能量升高 C、β相金属氢化物的释氢过程不破坏化学键 D、利用储氢合金可制备超高纯H2 -
15. 水热法制备Fe3O4纳米颗粒的反应为: 3Fe2++2S2O32-+O2+xOH-=Fe3O4↓+S4O62-+2H2O,若反应生成1 mol Fe3O4 , 则下列说法正确的是( )A、x=6 B、S2O32-作氧化剂 C、转移电子2 mol D、被Fe2+还原的O2为0.5 mol
-
16. 某水处理剂由纳米铁粉附着在多孔炭粉的表面复合而成,利用原电池原理处理弱酸性废水中的NO3-时,其表面发生如图所示反应。下列说法正确的是( )
 A、电池工作时,H+向负极移动 B、正极附近溶液的酸性增强 C、负极电极式:Fe-3e-=Fe3+ D、与单独使用纳米铁粉相比,该水处理剂能加快NO3-的除去速率
A、电池工作时,H+向负极移动 B、正极附近溶液的酸性增强 C、负极电极式:Fe-3e-=Fe3+ D、与单独使用纳米铁粉相比,该水处理剂能加快NO3-的除去速率 -
17. 在“价类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。图中的字母分别代表硫及其常见化合物,相关推断错误的是( )
 A、b、d、f既具有氧化性又具有还原性 B、硫酸型酸雨的形成过程涉及b→c的转化 C、d与c在一定条件下反应可生成b或a D、d在加热条件下与强碱溶液反应生成的n(e)∶n(f)=2∶1
A、b、d、f既具有氧化性又具有还原性 B、硫酸型酸雨的形成过程涉及b→c的转化 C、d与c在一定条件下反应可生成b或a D、d在加热条件下与强碱溶液反应生成的n(e)∶n(f)=2∶1 -
18. 溶液(X)可能含有下列离子中的几种:NH4+、Na+、Ba2+、I-、SO32-、SO42-。为确定该溶液的组成,取X进行实验:
①向X中加入少量氯水,再滴加淀粉溶液,未显蓝色;
②另取100 mL X加入过量氯水,再滴加足量BaCl2(aq),得到沉淀6.99 g;
③将②反应后的混合液过滤,在滤液中加足量NaOH(aq)加热,生成0.01 mol气体。
根据上述实验,原溶液中( )
A、一定存在Na+、NH4+ B、一定存在NH4+、SO32- C、一定不含Ba2+、I- D、可能存在Na +、SO42- -
19. 利用合成气(CO和H2)在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g)+Q(Q>0),反应体系中CO的平衡转化率α(CO)与温度、压强的关系如图所示。下列说法错误的是( )
 A、升高温度,平衡常数减小 B、p1>p2>p3 C、在不同温度、压强下进行该反应,α(CO)不可能相等 D、若α(CO)=α(H2),则合成气中
A、升高温度,平衡常数减小 B、p1>p2>p3 C、在不同温度、压强下进行该反应,α(CO)不可能相等 D、若α(CO)=α(H2),则合成气中 -
20. 室温下,向100 mL 0.1 mol·L-1 Na2SO3(aq)中分别加(通)入不同试剂,现象见下表:
试剂
现象
1
酚酞
溶液变红,加水稀释,红色变浅
2
少量SO2
用pH试纸测得溶液pH≈8
3
少量Cl2
无明显现象
下列说法错误的是( )
A、Na2SO3(aq)中存在:c(OH-)=c(H+)+2c(H2SO3)+c(HSO3-) B、实验1中随着水的不断加入,溶液中的值逐渐增大 C、实验2反应后溶液中存在:c(Na+)>c(HSO3-)+2c(SO32-) D、实验3反应后溶液中存在:c(H+)=c(Cl-)
二、综合题(共60分)
-
21. (一)铁的常见化合价有+2、+3,在很强的氧化剂作用下也可形成不稳定的+6价高铁酸盐。实验室以FeCl2(aq)为原料制备高密度磁记录材料Fe/Fe3O4复合物,装置如图所示。在氩气气氛中,向装有50 mL 1 mol·L-1 FeCl2(aq)的三颈烧瓶中逐滴加入100 mL 14 mol·L-1 KOH(aq),100℃下搅拌回流3 h,得到成分为Fe和Fe3O4的黑色沉淀。待三颈烧瓶中的混合物冷却后,过滤,再依次用沸水和乙醇洗涤,40℃干燥后焙烧3 h,得到Fe/Fe3O4复合物产品 3.24 g。
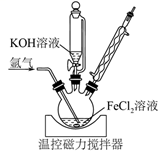
完成下列填空:
(1)、三颈烧瓶内发生反应的离子方程式为;检验反应是否进行完全的操作是。(2)、焙烧需在隔绝空气条件下进行,原因是。实验所得产品的产率为。(3)、FeCl3的晶体类型属于。(4)、向BaCl2(H+)中加入Ba(OH)2以除去杂质FeCl3 , 为使溶液中c(Fe3+)≤10-6 mol·L-1 , 则溶液中c(OH-)≥mol·L-1。用平衡移动原理解释除杂原理。 -
22. (二)
抗抑郁药盐酸马普替林(M:
 )的一条合成路线如下:
)的一条合成路线如下: 完成下列填空:(1)、反应①、③的反应类型分别是、。(2)、工业上,腈纶的主要成分PAN由A(CH2=CHCN)聚合而成,则PAN的结构简式为。B可由石油裂解获得,则B的结构简式为。(3)、写出反应④的化学方程式。(4)、原料
完成下列填空:(1)、反应①、③的反应类型分别是、。(2)、工业上,腈纶的主要成分PAN由A(CH2=CHCN)聚合而成,则PAN的结构简式为。B可由石油裂解获得,则B的结构简式为。(3)、写出反应④的化学方程式。(4)、原料 中的含氧官能团是 , 写出满足以下条件的该原料的一种同分异构体的结构简式。
中的含氧官能团是 , 写出满足以下条件的该原料的一种同分异构体的结构简式。
(i)是含有三个六元碳环的芳香族化合物;
(ii)只有一种含氧官能团;
(iii)分子中有4种不同化学环境的氢。
(5)、写出-Y的结构简式并将以下合成路线补充完整。

-
23. (三)H2O2(H-O-O-H)既有氧化性又有还原性,其中氧处于中间价态。
完成下列填空:
 (1)、H2O2是二元弱酸,则H2O2的第一步电离方程式为。(2)、已知:4H2O2+Cr2O72-+2H+
(1)、H2O2是二元弱酸,则H2O2的第一步电离方程式为。(2)、已知:4H2O2+Cr2O72-+2H+ 2CrO5+5H2O,CrO5结构如图所示,该反应(选填“是”或“不是”)氧化还原反应,理由是。
(3)、少量Mn2+催化分解H2O2的反应分两步进行,第一步:H2O2+Mn2+=MnO2+2H+;写出第二步反应的离子方程式。
2CrO5+5H2O,CrO5结构如图所示,该反应(选填“是”或“不是”)氧化还原反应,理由是。
(3)、少量Mn2+催化分解H2O2的反应分两步进行,第一步:H2O2+Mn2+=MnO2+2H+;写出第二步反应的离子方程式。称取1.023 g NaBO3·4H2O(M=153.86 g·mol-1)加入20.0 mL 1 mol·L-1 H2SO4(aq)酸化后定容至100 mL,取出10.00 mL用0.01046 mol·L-1 的KMnO4(aq)滴定至终点,消耗KMnO4(aq) 24.34 mL。
已知:① BO3-+2H2O=H2O2+H2BO3-
② MnO4-+H2O2+H+→Mn2++O2↑+H2O(未配平)
(4)、配平离子方程式。2MnO4-+5H2O2+_H+=_Mn2++_O2↑+_H2O
(5)、实验所需的定量仪器有电子天平、量筒、。(6)、滴定终点的现象为溶液变为色,且30 s不变色。理论上消耗KMnO4(aq)mL,实验过程操作正确,产生误差的原因可能是。 -
24. (四)丙烯(C3H6)是石油化工的基础有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等。制备方法如下:(1)、方法一 丙烷氧化脱氢法制备丙烯:C3H8(g)+1/2O2(g) C3H6(g)+H2O(g)(正反应放热)。在催化剂的作用下、相同的反应时间,C3H8的转化率和C3H6的产率随温度变化关系如图。

完成下列填空:
C3H8的转化率随温度升高而上升的原因是 , 写出一条提高C3H6产率的措施。
(2)、方法二 丙烷脱氢制备丙烯:C3H8(g)→C3H6(g)+H2(g)+Q kJ。已知:C3H8(g)→CH4(g)+C2H2(g)+H2(g)+a kJ;C3H6(g)→CH4(g)+C2H2(g)+b kJ
用含a、b的代数式表示Q=。
(3)、某温度下,在一恒容容器中充入C3H8 , 发生脱氢制丙烯反应,起始压强为10 kPa,平衡时总压强为14 kPa,C3H8的平衡转化率为。该反应的平衡常数Kp=kPa。(用平衡分压代替平衡浓度,分压=总压×物质的量分数)(4)、将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器发生脱氢反应:C3H8(g)→C3H6(g)+H2(g)。经相同时间,流出的c(C3H6)、c(CO)和c(H2)随初始c(CO2)的变化关系如图。结合化学方程式解释c(H2)和c(C3H6)变化差异的原因。
 (5)、一定条件下,CH3CH=CH2与HCl发生反应有①、②两种可能,反应进程中的能量变化如图。保持其他条件不变,若要提高产物中CH3CH2CH2Cl(g)的比例,可采用的措施是。
(5)、一定条件下,CH3CH=CH2与HCl发生反应有①、②两种可能,反应进程中的能量变化如图。保持其他条件不变,若要提高产物中CH3CH2CH2Cl(g)的比例,可采用的措施是。
a.适当提高反应温度 b.改变催化剂
c.适当降低反应温度 d.改变反应物浓度
