内蒙古乌兰察布市2022-2023学年高一上学期期中考试化学试题
试卷更新日期:2022-12-28 类型:期中考试
一、单选题
-
1. 化学与生活等密切相关,下列说法错误的是( )A、葡萄糖注射液不能产生丁达尔效应 B、“铁质菜刀生锈”与氧化还原反应有关 C、为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 D、维生素C可将Fe3+转变为Fe2+ , 所以维生素C具有还原性2. 化学中很多结论都存在特例,下列结论正确的是( )A、酸性氧化物一定能与水反应生成相应的酸 B、碱性氧化物一定是金属氧化物 C、能电离出且显酸性的化合物一定是酸 D、只含有一种元素的物质为纯净物3. 在水溶液中下列电离方程式错误的是( )A、KAl(SO4)2=K++Al3++2 B、NaHCO3=Na++ C、H2SO4=2H++ D、NaHSO4=Na++4. 下列变化需要加入氧化剂才能实现的是( )A、S2-→HS- B、CO32-→CO2 C、2Cl-→Cl2 D、Cu2+→Cu5. 下列反应可以用离子方程式H++OH-=H2O来表示的是( )A、Mg(OH)2+2HCl=MgCl2+2H2O B、Cu(OH)2+2HNO3=Cu(NO3)2+2H2O C、2NaOH+H2SO4=Na2SO4+2H2O D、Ba(OH)2+H2SO4=BaSO4↓+2H2O6. 下列叙述中正确的有( )
①溶液在电流的作用下电离成钠离子和氯离子
②强电解质溶液的导电性比弱电解质溶液的导电性强
③的水溶液导电能力很弱,所以是弱电解质
④溶于水的部分能够完全电离,故它是强电解质
⑤氯水能导电,所以是电解质
⑥乙醇和乙酸都能溶于水,都是电解质
A、1个 B、2个 C、3个 D、4个7. 溶液中含Fe3+、Mg2+、和M离子,四种离子的个数之比为2:1:3:2,则M有可能为 ( ) A、 B、Cl- C、Na+ D、OH-8. 氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应中属于阴影部分的是 ( )
( ) A、 B、Cl- C、Na+ D、OH-8. 氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应中属于阴影部分的是 ( ) A、4NH3 +5O2=4NO+6H2O B、4Fe(OH)2+O2+2H2O=4Fe(OH)3 C、2NaHCO3=Na2CO3+H2O+CO2↑ D、Cl2+2NaBr=2NaCl +Br29. 下列离子方程式正确的是( )A、铁和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ B、碳酸钡与足量的盐酸反应:CO+2H+=CO2↑+H2O C、氢氧化钡与稀盐酸的反应:Ba(OH)2+2H+=Ba2++2H2O D、铜片插入硝酸银溶液中:Cu+2Ag+=Cu2++2Ag10. 下列反应中电子转移发生在同种元素之间的是( )A、Zn+2HCl=ZnCl2+H2↑ B、2H2S+SO2=3S↓+2H2O C、H2+CuOCu+H2O D、2H2O2H2↑+O2↑11. 在碱性溶液中能大量共存且溶液为无色透明的是( )A、K+、MnO、Na+、Cl- B、K+、Na+、NO、CO C、Na+、H+、NO、SO D、Fe3+、Na+、Cl-、SO12. 下列叙述中正确的是( )A、氧化剂中的每一种元素在反应中都得到电子 B、还原剂在同一反应中既可以是反应物,也可以是生成物 C、失电子多的还原剂,还原性不一定强 D、阳离子只有氧化性,阴离子只有还原性13. ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得:2KClO3+H2C2O4+H2SO4=2ClO2↑+2CO2↑+K2SO4+2H2O。下列有关该反应的说法正确的是( )A、KClO3在反应中失去电子 B、ClO2是还原产物 C、H2C2O4在反应中被还原 D、H2C2O4中碳的化合价为+2价14. 向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用下图中的曲线表示是( )
A、4NH3 +5O2=4NO+6H2O B、4Fe(OH)2+O2+2H2O=4Fe(OH)3 C、2NaHCO3=Na2CO3+H2O+CO2↑ D、Cl2+2NaBr=2NaCl +Br29. 下列离子方程式正确的是( )A、铁和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ B、碳酸钡与足量的盐酸反应:CO+2H+=CO2↑+H2O C、氢氧化钡与稀盐酸的反应:Ba(OH)2+2H+=Ba2++2H2O D、铜片插入硝酸银溶液中:Cu+2Ag+=Cu2++2Ag10. 下列反应中电子转移发生在同种元素之间的是( )A、Zn+2HCl=ZnCl2+H2↑ B、2H2S+SO2=3S↓+2H2O C、H2+CuOCu+H2O D、2H2O2H2↑+O2↑11. 在碱性溶液中能大量共存且溶液为无色透明的是( )A、K+、MnO、Na+、Cl- B、K+、Na+、NO、CO C、Na+、H+、NO、SO D、Fe3+、Na+、Cl-、SO12. 下列叙述中正确的是( )A、氧化剂中的每一种元素在反应中都得到电子 B、还原剂在同一反应中既可以是反应物,也可以是生成物 C、失电子多的还原剂,还原性不一定强 D、阳离子只有氧化性,阴离子只有还原性13. ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得:2KClO3+H2C2O4+H2SO4=2ClO2↑+2CO2↑+K2SO4+2H2O。下列有关该反应的说法正确的是( )A、KClO3在反应中失去电子 B、ClO2是还原产物 C、H2C2O4在反应中被还原 D、H2C2O4中碳的化合价为+2价14. 向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用下图中的曲线表示是( ) A、A B、B C、C D、D15. 已知反应:
A、A B、B C、C D、D15. 已知反应:①2BrO+Cl2=Br2+2ClO;
②5Cl2+I2+6H2O=2HIO3+10HCl;
③ClO+5Cl-+6H+=3Cl2↑+3H2O。
下列微粒氧化性强弱顺序正确的是( )
A、ClO>BrO>HIO3>Cl2 B、BrO>Cl2>ClO>HIO3 C、BrO>ClO>Cl2>HIO3 D、Cl2>BrO>ClO>HIO316. 反应①②分别是从海藻灰和某种矿石中提取碘的主要反应:①;
②。
下列说法正确的是( )
A、两个反应中硫元素均被氧化 B、碘元素在反应①中被氧化,在反应②中被还原 C、还原性: D、反应①②中生成等量的时,转移电子数之比为2∶5二、综合题
-
17. 用分类思想研究一类物质的通性和特殊性是学习化学的一种重要方法。以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。已知:Cl2+H2O=HCl+HClO;2Na+2H2O=2NaOH+H2↑;3NO2+H2O=2HNO3+NO。请根据你所学的知识,按要求填空:
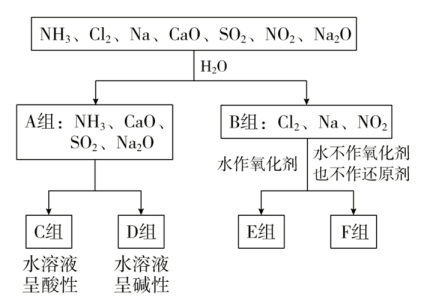 (1)、该种分类方法是分类法,上述第一级分类标准(分成A、B组的依据)是。(2)、F组物质中除了Cl2外还有(填化学式,下同)。(3)、已知制备Cl2可发生如下反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
(1)、该种分类方法是分类法,上述第一级分类标准(分成A、B组的依据)是。(2)、F组物质中除了Cl2外还有(填化学式,下同)。(3)、已知制备Cl2可发生如下反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。①该反应中氧化剂是 , 还原剂是。
②用双线桥法标出电子转移的数目和方向。
18. 现有以下物质:①NaOH溶液②液氨③BaCO3固体④熔融KHSO4⑤Fe(OH)3胶体⑥铜⑦CO2⑧稀醋酸(CH3COOH)⑨饱和NaHCO3溶液⑩乙醇。(1)、物质中属于电解质的是 , 非电解质的是。(填序号)(2)、写出⑨和KHSO4溶液反应的离子方程式。(3)、写出④的电离方程式。(4)、⑤的实验室制备方法:向沸水中滴加几滴溶液,加热至液体呈红褐色,停止加热;其化学方程式为。(5)、在足量①的水溶液中通入少量⑦,发生反应的离子方程式为。19. 有下列三个在溶液中发生的氧化还原反应:①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③K2Cr2O7+14HCl=2KCl+2CrCl3+7H2O+3Cl2↑
请根据上述反应分析推断后回答下列问题:
(1)、FeCl3、I2、Cl2、K2Cr2O7的氧化性由强到弱依次是。(2)、Cr2O、I-在强酸性溶液中能否大量共存?(填“能”或“不能”),理由是。(3)、在酸性溶液中存在大量的I- , 则Cr2O、Fe3+、Fe2+、Cl-中能与I-大量共存的离子是。(4)、+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O还原成Cr3+ , 反应的离子方程式为。20. 已知甲、乙、丙是三种可溶性物质。其中甲是碱,乙、丙是盐,它们溶于水后电离产生的所有离子如表所示:阳离子
Na+、H+、Ba2+
阴离子
OH-、CO、SO
(1)、甲的化学式为。(2)、乙溶液与丙溶液反应可生成气体M,则M的化学式为 , 该反应的离子方程式为。(3)、乙、丙溶液与甲溶液反应可分别生成白色沉淀A和B,其中B可溶于稀硝酸。①乙的化学式为 , 如何鉴别乙中的阴离子:。
②B溶于稀硝酸的离子方程式为。