福建省福州市三校2022-2023学年高三上学期期中联考化学试题
试卷更新日期:2022-12-28 类型:期中考试
一、单选题
-
1. 《医学入门》中记载我国传统中医提纯铜绿的方法:“水洗净,细研水飞,去石澄清,慢火熬干,”其中未涉及的操作是( )A、洗涤 B、粉碎 C、萃取 D、蒸发2. 下列化学用语描述或图示表达正确的是( )A、原子结构示意图
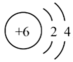 , 可以表示和
B、中子数为127的碘原子:
C、过氧化氢的比例模型:
, 可以表示和
B、中子数为127的碘原子:
C、过氧化氢的比例模型: D、NaClO的电子式:
D、NaClO的电子式: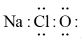 3. 图为酸雨形成的示意图。下列说法正确的是( )
3. 图为酸雨形成的示意图。下列说法正确的是( )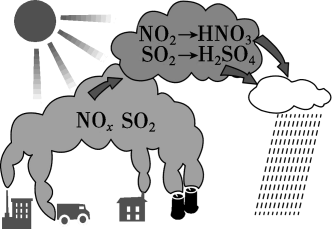 A、空气中的溶于水也会形成酸雨 B、易溶于水,并在雨水中转化为 C、含的雨水在空气中放置其pH可能会降低 D、硝酸型酸雨会腐蚀石灰岩建筑,而硫酸型酸雨不能4. 某无色透明溶液中加入后,有无色无味气体产生,同时产生沉淀。则原溶液中可能含有的离子是( )A、 B、 C、 D、5. 几种物质的转化关系如图所示。下列说法正确的是( )
A、空气中的溶于水也会形成酸雨 B、易溶于水,并在雨水中转化为 C、含的雨水在空气中放置其pH可能会降低 D、硝酸型酸雨会腐蚀石灰岩建筑,而硫酸型酸雨不能4. 某无色透明溶液中加入后,有无色无味气体产生,同时产生沉淀。则原溶液中可能含有的离子是( )A、 B、 C、 D、5. 几种物质的转化关系如图所示。下列说法正确的是( )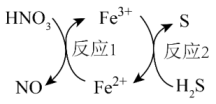 A、反应1中是还原产物 B、反应2中得电子 C、反应2的离子方程式为 D、能和大量共存6. 某药物的一种成分均由短周期主族元素组成,其结构如图所示。元素X、Y、Z、W、E的原子序数依次增大,X与其它几种元素不同周期,W与E原子的基态价电子排布均为。下列说法中错误的是( )
A、反应1中是还原产物 B、反应2中得电子 C、反应2的离子方程式为 D、能和大量共存6. 某药物的一种成分均由短周期主族元素组成,其结构如图所示。元素X、Y、Z、W、E的原子序数依次增大,X与其它几种元素不同周期,W与E原子的基态价电子排布均为。下列说法中错误的是( ) A、原子半径:W<E B、简单氢化物的沸点:Z>Y C、第一电离能:Z>W D、最高价氧化物对应的水化物的酸性:E>Y7. 用如图装置进行实验前将液体A逐滴加入到固体B中,下列叙述正确的是( )
A、原子半径:W<E B、简单氢化物的沸点:Z>Y C、第一电离能:Z>W D、最高价氧化物对应的水化物的酸性:E>Y7. 用如图装置进行实验前将液体A逐滴加入到固体B中,下列叙述正确的是( )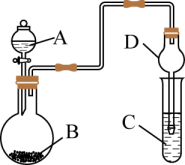 A、若A为浓盐酸,B为 , C为溶液,可证明酸性: B、若A为70%的硫酸,B为固体,C为溶液,则C中溶液变浑浊 C、若A为浓盐酸,B为 , C为石蕊试液,则C中溶液最终呈红色 D、装置D起干燥气体作用8. 有关乙醇
A、若A为浓盐酸,B为 , C为溶液,可证明酸性: B、若A为70%的硫酸,B为固体,C为溶液,则C中溶液变浑浊 C、若A为浓盐酸,B为 , C为石蕊试液,则C中溶液最终呈红色 D、装置D起干燥气体作用8. 有关乙醇 说法正确的是( ) A、与钠反应产生H2 , 说明乙醇属于酸 B、分子中含有-OH,所以乙醇是碱 C、发生酯化反应,断裂②键 D、发生氧化反应生成乙醛,断裂①、③键9. 下列离子方程式书写正确的是( )A、往KBr溶液中通入少量: B、少量金属钠投入溶液中: C、氢氧化钡溶液与稀硫酸混合: D、铁片投入稀硫酸中:10. 下列实验方案中,能达到实验目的的是( )
说法正确的是( ) A、与钠反应产生H2 , 说明乙醇属于酸 B、分子中含有-OH,所以乙醇是碱 C、发生酯化反应,断裂②键 D、发生氧化反应生成乙醛,断裂①、③键9. 下列离子方程式书写正确的是( )A、往KBr溶液中通入少量: B、少量金属钠投入溶液中: C、氢氧化钡溶液与稀硫酸混合: D、铁片投入稀硫酸中:10. 下列实验方案中,能达到实验目的的是( )实验目的
实验方案
A
比较HF和HClO的酸性强弱
分别测定等体积等物质的量浓度的HF和HClO溶液消耗NaOH的物质的量
B
检验溶液中是否含NH4+
滴加稀NaOH溶液,并将润湿的红色石蕊试纸置于盛放溶液的试管口,观察试纸颜色变化
C
证明Na2CO3溶液中存在水解平衡
向含有酚酞的Na2CO3 溶液中加入少量BaCl2固体,观察溶液颜色变化
D
证明Mg(OH)2沉淀可以转化为Fe(OH)3
向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液
A、A B、B C、C D、D二、综合题
-
11. 一种利用黄铁矿烧渣和硫酸铵废液制备铵铁蓝颜料的工艺如下:

已知:黄铁矿的主要成分是FeS2;铵铁蓝的化学式为 , 难溶于水。
(1)、高纯度硫酸铵溶液能够提高铵铁蓝的品质,为除去硫酸铵废液中的Fe2+和Fe3+ , “氧化1”工序使用酸化的H2O2作为氧化剂,写出反应的离子方程式 , “调pH”工序应加入(写出一种物质的化学式)。(2)、黄铁矿在空气中焙烧得到黄铁矿烧渣,其主要成分是(写化学式)。(3)、“还原”工序获得FeSO4溶液,(填“能”或者“不能”)直接加热FeSO4溶液,得到FeSO4晶体。则“结晶”工序的操作方法是。(4)、“沉铁”工序产生的白色沉淀中Fe的化合价为12. PCl3主要用于制造敌百虫等有机磷农药和磺胺嘧啶(S.D)等医药的原料。如图为实验室中制取粗PCl3产品的装置,夹持装置略去。
经查阅资料知:红磷与少量Cl2反应生成PCl3 , 与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3。PCl3遇O2会生成POCl3(三氯氧磷),PCl3、POCl3的熔沸点见下表。
物质
熔点/℃
沸点/℃
PCl3
-112
75.5
POCl3
2
105.3
回答下列问题:
(1)、仪器G的名称是。装置F与G由橡胶管a相连通,a的作用是。(2)、A是制取CO2装置,CO2的作用是 , 选择A中的药品是(填字母)。a.稀盐酸 b.稀硫酸 c.NaHCO3粉末 d.块状石灰石
(3)、装置D中盛有碱石灰,其作用是。(4)、装置G中生成Cl2 , 反应的离子方程式为。(5)、装置C采用65-70℃水浴加热,制得的PCl3粗产品中常含有POCl3、PCl5等杂质,除杂的方法是:先加入红磷加热,除去PCl5 , 然后通过(填实验操作名称),即可得到较纯净的PCl3。(6)、通过实验测定粗产品中PCl3的质量分数,实验步骤如下(不考虑杂质的反应):第一步:迅速移取20.0 g PCl3粗产品,加水完全水解后,再配成500 mL溶液;
第二步:移取25.00 mL溶液置于锥形瓶中;
第三步:加入0. 5 mol•L-1碘溶液20 mL,碘过量,H3PO3完全反应生成H3PO4;
第四步:加入几滴淀粉溶液,用1.0 mol•L-1Na2S2O3标准溶液滴定过量的碘,反应方程式为I2+2Na2S2O3=Na2S4O6+2NaI,滴至终点时消耗Na2S2O3标准溶液10 mL。
①第三步中反应的化学方程式为。
②根据上述数据,计算该产品中PCl3的质量分数为%(保留三位有效数字)。
13. 二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。完成下列填空:
(1)、将二氧化氯通入品红试液中,溶液褪色的理由是。(2)、请配平下列反应的化学方程式(CH3OH中H为+1价,O为-2价):_CH3OH+__NaClO3+__→__CO2↑+__ClO2↑+__Na2SO4+
(3)、该反应中,被氧化的元素是。还原产物与氧化产物的物质的量之比是。(4)、根据上述反应可推知。a.氧化性:ClO2>NaClO3 b.氧化性:NaClO3>CH3OH
c.还原性:CH3OH>ClO2 d.还原性:CH3OH>Na2SO4
(5)、若转移的电子数目为0.3NA(NA为阿伏加德罗常数),则反应产生气体(标准状况)为L。(6)、消毒效率常以单位质量的消毒剂得到的电子数表示。ClO2的消毒效率是Cl2的倍。14. A、B、D、E、X是原子序数依次增大的五种短周期元素。A是元素周期表中相对原子质量最小的元素,A、B能形成两种液态化合物和。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。(1)、的电子式为;E在元素周期表中的位置是。(2)、如图所示,将X单质的水溶液分别滴入盛有不同试剂的试管中。
①试管a中发生反应的化学方程式为 , 该反应可用于制备漂白液。
②试管b中的实验现象为 , 说明X的非金属性于硝酸(填“强”或“弱”)
(3)、镓()与E为同主族元素,氮化镓(GaN)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,GaN商用进入快车道。下列相关说法中,正确的是____ (填字母)。A、Ga位于元素周期表的第四周期 B、GaN中Ga的化合价为+3 C、的离子半径小于的离子半径(4)、是一种高效消毒剂,工业上用其处理中性废水中的锰,使转化为沉淀除去,X被还原至最低价,该反应的离子方程式为。15. 乙二胺四乙酸(EDTA)及其盐类能与多种金属离子发生络合反应,具有广泛用途。EDTA的分子结构如图所示。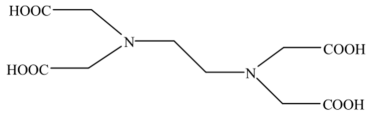 (1)、EDTA所含元素电负性有小到大的顺序为。(2)、EDTA分子中碳原子采取的杂化类型为。基态氧原子核外电子有种运动状态。(3)、EDTA可以与形成盐,分子的VSEPR模型为。氨熔沸点低,铵盐熔沸点高,原因是。(4)、EDTA及其盐可与形成稳定络合物,用于测定水的硬度,这一性质与EDTA分子中原子能够提供孤电子对有关。
(1)、EDTA所含元素电负性有小到大的顺序为。(2)、EDTA分子中碳原子采取的杂化类型为。基态氧原子核外电子有种运动状态。(3)、EDTA可以与形成盐,分子的VSEPR模型为。氨熔沸点低,铵盐熔沸点高,原因是。(4)、EDTA及其盐可与形成稳定络合物,用于测定水的硬度,这一性质与EDTA分子中原子能够提供孤电子对有关。