天津市北辰区2022-2023学年高二上学期期中检测化学试题
试卷更新日期:2022-12-28 类型:期中考试
一、单选题
-
1. 火箭所需要的巨大能量由特制的燃料来提供,有关燃料燃烧过程中的变化,下列说法错误的是( )A、所有的燃烧过程均是放热的 B、需要点燃才能发生的燃烧过程是吸热的 C、所有燃料在燃烧过程中均会发生化学键的断裂 D、燃烧后产物的总能量一定小于反应物的总能量2. 化学反应伴随能量变化。下列相关描述正确的是( )A、放热过程(△H<0)或熵增加(△S>0)的过程一定是自发的 B、甲烷的标准燃烧热为890.3kJ·mol-1 , 则甲烷燃烧热的热化学方程式表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1 C、已知N2(g)+3H2(g)2NH3(g)△H=-92.2kJ·mol-1 , 在密闭容器中,过量的N2与3molH2反应时放出的能量小于92.2kJ D、同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同3. 对于反应A+3B=2C+2D,下列数据表示不同条件的反应速率,其中反应进行得最快的是( )A、v(A)=0.15mol/(L•s) B、v(B)=0.3mol/(L•s) C、v(C)=0.2mol/(L•s) D、v(D)=0.1mol/(L•s)4. 下列关于平衡常数K的说法正确的是( )A、加入催化剂可能会改变平衡常数K B、改变反应物浓度能改变平衡常数K C、平衡常数K与反应本身及温度有关 D、K越大,反应物的转化率越小5. 已知25℃,101时, , 请结合水的聚集状态变化时的焓变示意图分析,下列说法错误的是( )
 A、A过程为熔化,B过程焓增大 B、的燃烧热为571.6 C、1g冰经过A和B两个过程后化学键数目不变 D、的单位中“”指每摩尔反应6. 下列说法正确的是( )A、增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 B、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 C、升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 D、催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大化学反应速率7. 硫酸生产中,催化氧化生成的反应为放热反应。如图表示等物质的量的和在固定体积的密闭容器中反应达到平衡时,由于条件改变而引起反应速率的变化情况,下列说法正确的是( )
A、A过程为熔化,B过程焓增大 B、的燃烧热为571.6 C、1g冰经过A和B两个过程后化学键数目不变 D、的单位中“”指每摩尔反应6. 下列说法正确的是( )A、增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 B、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 C、升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 D、催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大化学反应速率7. 硫酸生产中,催化氧化生成的反应为放热反应。如图表示等物质的量的和在固定体积的密闭容器中反应达到平衡时,由于条件改变而引起反应速率的变化情况,下列说法正确的是( ) A、a时刻改变的条件可能是增大压强 B、a时刻改变的条件可能是再次加入等物质的量的和 C、b时刻改变的条件可能是降低温度 D、b时刻改变的条件可能是分离出部分8. 关于一定条件下的化学平衡H2(g)+I2(g)2HI(g) ΔH<0,下列说法正确的是( )A、恒温恒容,充入H2 , v(正)增大,平衡右移 B、恒温恒容,充入He,v(正)增大,平衡右移 C、加压,v(正),v(逆)不变,平衡不移动 D、升温,v(正)减小,v(逆)增大,平衡左移9. 甲醇和水蒸气在催化剂下发生重整制氢反应:。下列说法正确的是( )A、正反应的活化能比逆反应的活化能低 B、恒压条件下充入Ne,有利于提高甲醇平衡转化率 C、催化剂利于平衡正向移动,使其平衡常数增大 D、当混合体系密度恒定时,反应达到平衡状态10. 下列事实中不能用勒夏特列原理解释的是( )A、Fe(SCN)3溶液中加入固体KSCN后颜色变深 B、夏天喝碳酸饮料打开瓶盖大量气泡冒出 C、实验室常用排饱和食盐水法收集氯气 D、N2 + 3H2⇌2NH3 ΔH<0 工业上采用高温条件更有利于合成氨11. 对于可逆反应:2A(g)+B(g)⇌2C(g)△H<0,下列各图中正确的是( )A、
A、a时刻改变的条件可能是增大压强 B、a时刻改变的条件可能是再次加入等物质的量的和 C、b时刻改变的条件可能是降低温度 D、b时刻改变的条件可能是分离出部分8. 关于一定条件下的化学平衡H2(g)+I2(g)2HI(g) ΔH<0,下列说法正确的是( )A、恒温恒容,充入H2 , v(正)增大,平衡右移 B、恒温恒容,充入He,v(正)增大,平衡右移 C、加压,v(正),v(逆)不变,平衡不移动 D、升温,v(正)减小,v(逆)增大,平衡左移9. 甲醇和水蒸气在催化剂下发生重整制氢反应:。下列说法正确的是( )A、正反应的活化能比逆反应的活化能低 B、恒压条件下充入Ne,有利于提高甲醇平衡转化率 C、催化剂利于平衡正向移动,使其平衡常数增大 D、当混合体系密度恒定时,反应达到平衡状态10. 下列事实中不能用勒夏特列原理解释的是( )A、Fe(SCN)3溶液中加入固体KSCN后颜色变深 B、夏天喝碳酸饮料打开瓶盖大量气泡冒出 C、实验室常用排饱和食盐水法收集氯气 D、N2 + 3H2⇌2NH3 ΔH<0 工业上采用高温条件更有利于合成氨11. 对于可逆反应:2A(g)+B(g)⇌2C(g)△H<0,下列各图中正确的是( )A、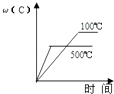 B、
B、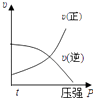 C、
C、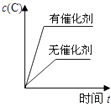 D、
D、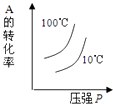 12. 在某密闭容器中发生反应3C(s)+ 2Fe2O3(s)3CO2(g)+ 4Fe(s),每隔2min测定一次CO2的浓度,测定结果如表:
12. 在某密闭容器中发生反应3C(s)+ 2Fe2O3(s)3CO2(g)+ 4Fe(s),每隔2min测定一次CO2的浓度,测定结果如表:时间/min
0
2
4
6
8
10
12
c(CO2)/(mol·L−1)
0
0.040
0.060
0.070
0.072
0.072
0.072
下列说法错误的是( )
A、反应在前4 min的平均速率为v(CO2)=0.015 mol·L−1·min−1 B、保持其他条件不变,向平衡后的容器中再充入0.2 mol C(s)时,v正>v逆 C、反应可能在8 min前达到了平衡状态 D、其他条件不变,增大容器体积,再达到平衡时,二氧化碳的浓度与原平衡时相同二、综合题
-
13. 回答下列问题:(1)、I.下表中的数据是破坏1物质中的化学键所消耗的能量,回答下列问题
物质
键能/
243
193
151
432
366
298
436
下列氢化物中最稳定的是(填字母代号)。
A.B.C.(2)、按照反应 , 生成2(填“吸收”或“放出”)的热量为。(3)、II.某温度时,在一个2L的密闭容器中, A、B、C三种气体物质的浓度随时间的变化曲线如图所示。根据图中数据填写下列空白:
该反应的化学方程式为;
(4)、从开始至2min,A的平均反应速率为;(5)、2min反应达平衡容器内混合气体的平均相对分子质量比起始时(填“大”,“小”或“相等”,下同),混合气体密度比起始时。(6)、在某一时刻采取下列措施能使该反应速率减小的是____。A、加催化剂 B、降低温度 C、容积不变,充入A D、容积不变,从容器中分离出A(7)、下列叙述能说明该反应已达到化学平衡状态的是____(填序号);A、A,B,C的物质的量之比为3∶1∶3 B、相同时间内消耗3A,同时生成nB C、容器内的压强不再变化 D、混合气体的总质量不随时间的变化而变化 E、B的体积分数不再发生变化14. 反应① , 平衡常数为K;测得在不同温度下,K值如表:温度/℃
500
700
900
K
1.00
1.47
2.40
反应② 。
(1)、反应③ 。(2)、反应①中的a0(填大于、小于、等于),平衡常数表达式是。(3)、500℃时进行反应①,若起始浓度为2 , 的平衡浓度为;若该温度下某时刻测得和的浓度分别为0.6和1.1 , 则此时v(正)v(逆)(填“>”、“<”或“=”)。
(4)、700℃反应①达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有____(填序号)。A、缩小反应器体积 B、通入 C、升高温度到900℃ D、使用合适的催化剂(5)、某温度,反应②在2L容器中加入4的和2的 , 达平衡时,测得的转化率为50%,则该反应的化学平衡常数为。15. 化学是以实验为基础的学科,请回答以下问题:(1)、I.利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取500.50盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取500.55溶液,并用同一温度计测出其温度;
③将溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
该图中有一处仪器未画出,它是。
(2)、倒入溶液时需一次性迅速倒入并立即盖上盖板,这样做的目的是。(3)、现将一定量的稀氢氧化钠溶液、稀氨水分别和1 L 1mol·L-1的稀盐酸恰好完全反应,其反应热分别为、 , 则、的大小关系为。(4)、II.现用0.1酸性溶液与0.5(草酸)溶液,研究不同条件对化学反应速率的影响。实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:实验序号
反应温度/℃
参加反应的物质
()
g
A
20
10
0.1
10
0.5
0
0
B
20
10
0.1
6
0.5
0
C
20
10
0.1
10
0.5
0
1
D
50
10
0.1
6
0.5
0
0
E
40
10
0.1
10
0.5
0
0
如果研究催化剂对化学反应速率的影响,使用实验对比可以得出结论(用A~E表示,下同)。
(5)、实验A和B,可以研究浓度对化学反应速率的影响,则。(6)、 A,B,C三组实验比较,溶液褪色所用的时间最长的是组实验。(7)、对比实验 , 可以研究温度对化学反应速率的影响16. 一定温度下,将3A气体和1B气体通过一密闭容器中,发生如下反应:。请填写下列空白:若容器体积固定为2L,反应1min时测得剩余1.8A,C的浓度0.4。
(1)、反应1min时测得剩余1.8A,则剩余B,计算得到;(2)、平衡混合物中,C的体积分数为20%,则平衡时A与B的浓度比为 , A与B的转化率比为