山东省滕州市2022-2023学年高二上学期期中考试化学试题
试卷更新日期:2022-12-28 类型:期中考试
一、单选题
-
1. 化学与社会,生产,生活密切相关。下列说法错误的是( )A、生活中用明矾净水,可加速水中悬浮物沉降 B、为除去锅炉中的水垢,可用适量稀硫酸处理,快速且不挥发酸性气体 C、废旧钢材焊接前,可用饱和氯化铵溶液处理焊点的铁锈 D、将草木灰与氯化铵混合施用,容易降低N营养元素的肥效2. 研究表明与CO在作用下发生反应,下列说法错误的是( )
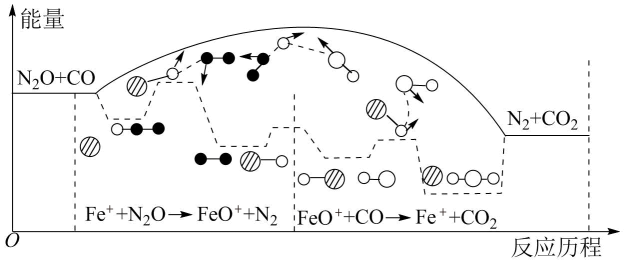 A、反应总过程 B、是该反应的中间产物 C、使反应的活化能减小 D、、两步反应均为放热反应3. 室温下,下列溶液中粒子浓度关系正确的是( )A、溶液: B、溶液: C、的溶液: D、和混合溶液:4. 用惰性电极电解含、的混合溶液 , 其中, , , 当在阳极得到气体(标准状况)时,在阴极析出固体的质量为( )A、19.2g B、22.4g C、32.0g D、38.4g5. 用活性炭还原可防止空气污染,其反应原理为。在密闭容器中和足量C发生上述反应,反应相同时间内测得的生成速率与的生成速率随温度变化的关系如图1所示;维持温度不变,反应相同时间内测得的转化率随压强的变化如图2所示。下列说法错误的是( )
A、反应总过程 B、是该反应的中间产物 C、使反应的活化能减小 D、、两步反应均为放热反应3. 室温下,下列溶液中粒子浓度关系正确的是( )A、溶液: B、溶液: C、的溶液: D、和混合溶液:4. 用惰性电极电解含、的混合溶液 , 其中, , , 当在阳极得到气体(标准状况)时,在阴极析出固体的质量为( )A、19.2g B、22.4g C、32.0g D、38.4g5. 用活性炭还原可防止空气污染,其反应原理为。在密闭容器中和足量C发生上述反应,反应相同时间内测得的生成速率与的生成速率随温度变化的关系如图1所示;维持温度不变,反应相同时间内测得的转化率随压强的变化如图2所示。下列说法错误的是( )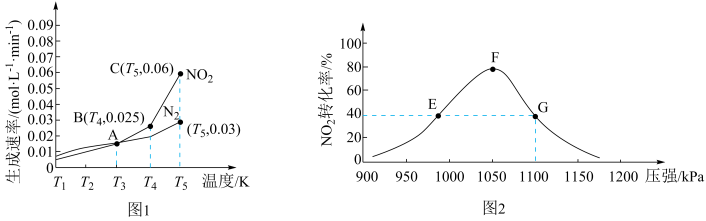 A、图1中的A,B,C三个点中只有A点的 B、图2中E点的小于F点的 C、图2中平衡常数 , 的平衡浓度 D、在恒温恒容下,向图2中G点平衡体系中充入一定量的 , 与原平衡相比,的平衡转化率减小6. 下列说法错误的是( )A、、的反应在任何温度下都能自发进行 B、对于同一物质来讲,熵值的大小与其状态有关,固态物质的熵值通常最小 C、焓变和熵变都与反应的自发性有关,因此焓变或熵变不可单独作为反应自发性的判据 D、在其他外界条件不变的情况下,使用催化剂可改变化学反应自发进行的方向7. 执法交警最常用的一种酒精检测仪的工作原理示意图如图所示,其反应原理为 , 被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法错误的( )
A、图1中的A,B,C三个点中只有A点的 B、图2中E点的小于F点的 C、图2中平衡常数 , 的平衡浓度 D、在恒温恒容下,向图2中G点平衡体系中充入一定量的 , 与原平衡相比,的平衡转化率减小6. 下列说法错误的是( )A、、的反应在任何温度下都能自发进行 B、对于同一物质来讲,熵值的大小与其状态有关,固态物质的熵值通常最小 C、焓变和熵变都与反应的自发性有关,因此焓变或熵变不可单独作为反应自发性的判据 D、在其他外界条件不变的情况下,使用催化剂可改变化学反应自发进行的方向7. 执法交警最常用的一种酒精检测仪的工作原理示意图如图所示,其反应原理为 , 被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法错误的( ) A、电解质溶液中的移向a电极 B、b为正极,电极反应式为 C、呼出气体中酒精含量越低,微处理器中通过的电流越大 D、a极上的电极反应式为8. 研究小组将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入醋酸溶液,容器中的压强随时间的变化曲线如图2。下列说法错误的是( )
A、电解质溶液中的移向a电极 B、b为正极,电极反应式为 C、呼出气体中酒精含量越低,微处理器中通过的电流越大 D、a极上的电极反应式为8. 研究小组将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入醋酸溶液,容器中的压强随时间的变化曲线如图2。下列说法错误的是( ) A、铁粉发生反应: B、时碳粉上发生了还原反应 C、时压强增大的原因不一定是铁发生了析氢腐蚀 D、时,容器中压强明显小于起始压强,原因是铁发生了吸氧腐蚀9. 下列溶液不一定呈中性的是( )A、的水 B、的溶液 C、水溶液 D、通电一小段时间后的溶液(惰性电极)10. 氯化氢直接氧化法制氯气的反应是:。刚性容器中,进料浓度比分别等于 , , 时,平衡转化率随温度变化的关系如图所示。下列说法正确的是( )
A、铁粉发生反应: B、时碳粉上发生了还原反应 C、时压强增大的原因不一定是铁发生了析氢腐蚀 D、时,容器中压强明显小于起始压强,原因是铁发生了吸氧腐蚀9. 下列溶液不一定呈中性的是( )A、的水 B、的溶液 C、水溶液 D、通电一小段时间后的溶液(惰性电极)10. 氯化氢直接氧化法制氯气的反应是:。刚性容器中,进料浓度比分别等于 , , 时,平衡转化率随温度变化的关系如图所示。下列说法正确的是( ) A、 B、适当增加反应的压强可以提高氯化氢的转化率 C、采用等于的投料比较为合适 D、若的初始浓度为c,进料比为时,11. 对于可逆反应:A2(g)+3B2(g)2AB3(g)ΔH<0,下列描述平衡移动的图象正确的是( )A、
A、 B、适当增加反应的压强可以提高氯化氢的转化率 C、采用等于的投料比较为合适 D、若的初始浓度为c,进料比为时,11. 对于可逆反应:A2(g)+3B2(g)2AB3(g)ΔH<0,下列描述平衡移动的图象正确的是( )A、 B、
B、 C、
C、 D、
D、 12. 下列事实不能说明HNO2是弱电解质的是( )A、常温下NaNO2溶液的pH大于7 B、常温下0.1 mol•L-1的HNO2溶液的pH为2.1 C、pH=11的NaNO2溶液加水稀释到100倍,pH大于9 D、用HNO2溶液作导电实验,灯泡很暗13. 关于图中各装置的叙述错误的是( )
12. 下列事实不能说明HNO2是弱电解质的是( )A、常温下NaNO2溶液的pH大于7 B、常温下0.1 mol•L-1的HNO2溶液的pH为2.1 C、pH=11的NaNO2溶液加水稀释到100倍,pH大于9 D、用HNO2溶液作导电实验,灯泡很暗13. 关于图中各装置的叙述错误的是( ) A、装置①模拟铁制品镀铜可用溶液作电镀液 B、装置②能探究浓度对锌与稀硫酸化学反应速率的影响 C、装置③可通过球内气体颜色的深浅判断温度对平衡的影响 D、装置④在充电时,应将电源的负极连接在Pb电极上
A、装置①模拟铁制品镀铜可用溶液作电镀液 B、装置②能探究浓度对锌与稀硫酸化学反应速率的影响 C、装置③可通过球内气体颜色的深浅判断温度对平衡的影响 D、装置④在充电时,应将电源的负极连接在Pb电极上二、多选题
-
14. 中华传统文化蕴含着丰富的化学知识,下列诗句中主要涉及吸热反应的是( )A、苏轼《石炭》“投泥泼水愈光明,烁玉流金见精悍” B、白居易《赋得古原草送别》“野火烧不尽,春风吹又生” C、李商隐《相见时难别亦难》“春蚕到死丝方尽,蜡炬成灰泪始干” D、于谦《石灰吟》“千锤万凿出深山,烈火焚烧若等闲”15. 工业上用溶液吸收硫酸工业尾气中的 , 并通过电解方法实现吸收液的循环再生。其中阴、阳离子交换膜组合循环再生机理如图所示,下列有关说法正确的是( )
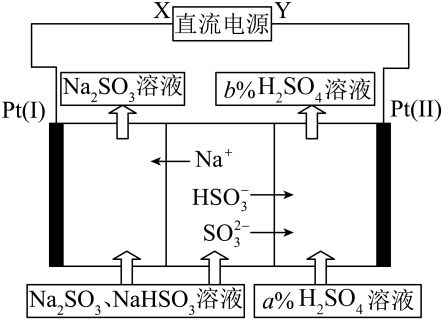 A、X应为直流电源的正极 B、电解过程中阴极区pH升高 C、图中的 D、在电极上发生的反应为:
A、X应为直流电源的正极 B、电解过程中阴极区pH升高 C、图中的 D、在电极上发生的反应为:三、综合题
-
16. 资源的可持续发展是化学家的重要研究方向。甲醇是优质的清洁燃料,经催化加氢可生成甲醇,主要有以下两个反应:
反应①:
反应②:
(1)、反应①的活化能(逆)(正)(填“>”“<”或“=”)。(2)、一定温度下,在某一恒容密闭容器中充入一定量的和 , 发生反应①。下列能说明该反应已达到平衡状态的是____(填序号)。A、混合气体的平均摩尔质量不再随时间变化而改变 B、 C、的物质的量不再随时间变化而改变 D、单位时间内每形成键,同时形成键(3)、在T温度下,将和充入2L的恒容密闭容器中发生反应①和②,达到平衡状态时和的物质的量分别为和。则T温度时反应①的平衡常数K为。(4)、在某催化剂作用下充入一定量的和 , 同时发生反应①和反应②,经相同反应时间,测得不同温度下转化率和产率的变化曲线如图1所示。时产率最高的可能原因是。 (5)、向2L密闭容器中充入和 , 在一定条件下,发生反应:。的浓度随时间变化如图2所示。其他条件不变,在时间将容器体积缩小至原来的一半,时重新达到平衡。请画出时段内浓度的变化曲线。(在答题纸对应区域作图)
(5)、向2L密闭容器中充入和 , 在一定条件下,发生反应:。的浓度随时间变化如图2所示。其他条件不变,在时间将容器体积缩小至原来的一半,时重新达到平衡。请画出时段内浓度的变化曲线。(在答题纸对应区域作图) (6)、甲醇蒸气重整法。主要反应为。设在容积为2.0L的密闭容器中充入 , 体系压强为 , 在一定条件下达到平衡状态时,体系压强为 , 且 , 则该条件下的平衡转化率为。17. 高纯度的砷可用于制备除草杀虫剂、木材防腐剂等。硫化沉淀法处理酸性含砷废水易产生大量硫化砷渣(主要成分)。一种从硫化砷废渣中回收单质砷的工艺流程如下:
(6)、甲醇蒸气重整法。主要反应为。设在容积为2.0L的密闭容器中充入 , 体系压强为 , 在一定条件下达到平衡状态时,体系压强为 , 且 , 则该条件下的平衡转化率为。17. 高纯度的砷可用于制备除草杀虫剂、木材防腐剂等。硫化沉淀法处理酸性含砷废水易产生大量硫化砷渣(主要成分)。一种从硫化砷废渣中回收单质砷的工艺流程如下:
回答下列问题:
(1)、“混合加热”之前,将硫化砷渣预先粉碎的目的是 , 然后加入溶液并加热控制温度在 , 可采用的加热方式。(2)、“氧化浸出”中,维持温度在的原因是。转化为和的离子方程式为。该过程可能产生有毒的 , 可通过电解反应其转化为无毒的。用石墨为电极,在强碱性溶液中电解含的溶液,阳极的电极反应式为。(3)、“氧化浸出”中,探究双氧水投加量对砷浸出率的影响,某实验小组取5g硫化砷渣,进行氧化浸取,控制反应温度在、分别加入不同体积的双氧水,反应4h后,浸取液中砷的质量浓度和浸出率结果如图。
由图可知双氧水的合适用量mL,增加双氧水的投加量,砷浸出率先增加的原因。
18. 时部分弱酸的电离平衡常数如下表:弱酸
电离平衡常数
(1)、在温度相同时,各弱酸的值与酸性的相对强弱的关系为。(2)、室温下① , ② , ③ , ④ , 溶液的pH由大到小的关系为(填序号)。(3)、浓度均为的和的混合溶液中,、、浓度由大到小的顺序为。(4)、在时,将的溶液与的盐酸等体积混合,反应后测得溶液 , 则a(填“>”“<”或“=”)0.01。(5)、某温度下纯水的。则此温度下溶液的。(6)、向醋酸溶液中加入水,电离平衡向移动(填“左”“右”或“不移动”);(填“变大”“变小”或“不变”)。19. 下图是一个电化学过程的示意图: (1)、图中乙池是装置(填“电解池”或“原电池”),写出通入一极的电极反应式。(2)、反应一段时间后,乙池中溶液的pH(填“增大”“减小”或“不变”)。(3)、某课外小组利用原电池原理驱动某简易小车(用电动机表示)。
(1)、图中乙池是装置(填“电解池”或“原电池”),写出通入一极的电极反应式。(2)、反应一段时间后,乙池中溶液的pH(填“增大”“减小”或“不变”)。(3)、某课外小组利用原电池原理驱动某简易小车(用电动机表示)。
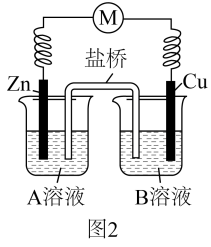
初步设计的实验装置示意图如图1所示,溶液在图1所示装置中的作用是(答两点)。
实验发现:该装置不能驱动小车。
该小组同学提出假设:
可能是氧化反应和还原反应没有完全隔开,降低了能量利用率,为进一步提高能量利用率,该小组同学在原有反应的基础上将氧化反应与还原反应隔开进行,优化的实验装置示意图如图2所示,图2中A溶液和B溶液分别是和 , 盐桥中的移向溶液。
20.(1)、Ⅰ中和热的测定:测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
仪器a的名称为 , 实验中还需要用到的玻璃仪器是。
(2)、用相同浓度和体积的氨水代替溶液进行上述实验,测得的中和热数值会偏小,原因为。(3)、Ⅱ.在试管中进行溶液间反应时,同学们无法观察到转化为 , 于是又设计了如下实验(电压表读数:)。装置
步骤
电压表读数

ⅰ.如图连接装置并加入试剂,闭合K
a
ⅱ.向B中滴入 , 至沉淀完全
b
ⅲ.再向B中投入一定量
c
ⅳ.重复ⅰ,再向B中加入与ⅲ等量
a
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
步骤ⅰ中,B中石墨上的电极反应式是。
(4)、结合信息,解释实验步骤ⅳ中的原因。(5)、能说明转化为的实验现象是。