备考2023中考化学第一轮复习:金属与金属矿物
试卷更新日期:2022-12-28 类型:一轮复习
一、单选题
-
1. 物质的性质决定用途。下列关于物质的性质与用途对应错误的是( )A、镁燃烧发出耀眼白光,可用作照明弹 B、酒精燃烧放出大量的热,可用作燃料 C、氮气的化学性质比较活泼,可用于食品充氮防腐 D、水能溶解多种物质,可用作常见的溶剂2. 下列有关实验现象描述正确的是( )A、镁条加入白醋中,产生大量气泡 B、磷在空气中燃烧产生大量白雾 C、硫在氧气中燃烧产生微弱的淡蓝色火焰 D、铜在氧气中加热,固体由绿色逐渐变成黑色3. 为了探究铁的锈蚀,同学们设计并完成了如图的家庭小实验,表明实验取得成功的现象是红墨水液面( )
 A、两端持平 B、左高右低 C、左低右高 D、无法判断4. 某化学兴趣小组探究铁生锈实验,取一块废旧铁丝网,将铁丝网剪成几小片,用稀盐酸除去铁锈后,放入锥形瓶中、在锥形瓶中加入3~4mL浓食盐水,塞紧带导管的单孔塞后,将导管的另一端伸入滴有红墨水的水中,下列说法中错误的是( )
A、两端持平 B、左高右低 C、左低右高 D、无法判断4. 某化学兴趣小组探究铁生锈实验,取一块废旧铁丝网,将铁丝网剪成几小片,用稀盐酸除去铁锈后,放入锥形瓶中、在锥形瓶中加入3~4mL浓食盐水,塞紧带导管的单孔塞后,将导管的另一端伸入滴有红墨水的水中,下列说法中错误的是( )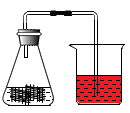 A、浓食盐水的作用是加快铁丝网生锈 B、水中滴加红墨水,便于观察实验现象 C、实验过程中,烧杯中的导管口会冒气泡 D、一段时间后,铁丝表面出现红棕色物质5. 下列说法正确的是( )A、人体中所含的钙、钾、镁、钠、铁等元素都属于常量元素 B、铁在潮湿的空气中易生锈,则隔绝氧气和水可以防止铁生锈 C、磷肥具有促进植物生长、增强抗病虫害和抗倒伏能力等功能 D、金属铝在空气中具有较强抗腐蚀性,是因为金属铝不易与空气成分反应6. 下列说法正确的是( )A、吹灭燃着的蜡烛,其灭火原理是使蜡烛与空气隔绝 B、不同种元素的本质区别是它们的核电荷数不同 C、合金是混合物,一定含金属元素,一定不含非金属元素 D、碱有一些相似的化学性质,是因为它们的溶液中都含有金属离子7. 2022年5月14日,我国首架C919大飞机首次飞行试验圆满成功.C919大量使用了铝锂合金,有效减小了飞机自重。铝锂合金属于( )
A、浓食盐水的作用是加快铁丝网生锈 B、水中滴加红墨水,便于观察实验现象 C、实验过程中,烧杯中的导管口会冒气泡 D、一段时间后,铁丝表面出现红棕色物质5. 下列说法正确的是( )A、人体中所含的钙、钾、镁、钠、铁等元素都属于常量元素 B、铁在潮湿的空气中易生锈,则隔绝氧气和水可以防止铁生锈 C、磷肥具有促进植物生长、增强抗病虫害和抗倒伏能力等功能 D、金属铝在空气中具有较强抗腐蚀性,是因为金属铝不易与空气成分反应6. 下列说法正确的是( )A、吹灭燃着的蜡烛,其灭火原理是使蜡烛与空气隔绝 B、不同种元素的本质区别是它们的核电荷数不同 C、合金是混合物,一定含金属元素,一定不含非金属元素 D、碱有一些相似的化学性质,是因为它们的溶液中都含有金属离子7. 2022年5月14日,我国首架C919大飞机首次飞行试验圆满成功.C919大量使用了铝锂合金,有效减小了飞机自重。铝锂合金属于( ) A、合成材料 B、复合材料 C、金属材料 D、天然材料8. “证据推理”是化学学科核心素养之一。下列推理正确的是( )A、混合物中至少含有两种物质,则混合物中至少含有两种元素 B、碱中含有氢元素和氧元素,所以含有氢元素和氧元素的物质一定是碱 C、铝比铁更易与氧气发生化学反应,则在空气中铝制品比铁制品更易被腐蚀 D、某物质在氧气中燃烧生成水和二氧化碳,则该物质一定含有碳、氢两种元素9. 某同学设计实验验证铁、铜、银的金属活动性顺序,下列实验不需要进行的是( )A、把铁丝浸入稀盐酸中 B、把铜丝浸入稀盐酸中 C、把银丝浸入稀盐酸中 D、把铜丝浸入硝酸银溶液中10. 化学与生活密切相关。下列说法正确的是( )A、钛合金与人体具有很好的“相容性”,可用于制造人造骨 B、甲醛能使蛋白质变质,用来浸泡海产品来保鲜 C、电木插座具有热塑性,破裂后可以修补再使用 D、霉变的食物含有黄曲霉素,加热煮熟可以食用11. 向溶液中加入一定质量的铜、锌混合粉末,充分反应后过滤,得到滤渣和滤液。下列说法正确的是( )A、滤渣中加入稀盐酸,一定没有气体产生 B、滤液中一定有Zn(NO3)2、Cu(NO3)2 , 可能有AgNO3 C、滤渣中一定没有Zn,但一定有Ag、Cu D、滤渣中一定有Ag,可能有Cu、Zn12. 鉴别、除杂是重要的实验技能。下列实验设计能达到实验目的的是( )
A、合成材料 B、复合材料 C、金属材料 D、天然材料8. “证据推理”是化学学科核心素养之一。下列推理正确的是( )A、混合物中至少含有两种物质,则混合物中至少含有两种元素 B、碱中含有氢元素和氧元素,所以含有氢元素和氧元素的物质一定是碱 C、铝比铁更易与氧气发生化学反应,则在空气中铝制品比铁制品更易被腐蚀 D、某物质在氧气中燃烧生成水和二氧化碳,则该物质一定含有碳、氢两种元素9. 某同学设计实验验证铁、铜、银的金属活动性顺序,下列实验不需要进行的是( )A、把铁丝浸入稀盐酸中 B、把铜丝浸入稀盐酸中 C、把银丝浸入稀盐酸中 D、把铜丝浸入硝酸银溶液中10. 化学与生活密切相关。下列说法正确的是( )A、钛合金与人体具有很好的“相容性”,可用于制造人造骨 B、甲醛能使蛋白质变质,用来浸泡海产品来保鲜 C、电木插座具有热塑性,破裂后可以修补再使用 D、霉变的食物含有黄曲霉素,加热煮熟可以食用11. 向溶液中加入一定质量的铜、锌混合粉末,充分反应后过滤,得到滤渣和滤液。下列说法正确的是( )A、滤渣中加入稀盐酸,一定没有气体产生 B、滤液中一定有Zn(NO3)2、Cu(NO3)2 , 可能有AgNO3 C、滤渣中一定没有Zn,但一定有Ag、Cu D、滤渣中一定有Ag,可能有Cu、Zn12. 鉴别、除杂是重要的实验技能。下列实验设计能达到实验目的的是( )选项
实验目的
实验设计
A
去除铁粉中的碳粉
在足量的氧气中灼烧
B
比较铜和银的金属活动性强弱
分别向盛有铜和银的试管中加入稀盐酸
C
鉴别硫酸铵和硫酸钾固体
分别与少量熟石灰混合后,研磨,闻气味
D
检验久置的NaOH是否变质
取样,滴加酚酞溶液
A、A B、B C、C D、D13. 下列金属中,硬度最大的是( )A、汞 B、铁 C、铬 D、金14. 现有Cu、Zn、Ag三种金属,限用一种试剂一次性就可以验证它们的金属活动性强弱,则该试剂是( )A、AgNO3溶液 B、稀H2SO4 C、CuSO4溶液 D、ZnCl2溶液15. 下列图像能正确反映其对应变化关系的是( )A、 向一定量的AgNO3、Cu(NO3)2混合溶液中加入Zn粉至过量
B、
向一定量的AgNO3、Cu(NO3)2混合溶液中加入Zn粉至过量
B、 向一定量的NaOH溶液中逐滴加入稀盐酸至过量
C、
向一定量的NaOH溶液中逐滴加入稀盐酸至过量
C、 在体积不变的密闭容器中用红磷燃烧来测定空气中氧气的含量
D、
在体积不变的密闭容器中用红磷燃烧来测定空气中氧气的含量
D、 向等质量的水中分别加入等质量的NH4NO3固体和NaOH固体
向等质量的水中分别加入等质量的NH4NO3固体和NaOH固体
二、填空题
-
16. 向盛有硝酸铜、硝酸银混合溶液的试管中加入一定量的锌粉,充分反应后过滤,滤液呈蓝色。根据上述现象推知,滤液中一定含有的阳离子是(填离子符号),滤渣中不能确定是否含有的金属是。17. 小明学习化学得知,水垢的主要成分是碳酸钙,可用稀盐酸与之反应去除。他设法找到半瓶盐酸,往家里生成水垢的烧水铝壶里注入大半壶水,又将一半的盐酸倒入,搅拌均匀后就上学去了。待放学回家,他发现水壶漏水了。这是因为小明只知其一,不知其二、用化学方程式解释导致烧水铝壶漏水的原因:。18. 小明的自行车链条上涂有润滑油,这样既可使链条与齿轮顺滑咬合,也可有效防止链条锈蚀。润滑油能够防止链条锈蚀的原因是。在金属活动性顺序中,愈加靠向左侧位置的金属,它们的活动性愈强。那么愈耐腐蚀或耐锈蚀的金属,它们的位置则愈加靠向侧。19. 如图是铁钉锈蚀条件的探究实验。一段时间后,A中铁钉锈蚀,B、C中铁钉没有锈蚀。实验A、B进行对照,说明铁钉锈蚀的条件之一是;铁锈可用稀盐酸除去,写出发生反应的化学方程式:。铝比铁活泼,但铝制品比铁制品更耐腐蚀的原因是。
 20. 向硝酸银溶液中加入一定量的锌和铜的混合粉末,充分反应后过滤,滤液呈蓝色,则滤出的固体中一定含有;滤液中一定含有的金属离子是(写离子符号)。21. 铝、铁、铜三种金属中不能与稀硫酸发生置换反应的是 , 铁制品易生锈需要做防锈处理,而铝化学性质比铁活泼,但铝制品通常不做防锈处理,原因用化学方程式表示;为验证Al、Fe、Cu的金属活动性强弱,某同学设计了如下方案,其中不合理的是。
20. 向硝酸银溶液中加入一定量的锌和铜的混合粉末,充分反应后过滤,滤液呈蓝色,则滤出的固体中一定含有;滤液中一定含有的金属离子是(写离子符号)。21. 铝、铁、铜三种金属中不能与稀硫酸发生置换反应的是 , 铁制品易生锈需要做防锈处理,而铝化学性质比铁活泼,但铝制品通常不做防锈处理,原因用化学方程式表示;为验证Al、Fe、Cu的金属活动性强弱,某同学设计了如下方案,其中不合理的是。①Al、FeSO4溶液、Cu ②Al2(SO4)3溶液、Fe、CuSO4溶液③Al、Fe、CuSO4溶液
22. 金属在生活、生产中有着非常广泛的应用,但全世界每年因金属腐蚀造成的损失超过7000亿美元。钢铁是应用最普遍的金属材料,也是最容易被腐蚀的金属材料之一,钢铁的锈蚀主要是铁与空气中的等物质发生化学反应的结果;钢铁锈蚀后生成铁锈的主要成分是(填写化学式)。有效减缓或防止钢铁锈蚀的方法为(写出一种方法即可)。23. 铁生锈是铁与共同作用的结果,用盐酸除铁锈的化学反应方程式为;三星堆出土的青铜器表面有一层铜绿,形成铜绿的化学反应为 , 则M的化学式为。24. 铁是世界上年产量最高的金属,如图为模拟炼铁的微型装置,写出a处发生反应的化学方程式 , 该反应前后化合价变化的元素是;描述b处的现象。 25. 铁制品锈蚀的过程,实际上是铁与空气中的发生化学反应的过程;铝的化学性质活泼,但是铝制品在空气中具有很好的抗腐蚀性能,其原因是(用化学方程式表示)。
25. 铁制品锈蚀的过程,实际上是铁与空气中的发生化学反应的过程;铝的化学性质活泼,但是铝制品在空气中具有很好的抗腐蚀性能,其原因是(用化学方程式表示)。三、简答题
-
26. 将ng锌粉加入一定量的硝酸镁,硝酸铜和硝酸银的混合溶液中,充分反应后过滤,得到固体和滤液,称量固体的质量为ng。(1)、写出一个该实验过程中发生反应的化学方程式。(2)、请分析滤液中溶质的成分。27. 请结合所学知识解释下列问题。(1)、炎热的夏天汽车更容易爆胎。(2)、二氧化碳能灭火,而一氧化碳能燃烧。(3)、铝的化学性质很活泼,但铝制品的耐腐蚀性能却很好。
四、综合题
-
28. 生活中处处离不开化学。(1)、薯片等易碎食品宜采用充气包装,下列气体中适宜充入的是____(选填序号)。A、氧气 B、氮气 C、二氧化硫 D、氨气(2)、在雾霾天气中,人们常佩戴防PM2.5专用口罩,此口罩夹层中的活性炭县有作用。(3)、蔗糖不易燃烧,掺入少量烟灰后,就能直接点燃(烟灰不能燃烧)。烟灰可能的作用为。(4)、“西气东输”工程已将天然气送入句容。为了安全,应在厨房安装天然气泄漏报警器(如图a处),由图可判断天然气的密度比空气(选填“大”或“小”)。
 (5)、多喝硬水易导致结石问题,日常生活中一般通过降低硬度。(6)、做铁生锈实验时,瓶中加入3~4mL浓食盐水,浓食盐水的作用是。29. 化学来源于生活,又服务于生活,请用所学化学知识回答下列问题。(1)、日常生活中,切菜刀采用的防锈措施是。(2)、古人在野外生火时常“钻木取火”。“钻木取火”满足的燃烧的条件是____(填序号)。A、提供可燃物 B、与氧气接触 C、达到燃烧所需的最低温度(3)、下图金属应用的实例,主要利用金属的导热性的是____(填序号);A、
(5)、多喝硬水易导致结石问题,日常生活中一般通过降低硬度。(6)、做铁生锈实验时,瓶中加入3~4mL浓食盐水,浓食盐水的作用是。29. 化学来源于生活,又服务于生活,请用所学化学知识回答下列问题。(1)、日常生活中,切菜刀采用的防锈措施是。(2)、古人在野外生火时常“钻木取火”。“钻木取火”满足的燃烧的条件是____(填序号)。A、提供可燃物 B、与氧气接触 C、达到燃烧所需的最低温度(3)、下图金属应用的实例,主要利用金属的导热性的是____(填序号);A、 电缆
B、
电缆
B、 电热壶
C、
电热壶
C、 金属丝
D、
金属丝
D、 金属乐器
金属乐器
五、实验探究题
-
30. 某兴趣小组同学将一块薄铜片盖在蜡烛火焰上方(如图),一段时间后,发现铜片被“熏黑”了。针对铜片上产生的黑色固体,请你参与探究。

【查阅资料】①蜡烛不充分燃烧产生炭黑(即黑烟)。
②氧气的化学性质比较活泼,加热条件下能与金属铜反应生成黑色的氧化铜。
【猜想与假设】甲认为:铜片表面的黑色固体是炭黑。
乙认为:铜片表面的黑色固体是氧化铜。
丙认为:铜片表面的黑色固体是炭黑和氧化铜的混合物。
(1)、【进行实验】实验步骤和方法
实验现象
实验结论
实验一:取一小段光亮铜片,放入试管内,然后用试管夹夹持试管,放在酒精灯的外焰部位加热。
铜片变黑
可推知(填甲、乙、丙)的猜想都不正确。
实验二:取一试管,将一小段光亮铜片放入试管中,塞上胶塞,并用注射器抽出试管内的空气,封好胶塞,并加热,趁热取下胶塞,观察现象。
取下胶塞前的现象:。
取下胶塞后的现象:。
乙的猜想正确
(2)、【反思拓展】实验一将铜片放入试管中加热,目的是排除的干扰。
(3)、由实验说明产生黑色物质是铜与空气中的氧气反应产生的新物质。请写出该反应的文字表达式。(4)、铜与氧气反应只生成氧化铜,(填“能”或“不能”)用此反应来设计实验测定空气中氧气的体积分数。31. 如图是木炭还原氧化铜实验的装置图。试回答: (1)、实验时要把粉末平铺在试管底部,是为了;(2)、当观察到现象时,证明左面试管中的反应结束了;(3)、实验过程中左面试管中所发生反应的化学方程式为。
(1)、实验时要把粉末平铺在试管底部,是为了;(2)、当观察到现象时,证明左面试管中的反应结束了;(3)、实验过程中左面试管中所发生反应的化学方程式为。六、计算题
-
32. 黄铜是 Cu-Zn 合金,小清和小新对黄铜的成分产生兴趣,他俩决定对黄铜中的铜元素含量进行测定探究:
小清称取 10g 黄铜样品,量取 60g 稀盐酸平均分成六等份,分别加入到盛有黄铜的烧杯中,当小新观察到无气泡冒出时记录了以下表格数据:
次数
1
2
3
4
5
6
加盐酸质量(g)
10
20
30
40
50
60
烧杯中固体质量
8.7
7.4
6.1
4.8
3.5
3.5
请回答下列问题:
(1)、当反应到无气泡冒出时,生成氢气g。(2)、反应所用盐酸的质量分数是多少?(写出计算过程)(3)、画出黄铜的质量随加入盐酸的变化关系图: 33. 实验室有一瓶硫酸溶液,老师请小红同学设计方案测定该废液中硫酸的质量分数。小红同学先取一洁净小烧杯,称其质量为18.2g,然后往其中倒入少量硫酸废液后称量,总质量为33.2g,之后,将一枚质量为10.8g的铁钉(已用砂纸打磨去铁锈)放入该小烧杯中反应,待铁钉表面不再有气泡产生后,再次称量,总质量为43.9g。
33. 实验室有一瓶硫酸溶液,老师请小红同学设计方案测定该废液中硫酸的质量分数。小红同学先取一洁净小烧杯,称其质量为18.2g,然后往其中倒入少量硫酸废液后称量,总质量为33.2g,之后,将一枚质量为10.8g的铁钉(已用砂纸打磨去铁锈)放入该小烧杯中反应,待铁钉表面不再有气泡产生后,再次称量,总质量为43.9g。请回答下列问题:
(1)、反应中产生的气体的质量是多少?(2)、计算该废液中硫酸的质量分数(写出计算过程,计算结果保留一位小数)。(3)、如果铁钉的铁锈未除净,对计算结果的影响是(选填“偏大”、“偏小”、“无影响”),原因是。34. 为测定某样品中锌的质量(样品中的其他物质既不与酸反应也不溶于水),某化学小组同学进行了如下图所示实验。请根据图中提供的数据进行计算: (1)、样品中锌的质量为g。(2)、计算实验结束后所得溶液的溶质质量分数。(计算结果精确到0.1%)
(1)、样品中锌的质量为g。(2)、计算实验结束后所得溶液的溶质质量分数。(计算结果精确到0.1%)