备考2023中考化学第一轮复习:质量守恒定律
试卷更新日期:2022-12-28 类型:一轮复习
一、单选题
-
1. 下列有关叙述和对应的化学方程式均正确的是 ( )A、用含氢氧化镁的药物治疗胃酸过多症
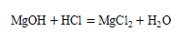 B、正常雨水显酸
B、正常雨水显酸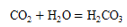 C、比较铜和银的金属活动性
C、比较铜和银的金属活动性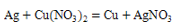 D、乙醇燃烧
D、乙醇燃烧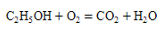 2. 现有 Mg 和 MgO 的固体混合物 3g,经测定镁元素的质量分数为 80%,向固体混合物中加入100g 一定溶质质量分数的稀硫酸,恰好完全反应,下列说法不正确的是( )A、反应后溶液中的溶质只有MgSO4 B、反应中有气泡产生 C、所用稀硫酸中溶质的质量分数为 19.6% D、生成 MgSO4 的质量为 12g3. 苯C6H6 是一种无色、有甜味的透明液体,可燃,有毒.下列有关苯的说法正确的是 ( )A、苯是由碳原子和氢原子构成的 B、每个苯分子由6个碳原子和6个氢原子构成 C、苯的相对分子质量为78g D、苯中碳、氢元素的质量比为1:14. 一定质量过氧化氢溶液在二氧化锰作用下反应。下列图像不能正确反映其变化过程的是( )A、
2. 现有 Mg 和 MgO 的固体混合物 3g,经测定镁元素的质量分数为 80%,向固体混合物中加入100g 一定溶质质量分数的稀硫酸,恰好完全反应,下列说法不正确的是( )A、反应后溶液中的溶质只有MgSO4 B、反应中有气泡产生 C、所用稀硫酸中溶质的质量分数为 19.6% D、生成 MgSO4 的质量为 12g3. 苯C6H6 是一种无色、有甜味的透明液体,可燃,有毒.下列有关苯的说法正确的是 ( )A、苯是由碳原子和氢原子构成的 B、每个苯分子由6个碳原子和6个氢原子构成 C、苯的相对分子质量为78g D、苯中碳、氢元素的质量比为1:14. 一定质量过氧化氢溶液在二氧化锰作用下反应。下列图像不能正确反映其变化过程的是( )A、 B、
B、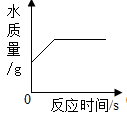 C、
C、 D、
D、 5. 在一个密闭容器中放入、、、 , 在一定条件下发生化学反应,一段时间后,测得有关数据如下表。则关于此反应的认识错误的是( )
5. 在一个密闭容器中放入、、、 , 在一定条件下发生化学反应,一段时间后,测得有关数据如下表。则关于此反应的认识错误的是( )物质
Ⅹ
反应前的质量
反应后的质量
待测
A、物质可能是该反应的催化剂 B、待测值为 C、该反应为化合反应 D、反应中、的质量比为6. 维生素主要存在于蔬菜、水果中,它能促进人体生长发育,增强人体对疾病的抵抗力。下列关于维生素的说法中错误的是( )A、维生素中 , , 三种元素的质量比为 B、个维生素分子由个碳原子、个氢原子、个氧原子构成 C、维生素的相对分子质量为 D、维生素中氢元素的质量分数为7. 一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反应,测得反应前后各物质的质量如下表所示。下列说法正确的是( )物质
甲
乙
丙
丁
反应前质量





反应后质量



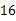
 A、上表中
A、上表中 的值是
的值是  B、该反应的基本反应类型是化合反应
C、乙一定是该反应的催化剂
D、丙和丁变化的质量比为
B、该反应的基本反应类型是化合反应
C、乙一定是该反应的催化剂
D、丙和丁变化的质量比为  :
:  8. 碳酸二甲酯(C3H6O3)是一种低毒、环保性能优异、用广泛的化工原料。下关于碳酸二甲酯的说法正确的是( )A、碳酸二甲酯由碳、氢、氧元素组成 B、碳酸二甲酯中含有3个氢分子 C、碳酸二甲酯的相对分子质量为90g D、碳酸二甲酯中氢元素的质量分数最大9. 已知亚硝酸钠(NaNO2)外观与食盐很相似,有咸味,误食会使人中毒。亚硝酸钠易分解,放出有刺激性气味的气体,你认为此气体可能是( )A、O2 B、N2 C、SO2 D、NO210. 在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量如下表。下列说法正确的是( )
8. 碳酸二甲酯(C3H6O3)是一种低毒、环保性能优异、用广泛的化工原料。下关于碳酸二甲酯的说法正确的是( )A、碳酸二甲酯由碳、氢、氧元素组成 B、碳酸二甲酯中含有3个氢分子 C、碳酸二甲酯的相对分子质量为90g D、碳酸二甲酯中氢元素的质量分数最大9. 已知亚硝酸钠(NaNO2)外观与食盐很相似,有咸味,误食会使人中毒。亚硝酸钠易分解,放出有刺激性气味的气体,你认为此气体可能是( )A、O2 B、N2 C、SO2 D、NO210. 在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量如下表。下列说法正确的是( )物质
a
b
c
d
反应前的质量/g
40
40
32
10
反应后的质量/g
12
x
0
10
A、x等于60 B、b可能是单质 C、该反应属于化合反应 D、参加反应的a与c的质量比为5:411. 微观示意图可形象地表示微粒的变化,下图是某反应前后分子变化的微观示意图,其中相同的球代表相同的原子。下列说法正确的是( )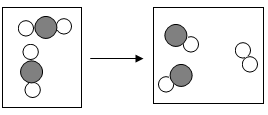 A、该反应前后元素的种类发生改变 B、该反应前后分子的个数不变 C、在化学反应中,分子可分,原子不可再分 D、反应物与生成物共有5种物质12. 环氧乙烷(化学式为C2H4O)常用于消毒医疗用品,如绷带、缝线及手术器具等。下列对环氧乙烷的说法错误的是( )A、环氧乙烷属于氧化物 B、环氧乙烷的相对分子质量为44 C、环氧乙烷中氢元素的质量分数最小 D、1个环氧乙烷分子是由2个碳原子、4个氢原子和1个氧原子构成13. 纯净物M加热可分解为NH3、H2O和CO2 , 根据这一实验事实推断M的化学式可能是( )A、Na2CO3 B、NaHCO3 C、(NH4)2SO4 D、(NH4)2CO314. 下列图像,能正确反映对应变化关系的是( )A、
A、该反应前后元素的种类发生改变 B、该反应前后分子的个数不变 C、在化学反应中,分子可分,原子不可再分 D、反应物与生成物共有5种物质12. 环氧乙烷(化学式为C2H4O)常用于消毒医疗用品,如绷带、缝线及手术器具等。下列对环氧乙烷的说法错误的是( )A、环氧乙烷属于氧化物 B、环氧乙烷的相对分子质量为44 C、环氧乙烷中氢元素的质量分数最小 D、1个环氧乙烷分子是由2个碳原子、4个氢原子和1个氧原子构成13. 纯净物M加热可分解为NH3、H2O和CO2 , 根据这一实验事实推断M的化学式可能是( )A、Na2CO3 B、NaHCO3 C、(NH4)2SO4 D、(NH4)2CO314. 下列图像,能正确反映对应变化关系的是( )A、 水通电分解
B、
水通电分解
B、 向溶质的质量分数为20%的氯化钠溶液中不断加入蒸馏水
C、
向溶质的质量分数为20%的氯化钠溶液中不断加入蒸馏水
C、 常温下向某不饱和的硝酸钾溶液中不断加入硝酸钾固体
D、
常温下向某不饱和的硝酸钾溶液中不断加入硝酸钾固体
D、 用15%的过氧化氢溶液和二氧化锰混合制取氧气
15. 2022年2月4日北京冬奥会开幕式上,“立春”、“迎客松”、“漫天雪花”等璀璨的焰火表演让世界惊艳,焰火药剂无重金属、低硫,均是高科技环保产品,体现了绿色办奥的理念。小明根据下列现象推测烟花爆竹的成分中可能含有什么物质,其中不合理的是( )A、燃放烟花时,发出耀眼的白光,说明烟花中可能含有镁粉 B、燃放烟花时,发出蓝紫色火焰,说明烟花中可能含有铁粉 C、爆竹的火药呈现黑色,说明火药的成分中可能含有木炭粉 D、爆竹爆炸后,产生刺激性气味气体,说明火药成分中可能含有硫粉
用15%的过氧化氢溶液和二氧化锰混合制取氧气
15. 2022年2月4日北京冬奥会开幕式上,“立春”、“迎客松”、“漫天雪花”等璀璨的焰火表演让世界惊艳,焰火药剂无重金属、低硫,均是高科技环保产品,体现了绿色办奥的理念。小明根据下列现象推测烟花爆竹的成分中可能含有什么物质,其中不合理的是( )A、燃放烟花时,发出耀眼的白光,说明烟花中可能含有镁粉 B、燃放烟花时,发出蓝紫色火焰,说明烟花中可能含有铁粉 C、爆竹的火药呈现黑色,说明火药的成分中可能含有木炭粉 D、爆竹爆炸后,产生刺激性气味气体,说明火药成分中可能含有硫粉二、填空题
-
16. 在点燃条件下,4.0 g C3H4与11.2 g O2恰好完全反应,生成8. 8 g CO2、3. 6 g H2O和x g CO。则x的值为 , 写出该反应的化学方程式。17. 已知某氮的氧化物中,氮元素和氧元素的质量比为7:20,则此氧化物的化学式为。18. 比较相同质量的镁、铝、锌三种金属,所含原子个数最多的是(填化学符号);硝酸铵是一种重要的氮肥,1000克硝酸铵中含氮元素的质量是。19. 在化学反应前后,下列各项中①原子的数目,②分子的数目,③原子的种类,④物质的种类,⑤分子的种类,肯定不会改变的是;肯定会改变的是。20. 甲和乙两种物质反应的示意图如下。请回答下列问题:

上述反应的化学方程式为;反应中化合价降低的元素是(写元素符号);发生氧化反应的物质是(写化学式)。
21. 生活经验告诉我们,在常温下,铁与水是不发生反应的,但在高温下,铁粉能与水蒸气发生反应生成四氧化三铁和氢气。请回答下列问题:上述反应的化学方程式为;反应中化合价升高的元素是(写元素符号);具有氧化性的物质是(写化学式)。
22. 在今年两会上我国政府首次提出碳中和,承诺2030年后二氧化碳排放量将逐步减少,为控制二氧化碳的排放量,科学家采取新技术,将二氧化碳和氢气在催化剂和加热条件下转化为重要的化工原料乙烯(C2H4)和水,反应的化学方程式为。23. 利用催化剂可有效消除室内装修材料释放的有害气体甲醛(HCHO)。请根据下图写出反应的化学方程式。 24. 掌握化学用语,是学好化学的重要前提。用化学用语按下列要求填空:
24. 掌握化学用语,是学好化学的重要前提。用化学用语按下列要求填空:人体内含量最高的金属元素是 , 它与水所含的两种元素组成一种物质,该物质的化学式是 , 其中阴离子的化合价为 , 阳离子符号为 , 该物质的溶液与干冰反应的化学方程式为 。
25. 截至 2022 年 3 月 24 日,“祝融号”火星车在火星表面工作了 306 个火星日,累计行驶了 1784 米,“祝融号”上使用了我国自主研发的砷化镓(GaAs)太阳能电池,该电池将转化为电能。(CH3)3Ga 和 AsH3在 700℃的条件下反应,可制得砷化镓并生成一种最简单的有机物,请写出该反应的化学方程式。三、简答题
-
26. 写出下列反应的化学方程式:(1)、木炭在充足的氧气中完全燃烧(2)、碳酸氢钠和稀盐酸混合(3)、高锰酸钾制取氧气27. 某粗盐中可能含有杂质氯化镁、氯化钙、硫酸钠中的一种或几种,为了确定其成分,并对其提纯,某同学设计了如下的实验步骤:
 (1)、步骤⑥中玻璃棒的作用。(2)、根据以上实验现象,请你分析该粗盐中可溶性杂质的成分。(3)、写出步骤⑤发生反应的化学反应方程式(任写其中一个)。
(1)、步骤⑥中玻璃棒的作用。(2)、根据以上实验现象,请你分析该粗盐中可溶性杂质的成分。(3)、写出步骤⑤发生反应的化学反应方程式(任写其中一个)。四、综合题
-
28. 生活中处处有化学(1)、疫情防控时期,84 消毒液 (含NaClO)是常用的消毒剂,但若将 84 消毒液与洁厕灵(含HCl)混合,会产生有毒的气体,两者反应化学方程式为:NaClO+2HCl=NaCl+X↑+H2O,则X为。(2)、已知碳酸氢钙(Ca(HCO3)2 易溶于水。向一定量的澄清石灰水中通入二氧化碳,产生的现象是 , 若再继续通入二氧化碳,又会看到的现象是。(3)、煤燃烧会产生SO2 , 有可能形成酸雨,为减少SO2 放排,常用氢氧化钠溶液吸收则两者发生反应的化学方程式为:。29. 工业上可通过下列工艺流程处理工厂排放的含二氧化硫的尾气并获得氢气。
 (1)、上述流程中,能被循环利用的物质是(填化学式)。(2)、膜反应器中,发生的化学反应类型为反应。(3)、主反应器中反应的化学方程式为。30. 化学与我们的生产、生活息息相关。(1)、从下列选项中选择一种适当的物质填空(填字母序号)。
(1)、上述流程中,能被循环利用的物质是(填化学式)。(2)、膜反应器中,发生的化学反应类型为反应。(3)、主反应器中反应的化学方程式为。30. 化学与我们的生产、生活息息相关。(1)、从下列选项中选择一种适当的物质填空(填字母序号)。A.水 B.氢气 C.酒精 D.二氧化锰 E.稀有气体
①可用于填充氢气球的气体是。
②可用于医用消毒、杀菌的是。
③可制成多种用途的电光源的是。
④一切生命体生存所必需的物质是。
⑤可用作某些化学反应的催化剂的是。
(2)、随着工业的发展,排放到空气中的有害气体和烟尘对空气造成了污染。形成酸雨的主要气体污染物是____(填字母序号)。A、臭氧 B、二氧化碳 C、二氧化硫 D、一氧化碳(3)、用五氧化二碘(I2O5)可以测定空气受一氧化碳气体污染的程度,发生反应的化学方程式为: , 则其中m的值为。五、实验探究题
-
31. 纯碱在工业上有广泛的应用.实验室模拟工业上利用饱和食盐水生产纯碱的流程图(图1):

回答下列问题:
(1)、反应 1 的化学方程式为。(2)、操作 1 中,需要用到的玻璃仪器除漏斗、玻璃棒外,还有。(3)、纯碱的化学式为 , X 的化学式为 .(4)、“后续处理”主要包括蒸发浓缩、、过滤等操作,参考图 2 的溶解度曲线分析,采用这些操作方法的原因是 .32. 某化学兴趣小组的同学在老师的指导下进行课外实验,利用图A装置来探究单质在空气中燃烧后氧气浓度的变化情况。
【提出问题】足量的红磷在密闭的四颈平底烧瓶内燃烧熄灭后,容器中是否有氧气剩余?
【猜想与假设】猜想一:有氧气剩余;猜想二:无氧气剩余
【实验验证】该小组同学按照图A组装好实验装置,利用高能激光笔照射燃烧匙上的红磷,红磷燃烧直至熄灭:待装置完全冷却后,将装有白磷的燃烧匙提出水面,再次用高能激光笔照射,白磷居然也被点燃。
(1)、红磷燃烧的产物能与瓶底中的热水反应,生成磷酸(H3PO4),请写出该反应的化学方程式。(2)、根据上述实验现象,可以得出猜想是正确的。(3)、课本上用红磷燃烧的方法(填“能”或“不能”)精确的测出空气中氧气的含量,理由是。(4)、【拓展延伸】图B是该小组从开始实验到最后装冷却后的整个实验过程,用氧气传感器测量容器内氧气浓度变化的曲线图。BC段氧气浓度变化的主要原因是。
六、计算题
-
33. 摄入适当剂量的柠檬酸(化学式为)对身体无害,可促进体内的正常代谢。在食品中加入柠檬酸后口感更好,并可促进食欲。计算:(1)、1个柠檬酸分子中含有个原子。柠檬酸中碳、氢、氧元素的质量比为(填最简整数比)。(2)、96g柠檬酸中氧元素的质量。