江苏省徐州市2022-2023学年九年级上学期第三次学情调研化学试题
试卷更新日期:2022-12-27 类型:月考试卷
一、单选题
-
1. 从人类文明的历史来看,铜、铁、铝、钛等金属广泛使用的先后顺序正确的是( )A、铜、铁、铝、钛 B、铁、铜、铝、钛 C、铜、铁、钛、铝 D、钛、铝、铜、铁2. 下列过程主要发生化学变化的是( )A、水结冰 B、铁矿石炼铁 C、风力发电 D、石蜡融化3. 下列化学用语表示正确的是( )A、氯原子结构示意图:
 B、2个氢氧根:2OH2-
C、氧化镁的化学式:MgO2
D、60个氮原子:N60
4. 下列实验操作正确的是( )A、
B、2个氢氧根:2OH2-
C、氧化镁的化学式:MgO2
D、60个氮原子:N60
4. 下列实验操作正确的是( )A、 加块状固体
B、
加块状固体
B、 加热液体
C、
加热液体
C、 倾倒液体
D、
倾倒液体
D、 振荡试管,
5. 如图所示装置可用来测定空气中氧气的含量,对该实验认识错误的是( )
振荡试管,
5. 如图所示装置可用来测定空气中氧气的含量,对该实验认识错误的是( ) A、红磷的量不足会影响实验结论 B、装置不漏气是实验成功的重要因素之一 C、将红磷改为碳也能得到正确的实验结论 D、随着集气瓶内气体压强的减小水可以被压入集气瓶中6. 下列实验现象描述正确的是( )A、木炭在空气中燃烧生成二氧化碳 B、铁在空气中燃烧火星四射,生成黑色固体 C、干冰在空气中会产生大量的白烟 D、镁条燃烧发出耀眼的白光,生成白色固体7. 下列推理正确的是( )A、蔗糖以分子形式分散在水中,所以物质都以分子分散到水中 B、CO2能灭火,所以能使燃着的木条熄灭的无色气体一定是CO2 C、铜锈的主要成分是Cu2 (OH) 2CO3 , 所以铜生锈可能与H2O, CO2, O2有关 D、金属和稀盐酸反应能生成气体,所以和稀盐酸反应生成气体的物质一定是金属8. 高锰酸钾和浓盐酸发生如下应:2KMnO4+16HCl=2KCl=2MnCl2+5X↑+8H2O根据质量守恒定律,推测X应是()A、HClO B、ClO2 C、O2 D、Cl29. 维生素的化学式为C28H44O,下列关于维生素的说法正确的是( )A、相对分子质量是396g B、维生素由28个碳原子、44个氢原子、1个氧原子构成 C、碳元素的质量分数为84.8% D、C,H,O元素的质量比为28:44:110. 在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少是,0表示物质质量不变),下列说法正确的是()
A、红磷的量不足会影响实验结论 B、装置不漏气是实验成功的重要因素之一 C、将红磷改为碳也能得到正确的实验结论 D、随着集气瓶内气体压强的减小水可以被压入集气瓶中6. 下列实验现象描述正确的是( )A、木炭在空气中燃烧生成二氧化碳 B、铁在空气中燃烧火星四射,生成黑色固体 C、干冰在空气中会产生大量的白烟 D、镁条燃烧发出耀眼的白光,生成白色固体7. 下列推理正确的是( )A、蔗糖以分子形式分散在水中,所以物质都以分子分散到水中 B、CO2能灭火,所以能使燃着的木条熄灭的无色气体一定是CO2 C、铜锈的主要成分是Cu2 (OH) 2CO3 , 所以铜生锈可能与H2O, CO2, O2有关 D、金属和稀盐酸反应能生成气体,所以和稀盐酸反应生成气体的物质一定是金属8. 高锰酸钾和浓盐酸发生如下应:2KMnO4+16HCl=2KCl=2MnCl2+5X↑+8H2O根据质量守恒定律,推测X应是()A、HClO B、ClO2 C、O2 D、Cl29. 维生素的化学式为C28H44O,下列关于维生素的说法正确的是( )A、相对分子质量是396g B、维生素由28个碳原子、44个氢原子、1个氧原子构成 C、碳元素的质量分数为84.8% D、C,H,O元素的质量比为28:44:110. 在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少是,0表示物质质量不变),下列说法正确的是()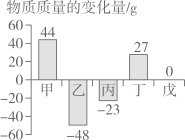 A、该反应一定属于置换反应 B、戊一定是该反应的催化剂 C、参加反应的乙、丙的质量比一定为48:23 D、该反应中甲、丁的相对分子质量之比一定为44:27
A、该反应一定属于置换反应 B、戊一定是该反应的催化剂 C、参加反应的乙、丙的质量比一定为48:23 D、该反应中甲、丁的相对分子质量之比一定为44:27二、填空题
-
11. 按要求用化学符号填空:(1)、2个氢原子;(2)、3个碳酸根离子;(3)、相对分子质量最小的氧化物;(4)、氧化铝中铝元素显+3价。12. 铁是应用最广泛的金属。
 (1)、为了检验铁生锈的条件,进行了如上图(略去其中的夹持装置)所示三个对比实验。
(1)、为了检验铁生锈的条件,进行了如上图(略去其中的夹持装置)所示三个对比实验。一段时间后,甲中铁丝发生锈蚀且试管中液面上升,乙和丙中均无明显变化。由此得出铁丝锈蚀的过程,实际上是铁丝与 、 发生化学反应的过程。
(2)、铁制品在下列情况:①潮湿空气中②部分浸入食盐水中③干燥的空气中 最易生锈的是 填序号,下同),不易生锈的是 。(3)、在“南海一号”打捞出来的文物中,铁器锈迹斑斑,残存很少,而“金龙纹手镯”光彩夺目,完好无损。这说明铁的金属活动性比金的 (填“强”或“弱”)(4)、为了验证铁、铜的金属活动性顺序,除了选择用砂纸打磨干净的铁钉外,还需要选择的一种溶液是 溶液。三、综合题
-
13. 某工厂从含铜废料中回收铜的生产流程如下。(提示:铜灼烧后的固体可以与稀硫酸反应生成硫酸铜和水;含铜废料中,除铜外其余物质不与氧气或稀硫酸反应且不溶于水。)
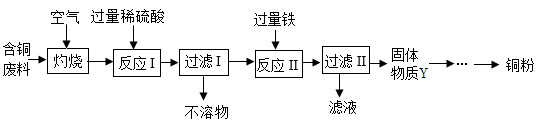 (1)、含铜废料灼烧时发生的反应的化学方程式为。(2)、反应Ⅱ中,铁与过滤I得到滤液发生反应,写出有关的化学方程式:。(3)、固体物质Y的成分是。14. 请回答下列实验问题:
(1)、含铜废料灼烧时发生的反应的化学方程式为。(2)、反应Ⅱ中,铁与过滤I得到滤液发生反应,写出有关的化学方程式:。(3)、固体物质Y的成分是。14. 请回答下列实验问题: (1)、甲仪器的名称是。(2)、实验室用双氧水和二氧化锰制氧气的化学方程式为 , 可用C装置收集O2的原因是。(3)、实验室制备CO2的化学方程式为;通常用澄清石灰水检验CO2气体,其化学方程式为。(4)、用E装置能完成的实验是____(填字母序号)。A、瓶内不放任何物质,CO2从a端通入,用排空气法收集CO2 B、瓶内装满水,a端连接导管伸入量筒,O2从b端通入,测量O2的体积 C、瓶内盛有可以吸水的液体,气体由导管b端进入,除去H2中的少量水蒸气15. 金属材料在生产、生活中有广泛的应用,人类的生产和生活都离不开金属。(1)、 (一)铁的应用和防护
(1)、甲仪器的名称是。(2)、实验室用双氧水和二氧化锰制氧气的化学方程式为 , 可用C装置收集O2的原因是。(3)、实验室制备CO2的化学方程式为;通常用澄清石灰水检验CO2气体,其化学方程式为。(4)、用E装置能完成的实验是____(填字母序号)。A、瓶内不放任何物质,CO2从a端通入,用排空气法收集CO2 B、瓶内装满水,a端连接导管伸入量筒,O2从b端通入,测量O2的体积 C、瓶内盛有可以吸水的液体,气体由导管b端进入,除去H2中的少量水蒸气15. 金属材料在生产、生活中有广泛的应用,人类的生产和生活都离不开金属。(1)、 (一)铁的应用和防护常州地铁的轨道主要材料是铁合金制作的,其硬度比纯铁。
(2)、为防止铁生锈,通常会对铁制品进行“烤蓝”处理,烤蓝是用化学方法在铁表面生成层致密的四氧化三铁(Fe3O4)保护膜。烤蓝的原理是:在高温下,铁与水发生反应,生成四氧化三铁和一种单质气体,写出该反应的化学反应方程式:。(3)、 (二)铁的冶炼我国劳动人民在春秋战国时期就会治铁炼钢,实验室模拟炼铁实验装置如下图所示。

实验时,应先注水片刻后再加热的目的是。
(4)、实验过程中,硬质玻璃管中发生的化学方程式为。(5)、有同学提出黑色粉末中还可能含有Fe3O4。已知:Fe3O4能溶于稀H2SO4 , 且有Fe3+生成;Fe3+遇到硫氰化钾溶液显血红色。为证明黑色粉末成分,该同学取少量样品于烧杯中,加过量稀H2SO4 , 充分反应后,滴加少量硫氰化钾,证明黑色粉末中含有Fe和Fe3O4的现象是。(6)、若取16g氧化铁粉末进行实验,反应一段时间后,经检测剩余黑色固体成分是Fe和 ,称量固体的质量为X,则X的范围为。四、计算题
-
16. 学习化学后,小红同学知道了鸡蛋壳的主要成分是碳酸钙。为了测定鸡蛋壳中碳酸钙的质量分数,她收集了干燥的鸡蛋壳拿去实验室,与足量稀盐酸在烧杯中反应(杂质不与盐酸反应)。有关实验数据如下表:
反应前
反应后
烧杯和稀盐酸总质量
鸡蛋壳的质量
烧杯和剩余物总质量
150g
6.25g
154.05g
(1)、反应生成CO2的质量为多少g。(2)、请你帮助小红同学计算她收集的鸡蛋壳中碳酸钙的质量分数。(写出计算过程)