重庆市万州区名校2022-2023学年高二上学期12月线上考试 化学
试卷更新日期:2022-12-26 类型:月考试卷
一、单选题( 每个4分,共4×16=64分
-
1. 下列事实:①NaHSO4溶液呈酸性;②长期施用化肥(NH4)2SO4会使土壤酸性增强,发生板结; ③配制CuCl2液时,用稀盐酸溶解CuCl2固体;④NaHS溶液中c(H2S)>c(S2-);⑤明矾净水;⑥蒸干FeCl3溶液,得不到FeCl3固体。
其中与盐类的水解有关的有( )
A、仅②③⑤ B、仅②③④⑤⑥ C、仅①②③④⑤⑥ D、仅②③④⑤2. 设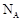 为阿伏加德罗常数的值,下列说法正确的是( ) A、
为阿伏加德罗常数的值,下列说法正确的是( ) A、 的
的 溶液中,所含的
溶液中,所含的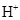 离子总数为
离子总数为 B、
B、 溶液中,所含的阳离子总数大于
溶液中,所含的阳离子总数大于 C、一定条件下,在某一恒容密闭容器中,
C、一定条件下,在某一恒容密闭容器中, 和
和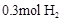 充分反应后,生成的
充分反应后,生成的 分子总数为
分子总数为 D、
D、 溶液中,所含的
溶液中,所含的 分子总数为
分子总数为 3. 下列有关实验内容、实验装置和对应的实验目的均正确的是( )
3. 下列有关实验内容、实验装置和对应的实验目的均正确的是( )A
B
C
D
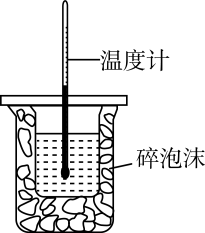
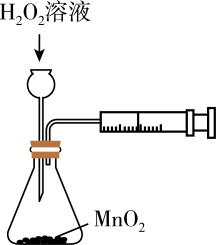

将球浸泡在冷水和热水中
测定中和热
测定的生成速率
验证反应的吸放热
比较温度对反应速率的影响
A、A B、B C、C D、D4. 下列说法不正确的是( )A、非自发的反应一定可以通过改变条件使其成为自发反应 B、相同物质的量的同种物质气态时熵值最大,固态时熵值最小 C、反应 在室温下可自发进行,则该反应的
在室温下可自发进行,则该反应的 D、恒温恒压下,
D、恒温恒压下, 且
且 的反应正向能自发进行
5. 下列依据热化学方程式得出的结论正确的是( )A、已知2SO2(g)+O2(g)⇌2SO3(g) △H<0,则SO2的能量一定高于SO3的能量 B、已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定 C、已知H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ·mol-1 , 则任何酸碱中和反应的热效应均为57.3 kJ D、已知2C(s) +2O2(g) =2 CO2(g) △H1 ;2C(s) +O2(g) =2CO (g) △H2则△H1<△H26. 为达到相应实验目的,下列实验操作可行的是( )
的反应正向能自发进行
5. 下列依据热化学方程式得出的结论正确的是( )A、已知2SO2(g)+O2(g)⇌2SO3(g) △H<0,则SO2的能量一定高于SO3的能量 B、已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定 C、已知H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ·mol-1 , 则任何酸碱中和反应的热效应均为57.3 kJ D、已知2C(s) +2O2(g) =2 CO2(g) △H1 ;2C(s) +O2(g) =2CO (g) △H2则△H1<△H26. 为达到相应实验目的,下列实验操作可行的是( )编号
实验目的
实验操作
A
证明碳酸酸性强于硼酸
向饱和碳酸氢钠溶液中滴加少量的硼酸溶液,无气泡产生
B
证明HClO是弱电解质
用pH试纸测NaClO溶液的pH值
C
除去碱式滴定管内的气泡
将尖嘴垂直向下,挤压胶管内玻璃球将气泡排出
D
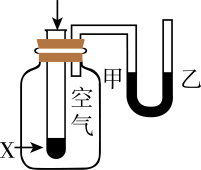
证明Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
向
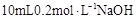 溶液中滴入2滴
溶液中滴入2滴 溶液,产生白色沉淀后,再滴加2滴
溶液,产生白色沉淀后,再滴加2滴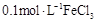 溶液,出现红褐色沉淀A、A B、B C、C D、D7. 下列各组离子在给定溶液中能大量共存的是( )A、在醋酸溶液中:K+、NO
溶液,出现红褐色沉淀A、A B、B C、C D、D7. 下列各组离子在给定溶液中能大量共存的是( )A、在醋酸溶液中:K+、NO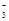 、SO
、SO B、在氯化钠溶液中:I-、Fe3+、HCO
B、在氯化钠溶液中:I-、Fe3+、HCO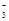 C、在硝酸溶液中:Cl-、Fe2+、SO
C、在硝酸溶液中:Cl-、Fe2+、SO D、 在氨水中:Cu2+、Na+、NO
D、 在氨水中:Cu2+、Na+、NO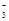 、S2-
8. Ni可活化
、S2-
8. Ni可活化 放出
放出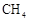 , 其反应历程如图所示。下列说法正确的是( )
, 其反应历程如图所示。下列说法正确的是( )  A、决速步骤:中间体1→中间体2 B、总反应为
A、决速步骤:中间体1→中间体2 B、总反应为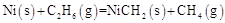
 kJ·mol
kJ·mol C、涉及非极性键的断裂和生成
D、在此反应过程中Ni的成键数目没有发生变化
9. 部分弱酸的电离平衡常数如下表:
C、涉及非极性键的断裂和生成
D、在此反应过程中Ni的成键数目没有发生变化
9. 部分弱酸的电离平衡常数如下表:弱酸

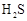
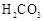

电离平衡常数






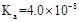
运用上述电离常数及物质的特性判断下列化学方程式不正确的是( )
A、次氯酸与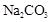 溶液的反应:
溶液的反应: B、碳酸钠滴入足量甲酸溶液中:
B、碳酸钠滴入足量甲酸溶液中: C、少量
C、少量 通入
通入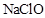 溶液中:
溶液中: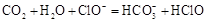 D、硫化氢通入
D、硫化氢通入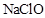 液中:
液中: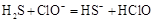 10. 在密闭容器中,反应2X(g)+Y2(g)
10. 在密闭容器中,反应2X(g)+Y2(g)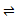 2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是( )
2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是( )  A、图Ⅰ中,甲、乙的平衡常数分别为
A、图Ⅰ中,甲、乙的平衡常数分别为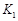 、
、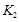 , 则
, 则 B、图Ⅱ中,平衡状态甲与乙的反应物转化率乙>甲
C、图Ⅱ中,t时刻可能是增大了压强
D、图Ⅲ表示反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
11. 实验室中模拟合成氨反应: N2((g)+3H2(g)
B、图Ⅱ中,平衡状态甲与乙的反应物转化率乙>甲
C、图Ⅱ中,t时刻可能是增大了压强
D、图Ⅲ表示反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
11. 实验室中模拟合成氨反应: N2((g)+3H2(g)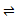 2NH3(g) 在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:
2NH3(g) 在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示: 实验序号
温度(
 )
)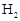 浓度(
浓度( )
)


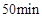

1
300
2.00
1.70
1.50
1.36
1.25
1.20
1.20
2
300
2.00
1.50
1.28
1.20
1.20
1.20
1.20
3
200
2.00
1.60
1.39
1.29
1.27
1.27
1.27
下列有关说法不正确的是( )
A、当容器内的压强不再改变时,说明该可逆反应已达到化学平衡状态 B、实验2中,前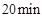 内以
内以 的浓度变化表示的化学反应速率为
的浓度变化表示的化学反应速率为 C、比较实验1和2,说明实验2使用了更高效的催化剂
D、实验3中,
C、比较实验1和2,说明实验2使用了更高效的催化剂
D、实验3中, 时向容器中充入一定量
时向容器中充入一定量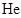 , 则正反应速率
, 则正反应速率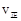 不变
12. 常温时,下列关于电解质溶液的叙述正确的是( )A、稀释pH=10的氨水,电离常数Kb减小 B、pH均为5的盐酸和氯化铵溶液中,水的电离程度相同 C、等浓度的碳酸钠与碳酸氢钠溶液相比,碳酸钠溶液的pH大 D、分别中和pH与体积均相同的硫酸和盐酸,硫酸消耗氢氧化钠的物质的量多13. 下表是
不变
12. 常温时,下列关于电解质溶液的叙述正确的是( )A、稀释pH=10的氨水,电离常数Kb减小 B、pH均为5的盐酸和氯化铵溶液中,水的电离程度相同 C、等浓度的碳酸钠与碳酸氢钠溶液相比,碳酸钠溶液的pH大 D、分别中和pH与体积均相同的硫酸和盐酸,硫酸消耗氢氧化钠的物质的量多13. 下表是 时某些盐的溶度积常数和弱酸的电离平衡常数。下列说法正确的是( )
时某些盐的溶度积常数和弱酸的电离平衡常数。下列说法正确的是( ) 化学式
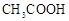
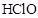


 或
或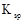



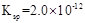 A、常温下同浓度的①
A、常温下同浓度的① 、②
、② 、③
、③ 溶液中,c(NH4+):①>②>③
B、
溶液中,c(NH4+):①>②>③
B、 在盐酸中的
在盐酸中的 大于其在水中的
大于其在水中的 C、向饱和氯水中滴加
C、向饱和氯水中滴加 溶液至溶液刚好呈中性时,c(Na+)=2c(ClO-)+c(HClO)
D、向浓度均为
溶液至溶液刚好呈中性时,c(Na+)=2c(ClO-)+c(HClO)
D、向浓度均为 的
的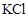 和
和 的混合溶液中滴加稀
的混合溶液中滴加稀 溶液,
溶液, 先形成沉淀
14. 某温度下,向10mL0.01mol/LPbCl2溶液中滴加0.01mol/L的Na2S溶液,滴加过程中lgc(Pb2+)与Na2S溶液体积的关系如图所示,下列有关说法正确的是( )
先形成沉淀
14. 某温度下,向10mL0.01mol/LPbCl2溶液中滴加0.01mol/L的Na2S溶液,滴加过程中lgc(Pb2+)与Na2S溶液体积的关系如图所示,下列有关说法正确的是( )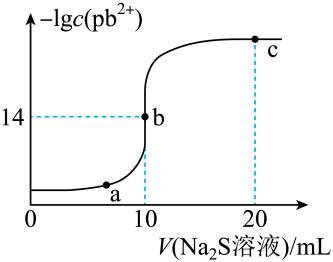
已知:lg2=0.3,Ksp(ZnS)=3×10-25mol2/L2
A、a、b、c三点对应的溶液中,水的电离程度最小的为a点 B、Na2S溶液中:c(Na+)=c(H2S)+2c(S2-)+c(HS-) C、向Zn2+、Pb2+浓度相等的混合溶液中逐滴加入一定浓度的Na2S溶液,Zn2+先沉淀 D、若改用0.005mol/LNa2S溶液,b点应该水平右移15. 微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置。某污水处理厂利用微生物燃料电池处理含铬废水的工作原理如图所示。下列说法错误的是( ) A、电池工作时a极发生氧化反应 B、CH3OH与
A、电池工作时a极发生氧化反应 B、CH3OH与 也可直接反应
C、电池工作一段时间后,右边溶液的酸性增强
D、a极的电极反应式为
也可直接反应
C、电池工作一段时间后,右边溶液的酸性增强
D、a极的电极反应式为 16. 通过甲醇羧基化法获取甲酸甲酯(HCOOCH3):CH3OH(g)+CO(g)
16. 通过甲醇羧基化法获取甲酸甲酯(HCOOCH3):CH3OH(g)+CO(g) HCOOCH3(g),在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图中实线所示(图中虚线表示相同条件下CO的平衡转化率随温度的变化),下列说法不正确的是( )
HCOOCH3(g),在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图中实线所示(图中虚线表示相同条件下CO的平衡转化率随温度的变化),下列说法不正确的是( ) 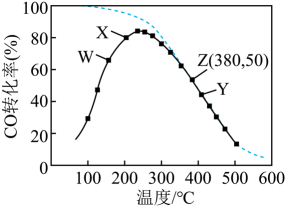 A、此制取甲酸甲酯的反应△H<0 B、图中X点,延长反应时间能提高CO转化率 C、图中W点,升高温度能提高CO转化率 D、380℃下,图中Z点,c起始(CH3OH)=5.0×10-4 mol/L,CO平衡转化率为50%,则平衡常数K(z)=2000
A、此制取甲酸甲酯的反应△H<0 B、图中X点,延长反应时间能提高CO转化率 C、图中W点,升高温度能提高CO转化率 D、380℃下,图中Z点,c起始(CH3OH)=5.0×10-4 mol/L,CO平衡转化率为50%,则平衡常数K(z)=2000二、非选择题
-
17.(1)、下列物质中,属于电解质的是 , 属于强电解质的是 , 属于弱电解质的是(填序号)。
①H2SO4 ②盐酸 ③硫酸钡 ④乙醇 ⑤铜 ⑥H2S ⑦蔗糖 ⑧氨气 ⑨NH4HSO3
(2)、甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,相关反应的热化学方程式及平衡常数如下所示:ⅰ.
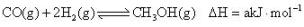 K1
K1ⅱ.
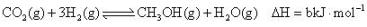 K2
K2ⅲ.
 K3
K3回答下列问题:
①a=(用b、c表示),则K1=(用K2、K3表示)。
②在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2和H2 , 在催化剂的作用下仅发生反应ⅲ.下列叙述能表示该反应达到平衡状态的是(填标号)。
a.容器中混合气体的压强不再改变
b.容器中CO、CO2的物质的量相等
c.容器中气体的密度不再改变
d.相同时间内,断裂H-O的数目是断裂H-H的2倍
(3)、在密闭容器中充入一定量的CO和NO气体,发生反应2CO(g)+2NO(g) ⇌ 2CO2(g)+N2(g)ΔH<0 ,如图为平衡时NO的体积分数与温度、压强的关系:
①温度:T1 T2 (填“>”、“<”或“=”)。
②若在D点对应容器升温,同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的点(填字母)。
18. Na2SO3、 NaHSO3是常见的化工原料,常用作还原剂。(1)、25℃, H2SO3、 HSO 、SO
、SO 的物质的量分数[]与pH的关系如下图所示。
的物质的量分数[]与pH的关系如下图所示。

①若向NaOH溶液中通入SO2制取NaHSO3溶液,则当溶液的pH为 时应停止通入。
②向NaOH溶液中通入SO2 , 所得溶液中一定存在的等式是 (用溶液中所含微粒的物质的量浓度表示)。
③NaHSO3溶液的酸碱性: 。
④若测得25℃时,某溶液中c(SO32-)/c(H2SO3)=10,则溶液的pH为。
(2)、Na2SO3固体久置后会被氧化,为测定某久置Na2SO3固体中Na2SO3的含量,现进行如下实验:称取0.3000 g该固体于锥形瓶中,加水溶解后,边振荡边向其中滴加0.1000mol·L-1I2标准溶液28 mL,充分反应后,向溶液中滴加2滴淀粉溶液作指示剂,继续滴加0.1000 mol·L-1Na2S2O3标准溶液与过量的I2反应(发生反应I2+ 2Na2S2O3=2NaI+ Na2S4O6),恰好完全反应时消耗Na2S2O3标准溶液16 mL。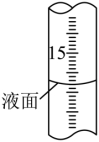
① 如何判断滴定终点:。
②滴定过程中,滴定管液面如图所示,此时滴定管的读数为 mL。
③计算久置Na2SO3固体中Na2SO3的质量分数为
④ 下列情况会造成样品中Na2SO3含量测定结果偏低的是 (填序号)。
A.滴定过程中用蒸馏水冲洗锥形瓶瓶壁
B.装Na2S2O3标准溶液的滴定管水洗后未润洗
C.开始滴定时,滴定管尖嘴部分未充满液体
D.滴定前仰视读数,滴定后俯视读数