九年级上册科学期末复习:物质的分类与转化
试卷更新日期:2022-12-18 类型:复习试卷
一、单选题
-
1. 中国科学院首创室温制氢方案,其反应原理如图所示。下列说法错误的是( )
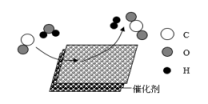 A、该反应的化学方程式是 B、该反应前后分子数目不变 C、该反应属于置换反应 D、反应物CO和都是氧化物2. 在化学反应 3S+6NaOH=2Na2S+Na2SO3+3H2O中,没有涉及到的物质类别是 ( )A、酸 B、碱 C、盐 D、氧化物3. 用“
A、该反应的化学方程式是 B、该反应前后分子数目不变 C、该反应属于置换反应 D、反应物CO和都是氧化物2. 在化学反应 3S+6NaOH=2Na2S+Na2SO3+3H2O中,没有涉及到的物质类别是 ( )A、酸 B、碱 C、盐 D、氧化物3. 用“ ”和“
”和“ ”表示不同元素的原子,下列微观示意图能表示化合物的是( ) A、
”表示不同元素的原子,下列微观示意图能表示化合物的是( ) A、 B、
B、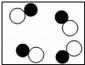 C、
C、 D、
D、 4. 下列物质的转变,不能一步实现的是( )A、KCl→KNO3 B、AgNO3→Fe(NO3)2 C、SO2→Na2SO4 D、H2→Cu5. 在给定条件下,下列选项所示的物质间转化不能实现的是( )A、CCO2CO B、SSO2H2SO3 C、CuCuSO4溶液Cu(OH)2 D、NaOH溶液Na2CO3溶液NaCl溶液6. 如图为物质的转化关系,其中“→”表示某种物质可一步反应生成另一种物质,则下列各组物质按照甲、乙、丙的顺序符合对应“转化关系”的是( )
4. 下列物质的转变,不能一步实现的是( )A、KCl→KNO3 B、AgNO3→Fe(NO3)2 C、SO2→Na2SO4 D、H2→Cu5. 在给定条件下,下列选项所示的物质间转化不能实现的是( )A、CCO2CO B、SSO2H2SO3 C、CuCuSO4溶液Cu(OH)2 D、NaOH溶液Na2CO3溶液NaCl溶液6. 如图为物质的转化关系,其中“→”表示某种物质可一步反应生成另一种物质,则下列各组物质按照甲、乙、丙的顺序符合对应“转化关系”的是( ) A、C、CO、H2CO3 B、Zn、Cu、Ag C、CuO、Cu、Cu(NO3)2 D、NaOH、NaCl、NaNO37. 下列物质间的转化,只需通过一步反应就能实现的是( )A、CaCO3→Ca(OH)2 B、Fe→FeCl3 C、Na2SO4→NaCl D、CuO→Cu(OH)28. 下列表中各物质不能按照图中关系(“→”表示反应一步完成)转化的是( )
A、C、CO、H2CO3 B、Zn、Cu、Ag C、CuO、Cu、Cu(NO3)2 D、NaOH、NaCl、NaNO37. 下列物质间的转化,只需通过一步反应就能实现的是( )A、CaCO3→Ca(OH)2 B、Fe→FeCl3 C、Na2SO4→NaCl D、CuO→Cu(OH)28. 下列表中各物质不能按照图中关系(“→”表示反应一步完成)转化的是( ) A、Na2SO4 , NaCl,NaNO3 B、BaCl2 , Ba(NO3)2 , BaCO3 C、Cu,CuO,CuSO4 D、CaO,CaCl2 , CaCO39. 下列物质间的转化,通过一步化学反应不能实现的是( )A、Cu(OH)2→CuCl2 B、H2SO4→HCl C、NaNO3→Na2CO3 D、CaCl2→CaCO310. 一定条件下,下列物质的转化均可一步实现的是( )A、Fe→Fe2O3→FeSO4 B、Fe→FeSO4→CuSO4 C、NaNO3→NaOH→Na2CO3 D、Ca(OH)2→CaCO3→CaCl211. 如图所示,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列说法错误的是( )
A、Na2SO4 , NaCl,NaNO3 B、BaCl2 , Ba(NO3)2 , BaCO3 C、Cu,CuO,CuSO4 D、CaO,CaCl2 , CaCO39. 下列物质间的转化,通过一步化学反应不能实现的是( )A、Cu(OH)2→CuCl2 B、H2SO4→HCl C、NaNO3→Na2CO3 D、CaCl2→CaCO310. 一定条件下,下列物质的转化均可一步实现的是( )A、Fe→Fe2O3→FeSO4 B、Fe→FeSO4→CuSO4 C、NaNO3→NaOH→Na2CO3 D、Ca(OH)2→CaCO3→CaCl211. 如图所示,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列说法错误的是( ) A、反应条件都需要加热 B、通过气体之前,都需要检验纯度 C、制铜时,实际消耗的CO、H2都比理论消耗的要多 D、实验中氢气和一氧化碳具有氧化性12. 下列事实与相应化学方程式书写均正确的是( )A、鉴别稀硫酸和稀盐酸一般可用AgNO3溶液:AgNO3+HCl=AgCl↓+HNO3 B、金属铝的表面易生成一层致密的保护膜:4Al+3O2=2Al2O3 C、工业炼铁常采用CO作为还原剂:Fe2O3+3CO2Fe+3CO2 D、使用Ca(OH)2治疗胃酸过多症:Ca(OH)2+2HCl=CaCl2+2H2O13. 小乐利用如图所示装置和药品进行实验。实验时,先加热炭粉,一段时间后,将酒精喷灯移至 CuO 处加热,最终CuO 变为紫红色固体。下列分析错误的是( )
A、反应条件都需要加热 B、通过气体之前,都需要检验纯度 C、制铜时,实际消耗的CO、H2都比理论消耗的要多 D、实验中氢气和一氧化碳具有氧化性12. 下列事实与相应化学方程式书写均正确的是( )A、鉴别稀硫酸和稀盐酸一般可用AgNO3溶液:AgNO3+HCl=AgCl↓+HNO3 B、金属铝的表面易生成一层致密的保护膜:4Al+3O2=2Al2O3 C、工业炼铁常采用CO作为还原剂:Fe2O3+3CO2Fe+3CO2 D、使用Ca(OH)2治疗胃酸过多症:Ca(OH)2+2HCl=CaCl2+2H2O13. 小乐利用如图所示装置和药品进行实验。实验时,先加热炭粉,一段时间后,将酒精喷灯移至 CuO 处加热,最终CuO 变为紫红色固体。下列分析错误的是( ) A、装置中气球的作用:收集尾气、防止污染空气 B、反应过程中,CuO变为Cu C、反应过程中,体现出炭粉具有还原性 高温 D、装置中发生的反应:C+2CuO=2Cu+CO2↑14. 用一种试剂就能把NaCl、NH4Cl、Na2SO4三种溶液区别开,这种试剂是( )A、AgNO3溶液 B、NaOH溶液 C、Ba(OH)2溶液 D、BaCl2溶液15. 现有铁、氧化铁、稀硫酸、氢氧化钙溶液、碳酸钠溶液等五种物质,存在着如图所示的相互反应或转化关系(图中“-”表示物质间可以发生化学友应,“→”表示物质间存在相应的转化关系)。下列判断合理的是( )
A、装置中气球的作用:收集尾气、防止污染空气 B、反应过程中,CuO变为Cu C、反应过程中,体现出炭粉具有还原性 高温 D、装置中发生的反应:C+2CuO=2Cu+CO2↑14. 用一种试剂就能把NaCl、NH4Cl、Na2SO4三种溶液区别开,这种试剂是( )A、AgNO3溶液 B、NaOH溶液 C、Ba(OH)2溶液 D、BaCl2溶液15. 现有铁、氧化铁、稀硫酸、氢氧化钙溶液、碳酸钠溶液等五种物质,存在着如图所示的相互反应或转化关系(图中“-”表示物质间可以发生化学友应,“→”表示物质间存在相应的转化关系)。下列判断合理的是( ) A、丙可能是碳酸钠溶液 B、丁可能是氢氧化钙溶液 C、乙必须通过置换反应转化为铁 D、甲和丁的反应一定是中和反应
A、丙可能是碳酸钠溶液 B、丁可能是氢氧化钙溶液 C、乙必须通过置换反应转化为铁 D、甲和丁的反应一定是中和反应二、填空题
-
16. 将以下物质按要求选择填写(填序号):
a.加碘盐;b.冰水混合物;c.硫磺;d.硫酸铝钾晶体[KAl(SO4)2·12H2O];e.KClO3;
f.钢; g.稀硫酸 h.金刚石
混合物 单质
17. 现有①液氧②洁净的食盐水③铁粉④二氧化碳⑤冰水混合物⑥液态空气等六种物质,其中属于混合物的是(填序号下同);属于氧化物的是;含氧分子的有。18. 怎样才能让月球拥有大气层呢?科学家们分析月壤后发现,其主要成分包括SiO2、Al2O3、Fe2O3等。有人设计如图方案,给月球制造大气。 (1)、电解器中,石墨用作反应物的同时,还充当电极,这是利用了它的 (填一种物理性质);(2)、以Al2O3为例,若电解中生成的两种气体(分子数为1:1)和一种金属单质(如图),则反应的化学方程式为 。19. 小科在下五子棋时受到启发,设计了一款“物质推断"版的五子棋,游戏规则为:在同一条直线上的相邻物质之间能够发生化学反应(如右图)。现假设这五种物质分别是盐酸、氢氧化钡、碳酸钠、二氧化碳和金属铁,请回答下列问题:
(1)、电解器中,石墨用作反应物的同时,还充当电极,这是利用了它的 (填一种物理性质);(2)、以Al2O3为例,若电解中生成的两种气体(分子数为1:1)和一种金属单质(如图),则反应的化学方程式为 。19. 小科在下五子棋时受到启发,设计了一款“物质推断"版的五子棋,游戏规则为:在同一条直线上的相邻物质之间能够发生化学反应(如右图)。现假设这五种物质分别是盐酸、氢氧化钡、碳酸钠、二氧化碳和金属铁,请回答下列问题: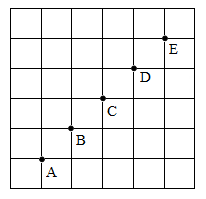 (1)、写出上述物质中发生置换反应的化学方程式:。(2)、C处的物质是 (写化学式) 。20. 在盐酸中加入过量的某种金属粉末,反应的微观模型如图所示,图中圆圈表示该反应前后溶液中存在的主要离子。
(1)、写出上述物质中发生置换反应的化学方程式:。(2)、C处的物质是 (写化学式) 。20. 在盐酸中加入过量的某种金属粉末,反应的微观模型如图所示,图中圆圈表示该反应前后溶液中存在的主要离子。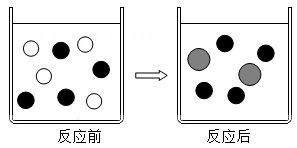 (1)、该金属粉末可能是 。A、Cu B、Mg C、Al D、Na(2)、图中“
(1)、该金属粉末可能是 。A、Cu B、Mg C、Al D、Na(2)、图中“ ”所代表的离子是(填离子符号)。 21. 碳捕捉技术”是通过一定的方法,将工业生产中产生的二氧化碳分离出来并加以利用.某校科研小组的同学设计用氢氧化钠溶液来“捕捉”二氧化碳,其基本过程如下(部分条件及物质未标出)。
”所代表的离子是(填离子符号)。 21. 碳捕捉技术”是通过一定的方法,将工业生产中产生的二氧化碳分离出来并加以利用.某校科研小组的同学设计用氢氧化钠溶液来“捕捉”二氧化碳,其基本过程如下(部分条件及物质未标出)。
请回答下列有关问题:
(1)、“捕捉室”中发生反应的化学方程式为:。(2)、在整个“捕捉”过程中,可以循环利用的物质是。22. 小政同学在复习Ca(OH)2的化学性质时,归纳出了Ca(OH)2与其他物质间相互反应的关系如图(图中“——”表示相连的两种物质能发生反应)。 (1)、若X是与其他三种不同类别的化合物,则X可以是。(写化学式)(2)、根据圈中所示的物质问的关系,写出其中两个化学方程式:
(1)、若X是与其他三种不同类别的化合物,则X可以是。(写化学式)(2)、根据圈中所示的物质问的关系,写出其中两个化学方程式:①;
②。
23. 如图是某科学老师设计的一氧化碳还原氧化铁的实验装置。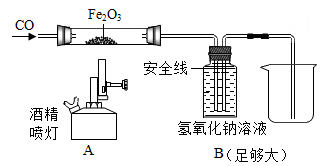 (1)、实验时先通CO,在B装置的液面下降到安全线之前,不能加热氧化铁,这是因为。(2)、反应结束后停止加热,继续通CO,此时B装置的作用是。24. 用氢气还原氧化铜的方法测定某氧化铜样品的纯度(样品中的杂质不与氢气反应),灵灵和溪溪设计并组装了如图所示实验装置(装置气密性良好):
(1)、实验时先通CO,在B装置的液面下降到安全线之前,不能加热氧化铁,这是因为。(2)、反应结束后停止加热,继续通CO,此时B装置的作用是。24. 用氢气还原氧化铜的方法测定某氧化铜样品的纯度(样品中的杂质不与氢气反应),灵灵和溪溪设计并组装了如图所示实验装置(装置气密性良好):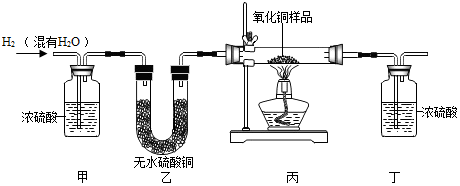 (1)、实验中,装置甲的作用是。(2)、实验中,装置乙的作用是。(3)、实验过程中,氧化铜变红色,说明了氢气具有性。25. 一包白色粉末,由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的两种或两种以上的物质混合而成。为探究其组成,进行如下实验:
(1)、实验中,装置甲的作用是。(2)、实验中,装置乙的作用是。(3)、实验过程中,氧化铜变红色,说明了氢气具有性。25. 一包白色粉末,由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的两种或两种以上的物质混合而成。为探究其组成,进行如下实验:⑴取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液。
⑵取实验⑴滤出的白色沉淀,向其中加入足量的盐酸,沉淀全部溶解,并产生无色气体。则原白色 粉末中一定含有。
CaCO3 ⑶为了进一步探究白色粉末的组成,取是按 (1)得到的滤液,向其中通入CO2 , 产生白色沉淀,则原白色粉末中一定还含有。26. 小科设计了一个“物语”信封,信封上五个点代表不同的化学物质,“——”表示两只物质之间可以相互反应。已知A˜E分别是铁、氢氧化钙、盐酸、碳酸钠、硫酸铜中的一种。E的溶液呈蓝色,A、B反应能产生气泡。
 (1)、E物质的化学式为(2)、写出A与C反应的化学方程式;
(1)、E物质的化学式为(2)、写出A与C反应的化学方程式;该反应的基本类型属于。
三、实验探究题
-
27. 如图是湛江××药厂生产的一种抗酸药(治疗胃酸过多的药物)的说明书的部分内容.阅读后回答下列问题.
 (1)、碳酸镁属于酸、碱、盐、氧化物中的。(2)、为了验证该药物的主要成分是碳酸盐,小军进行了如下实验:首先将药片放入试管中,向其中加入适 量的稀盐酸,观察到有气泡产生,然后将产生的气体通入 , 看到的现象是。(3)、写出该药物治疗胃酸过多的化学方程式。28. 用黄铜矿废液[溶质成分为Fe2(SO4)3、CuSO4及H2SO4]为原料,制备氢氧化铁并回收铜的生成流程如图,已知:Fe2(SO4)3+Fe=3FeSO4。
(1)、碳酸镁属于酸、碱、盐、氧化物中的。(2)、为了验证该药物的主要成分是碳酸盐,小军进行了如下实验:首先将药片放入试管中,向其中加入适 量的稀盐酸,观察到有气泡产生,然后将产生的气体通入 , 看到的现象是。(3)、写出该药物治疗胃酸过多的化学方程式。28. 用黄铜矿废液[溶质成分为Fe2(SO4)3、CuSO4及H2SO4]为原料,制备氢氧化铁并回收铜的生成流程如图,已知:Fe2(SO4)3+Fe=3FeSO4。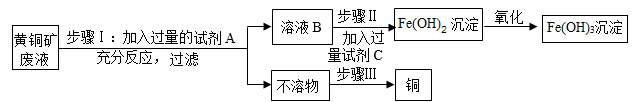 (1)、步骤Ⅰ中,加入过量A的目的是;反应过程中观察到的现象之一是有气泡产生,写出该反应的化学方程式。(2)、步骤Ⅱ中,试剂C的化学式可能为。(3)、步骤Ⅲ中,用化学方法回收铜的操作步骤为:加入过量的、过滤、、干燥。(4)、在生产流程中,能说明铁的活动性比铜强的是步骤(选填“Ⅰ”、“Ⅱ”或“Ⅲ”)。29. 利用工业碳酸钙(含少量铁、铝、钠等元素的金属矿物杂质)生产医用二水合氯化钙(CaCl2•2H2O),工艺流程如图所示。回答问题:
(1)、步骤Ⅰ中,加入过量A的目的是;反应过程中观察到的现象之一是有气泡产生,写出该反应的化学方程式。(2)、步骤Ⅱ中,试剂C的化学式可能为。(3)、步骤Ⅲ中,用化学方法回收铜的操作步骤为:加入过量的、过滤、、干燥。(4)、在生产流程中,能说明铁的活动性比铜强的是步骤(选填“Ⅰ”、“Ⅱ”或“Ⅲ”)。29. 利用工业碳酸钙(含少量铁、铝、钠等元素的金属矿物杂质)生产医用二水合氯化钙(CaCl2•2H2O),工艺流程如图所示。回答问题:
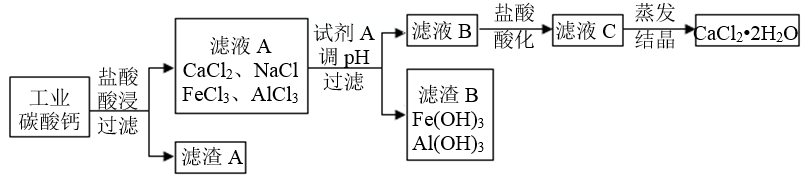 (1)、为了提高“盐酸酸浸”的效果可采取的措施有:适当升高温度、(写出1条)。(2)、写出碳酸钙与盐酸反应的化学方程式。(3)、试剂A的化学式为 , 已知部分氢氧化物形成沉淀和沉淀溶解时溶液的pH如表所示,则加入试剂A调节溶液的pH,其合理范围为 , 以便能除去溶液中的Al3+、Fe3+。
(1)、为了提高“盐酸酸浸”的效果可采取的措施有:适当升高温度、(写出1条)。(2)、写出碳酸钙与盐酸反应的化学方程式。(3)、试剂A的化学式为 , 已知部分氢氧化物形成沉淀和沉淀溶解时溶液的pH如表所示,则加入试剂A调节溶液的pH,其合理范围为 , 以便能除去溶液中的Al3+、Fe3+。氢氧化物
Fe(OH)3
Al(OH)3
Al(OH)3
开始沉淀时的pH
2.3
4.0
开始溶解时的pH
7.8
完全沉淀时的pH
3.7
5.2
完全溶解时的pH
10.8
30. 已知某气体可能是氢气或一氧化碳气体,或者是氢气和一氧化碳的混合物。为验证该气体的成分,小科设计了下图所示的实验,实验中小科观察到玻璃管中黑色固体变红,澄清石灰水变浑浊的现象。请回答下列问题: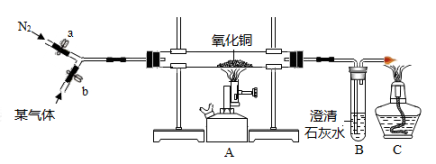 (1)、实验开始时,应先打开(选填“a”或“b”)通气体;(2)、根据装置中出现的实验现象,还无法确定气体的成分,还需要添加一组实验装置,请你写出该装置的位置和所需的药品。(3)、小科实验中若要对尾气中的可燃性气体进行回收再利用,C处酒精灯可换下列装置最为合理。
(1)、实验开始时,应先打开(选填“a”或“b”)通气体;(2)、根据装置中出现的实验现象,还无法确定气体的成分,还需要添加一组实验装置,请你写出该装置的位置和所需的药品。(3)、小科实验中若要对尾气中的可燃性气体进行回收再利用,C处酒精灯可换下列装置最为合理。 31. 已知某混合气体由H2、CO和CO2、SO2中的几种气体组成。为验证该混合气体成分,科学研究小组的同学经过讨论,设计了如图1所示的实验方案。请回答:
31. 已知某混合气体由H2、CO和CO2、SO2中的几种气体组成。为验证该混合气体成分,科学研究小组的同学经过讨论,设计了如图1所示的实验方案。请回答:【查阅资料】①SO2 能使品红溶液褪色;②SO2 易与高锰酸钾溶液反应而被吸收,并能使其褪色;③SO2 能使氢氧化钡溶液和澄清石灰水变浑浊;④CO和CO2均不能使品红溶液褪色,也不与高锰酸钾溶液反应。
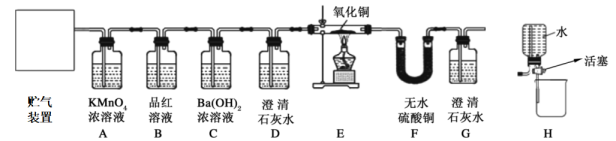
【实验分析】
(1)、装置C在实验中的作用是。(2)、能证明有CO的现象是。(3)、【反思与评价】若装置按照D→A→B→D→E→F→G连接,并观察到以下现象
装置
D
A
B
D
E
F
G
现象
变浑浊
褪色
无现象
变浑浊
变红
变蓝
变浑浊
由现象可以确定一定存在的气体有。
(4)、小王同学认为需要在G之后再连接一个装置H,则装置H的作用是。四、解答题
-
32. 山的伟岸、石的气势、水的灵韵、林的秀色,构成了桐庐山水洞天色彩斑斓的景致与诗画般的意境。请回答下列问题:(1)、登雄伟的大奇山,人消耗能量主要来源于食物的(填一种形式能量名称);(2)、瑶琳洞内有奇形怪状的钟乳石,奇形怪状的石形成原因之一是碳酸钙与水、二氧化碳反应生成碳酸氢钙,该反应基本类型为 , 碳酸氢钙中碳元素化合价为;(3)、富春江的水孕育桐庐人民,富春江中水属于(填“单质”、“氧化物”、“有机物”或“混合物”),未来氢能源氢气可由水在新型催化剂作用下分解得到,电解18g水生成氢气质量为g;(4)、秀丽的森林离不开土壤中无机盐提供的养分,如硝酸铵,硝酸铵中氮元素质量分数为。33. 含硫的物质在实验室或工业生产过程中可出现下列图示的转化:
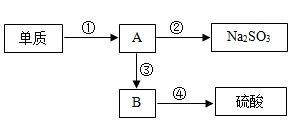 (1)、实验室中,点燃少量单质硫于充满氧气的集气瓶中燃烧,产生漂亮的蓝紫色火焰,生成物质A.A是工业排放物中一种主要的空气污染物,也是酸雨形成的主因之一.根据你学过的知识可将A转化成Na2SO3 , 你提供的试剂是 .(2)、在硫酸工业中,将A在一定条件下与空气中的物质反应得到B,B与水结合得到硫酸.B与A的组成元素相同,B中硫元素与硫酸中硫元素化合价相同,写出A转化成B的化学方程式: .(3)、上述物质转化过程中,属于化合反应的是(填序号).(4)、若回收工业排放物A 32吨,理论上可生产硫酸 吨.34. 某矿石由MgO、Fe2O3和SiO2组成其制备氢氧化镁的流程示意图如图:
(1)、实验室中,点燃少量单质硫于充满氧气的集气瓶中燃烧,产生漂亮的蓝紫色火焰,生成物质A.A是工业排放物中一种主要的空气污染物,也是酸雨形成的主因之一.根据你学过的知识可将A转化成Na2SO3 , 你提供的试剂是 .(2)、在硫酸工业中,将A在一定条件下与空气中的物质反应得到B,B与水结合得到硫酸.B与A的组成元素相同,B中硫元素与硫酸中硫元素化合价相同,写出A转化成B的化学方程式: .(3)、上述物质转化过程中,属于化合反应的是(填序号).(4)、若回收工业排放物A 32吨,理论上可生产硫酸 吨.34. 某矿石由MgO、Fe2O3和SiO2组成其制备氢氧化镁的流程示意图如图:
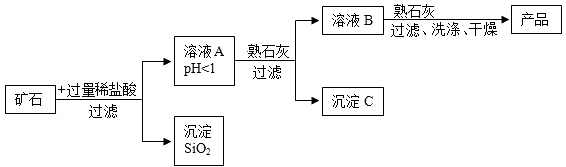 (1)、加入稀盐酸反应后,能采用过滤方法分离A与SiO2的原因是。(2)、在溶液A中加入熟石灰固体调节溶液的.pH,可以使溶液中的阳离子转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。现调节溶液B的pH值范围是4- 8,目的是 。
(1)、加入稀盐酸反应后,能采用过滤方法分离A与SiO2的原因是。(2)、在溶液A中加入熟石灰固体调节溶液的.pH,可以使溶液中的阳离子转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。现调节溶液B的pH值范围是4- 8,目的是 。氢氧化物
Fe(OH)3
Mg(OH)2
开始沉淀的 pH
1.5
8.6
完全沉淀的 pH
3.2
11.1
(3)、该实验过程中,熟石灰固体比氢氧化钠固体能更精确地调节溶液的pH,理由是。35. 为测定某赤铁矿石中氧化铁的质量分数,小乐用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的6.6g的气体用碱溶液完全吸收。回答下列问题:(1)、10g赤铁矿石样品与一氧化碳反应生成的气体是。(2)、上述气体用碱溶液吸收,选取的碱溶液可以是溶液。(3)、该赤铁矿石样品中氧化铁的质量分数?36. 有一包白色固体,可能由BaCl2、NaOH、Na2CO3、Na2SO4 , 中的一种或几种组成。为确定其成分,实验小组进行试验。实验过程中所加试剂均足量,实验过程及现象如图所示。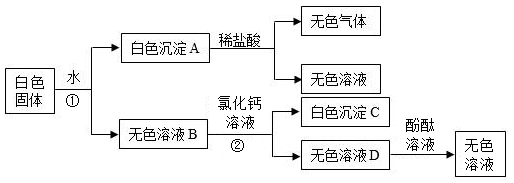 (1)、①和②的实验操作名称;(2)、无色气体产生的化学方程式是;(3)、这包白色固体中不含有的物质是。
(1)、①和②的实验操作名称;(2)、无色气体产生的化学方程式是;(3)、这包白色固体中不含有的物质是。