九年级上册科学期末复习:酸
试卷更新日期:2022-12-18 类型:复习试卷
一、单选题
-
1. 硫酸是一种常见的酸,下列不属于浓硫酸性质的是( )A、挥发性 B、脱水性 C、腐蚀性 D、吸水性2. 实验室存放石灰水的试剂瓶内壁,常附着一层白色固体,能除去它的最佳试剂是 ( )A、水 B、稀盐酸 C、食盐水 D、75%的酒精溶液3. 下列关于硫酸的说法错误的是( )A、浓硫酸具有吸水性 B、能够使无色酚酞溶液变红色 C、稀硫酸可用于金属除锈 D、稀硫酸能够与活泼金属反应4. 学习化学,化学实验现象十分重要,对下面实验现象的描述中,正确的是( )A、紫色石蕊滴入碳酸钠(Na2CO3)溶液中,溶液仍为紫色 B、打开浓硫酸的试剂瓶塞,瓶口出现大量的白雾 C、将铁锈放入少量的稀盐酸中,逐渐被溶解,溶液呈现黄色 D、氢氧化钠溶液滴入氯化铜溶液中,有红褐色沉淀生成5. 将浓盐酸、浓硫酸分别敞口放置一段时间,它们共同的变化是( )A、瓶口出现白雾 B、溶剂质量变大 C、溶液质量变大 D、溶质的质量分数变小6. 下列有关实验现象的描述中,正确的是( )A、氢氧化钠固体溶于水放出热量 B、打开浓硫酸试剂瓶的瓶盖,瓶口出现白雾 C、硫在氧气中燃烧,发出淡蓝色火焰,放出大量的热 D、向稀盐酸中滴加酚酞溶液,溶液由无色变为红色7. 浓硫酸具有较强的吸水性,但教材上没有设计实验证明,小明同学想利用如下实验装置验证浓硫酸的吸水性。实验过程中向长颈漏斗中缓缓注入水,观察C装置两侧导管中无水硫酸铜颜色的变化。(装置气密性良好,无水硫酸铜两端塞入疏松的玻璃纤维,以免实验过程中粉末被气流吹出)。以下分析不合理的是( )
 A、可以用注射器代替 A 装置中的长颈漏斗 B、装置 B 是为了增加进空气中的水蒸气 C、预期将观察到只有右侧无水硫酸铜变蓝 D、装置 D 是为了吸收空气中的水蒸气8. 如图所示,天平恰好处于水平平稳,经过一段时间后,杠杆将( )
A、可以用注射器代替 A 装置中的长颈漏斗 B、装置 B 是为了增加进空气中的水蒸气 C、预期将观察到只有右侧无水硫酸铜变蓝 D、装置 D 是为了吸收空气中的水蒸气8. 如图所示,天平恰好处于水平平稳,经过一段时间后,杠杆将( ) A、杠杆左端上升,右端下降 B、杠杆右端上升,左端下降 C、杠杆还是处于水平平稳 D、无法判断9. 下列实验操作中正确的是( )A、配置NaOH溶液
A、杠杆左端上升,右端下降 B、杠杆右端上升,左端下降 C、杠杆还是处于水平平稳 D、无法判断9. 下列实验操作中正确的是( )A、配置NaOH溶液 B、稀释浓硫酸
B、稀释浓硫酸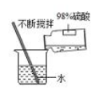 C、称量氢氧化钠固体
C、称量氢氧化钠固体 D、测定土壤溶液酸碱性
D、测定土壤溶液酸碱性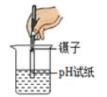 10. 用下图所示的密闭实验装置,能够使气球膨胀,过一段时间又恢复到原状的一组固体和液体是( )
10. 用下图所示的密闭实验装置,能够使气球膨胀,过一段时间又恢复到原状的一组固体和液体是( ) A、固体:硝酸铵;液体:水 B、固体:生石灰;液体:水 C、固体:碳酸钠;液体:稀盐酸 D、固体:氯化钠;液体:水11. 小陈在完成如图氢氧化钠与稀硫酸的反应的实验后, 想判断加入的稀硫酸是否过量,他取出部分反应后的液体, 利用下列方法进行判断,不可取的是 ( )
A、固体:硝酸铵;液体:水 B、固体:生石灰;液体:水 C、固体:碳酸钠;液体:稀盐酸 D、固体:氯化钠;液体:水11. 小陈在完成如图氢氧化钠与稀硫酸的反应的实验后, 想判断加入的稀硫酸是否过量,他取出部分反应后的液体, 利用下列方法进行判断,不可取的是 ( )
 A、加入镁条, 是否有气体生成 B、逐滴加入氯化钡溶液,是否有白色沉淀生成 C、加入少量氢氧化镁,白色固体是否消失 D、利用pH试纸测定,结果是否小于 712. 课外实验具有趣味性、实践性等特点。鸡蛋壳成分的探究过程如图,其中正确的是( )
A、加入镁条, 是否有气体生成 B、逐滴加入氯化钡溶液,是否有白色沉淀生成 C、加入少量氢氧化镁,白色固体是否消失 D、利用pH试纸测定,结果是否小于 712. 课外实验具有趣味性、实践性等特点。鸡蛋壳成分的探究过程如图,其中正确的是( ) A、实验①证明蛋壳成分是CaCO3 B、实验②可证明蛋壳中含钙元素 C、实验③得到的固体能与水反应 D、实验中每步操作都是规范的13. 小科查阅资料后知道柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出H+ , 从而呈现酸性,主要用于制造香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )A、Mg B、Fe2O3 C、CO2 D、Fe14. 小科观看微信公众号“胜哥课程”中的科学视频《神奇的酸》后对几种常见的酸有了深刻的认识。那么,实验室的浓硫酸、浓盐酸敞口放置一段时间后,下例图像描述正确的是( )A、
A、实验①证明蛋壳成分是CaCO3 B、实验②可证明蛋壳中含钙元素 C、实验③得到的固体能与水反应 D、实验中每步操作都是规范的13. 小科查阅资料后知道柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出H+ , 从而呈现酸性,主要用于制造香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )A、Mg B、Fe2O3 C、CO2 D、Fe14. 小科观看微信公众号“胜哥课程”中的科学视频《神奇的酸》后对几种常见的酸有了深刻的认识。那么,实验室的浓硫酸、浓盐酸敞口放置一段时间后,下例图像描述正确的是( )A、 B、
B、 C、
C、 D、
D、 15. 如图所示的四个图像,能正确反映对应变化关系的是( )A、
15. 如图所示的四个图像,能正确反映对应变化关系的是( )A、 向质量均为M克的锌粉和铁粉中分别滴加100克质量分数相同的稀硫酸
B、
向质量均为M克的锌粉和铁粉中分别滴加100克质量分数相同的稀硫酸
B、 一定量的氢氧化钠溶液中,通入二氧化碳,至恰好完全反应
C、
一定量的氢氧化钠溶液中,通入二氧化碳,至恰好完全反应
C、 一定量的稀盐酸中,滴加硝酸银溶液至过量
D、
一定量的稀盐酸中,滴加硝酸银溶液至过量
D、 一瓶浓盐酸和一瓶浓硫酸,在实验室中敞口放置一定时间
16. 下列图像能正确反映对应变化关系的是( )A、
一瓶浓盐酸和一瓶浓硫酸,在实验室中敞口放置一定时间
16. 下列图像能正确反映对应变化关系的是( )A、 室温下,相同质量的锌和铁分别与足量的溶质质分数相同的稀硫酸反应
B、
室温下,相同质量的锌和铁分别与足量的溶质质分数相同的稀硫酸反应
B、 向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
C、
向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
C、 一定温度时,向一定量的饱和石灰水中加入生石灰
D、
一定温度时,向一定量的饱和石灰水中加入生石灰
D、 向一定量的NaOH和Ba(NO3)2溶液中逐滴加入稀H2SO4
向一定量的NaOH和Ba(NO3)2溶液中逐滴加入稀H2SO4
二、填空题
-
17. 生活中处处有化学,请从下列物质中选择填空(填序号)。
①肥皂水 ②活性炭 ③食醋 ④甲烷
(1)、可用于除去冰箱异味的是。(2)、家用天然气的主要成分是。(3)、家里的水壶常有一层水垢,可用除去。18. 盐酸和硫酸是两种重要的酸。(1)、浓硫酸使木棒或棉花变黑,体现了浓硫酸的(选填“吸水性”、“脱水性”或“腐蚀性”)。(2)、如图为实验室稀释浓硫酸的操作示意图,其中烧杯中的液体A是。(选填“浓硫酸”或“水”) (3)、打开浓盐酸试剂瓶的瓶盖,瓶口出现白雾,这是因为浓盐酸具有性。19. 如图是某学生设计的一种有洗气、检验、贮气等用途的装置。若用此装置采用排水法收集氧气,可将集气瓶中装满水,氧气应从导管的端通入。若用此装置除去氧气中混有的水蒸气时,混合气体应从(填“A”或“B”)处导管进入,瓶中盛有的液体可能是。
(3)、打开浓盐酸试剂瓶的瓶盖,瓶口出现白雾,这是因为浓盐酸具有性。19. 如图是某学生设计的一种有洗气、检验、贮气等用途的装置。若用此装置采用排水法收集氧气,可将集气瓶中装满水,氧气应从导管的端通入。若用此装置除去氧气中混有的水蒸气时,混合气体应从(填“A”或“B”)处导管进入,瓶中盛有的液体可能是。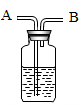 20. 如图是小科构建的硫酸部分知识网络,其中“—”表示相连物质能发生化学反应。
20. 如图是小科构建的硫酸部分知识网络,其中“—”表示相连物质能发生化学反应。 (1)、石蕊试液在H2SO4溶液中显红色,该溶液中能使石蕊试液变红的离子是。(2)、在实验室中常用浓硫酸做干燥剂,这是利用它的。(3)、硫酸与4种物质发生的化学反应中,没有体现酸的通性的方程式是:。21. 硫酸是一种常见的酸,完成下列问题。
(1)、石蕊试液在H2SO4溶液中显红色,该溶液中能使石蕊试液变红的离子是。(2)、在实验室中常用浓硫酸做干燥剂,这是利用它的。(3)、硫酸与4种物质发生的化学反应中,没有体现酸的通性的方程式是:。21. 硫酸是一种常见的酸,完成下列问题。
 (1)、实验室浓硫酸稀释的方法是。(2)、为研究稀硫酸的化学性质,某同学进行了如下实验。
(1)、实验室浓硫酸稀释的方法是。(2)、为研究稀硫酸的化学性质,某同学进行了如下实验。实验中,溶液有颜色变化的是(填序号)。
22. 浓H2SO4稀释时,要让沿着烧杯壁缓缓倒入烧杯里的已有液体中,否则将会使液滴飞溅,造成危险。浓硫酸可以干燥H2或O2 , 是由于它有性。23. 硫酸和盐酸是实验室常用的试剂,也是重要的化工原料,它们都能除铁锈,将带锈迹的铁钉放入过量的盐酸中,首先看到锈迹溶解,溶液呈黄色。这是因为(用化学方程式表示): , 不一会儿,又看到溶液中有气泡产生,这是因为(用化学方程式表示):。24. 小明将未经砂布打磨的铝条放入盛有稀盐酸的密闭容器中,此反应能放出热量。用压强传感器测得容器内气体压强和反应时间的变化曲线如图所示。 (1)、AB段参加反应的物质是。(2)、图中的点表示铝条和盐酸恰好反应完。25. 装石灰水的试剂瓶瓶壁上通常有白色固体,要洗去这白色固体,可选用的试剂是。反应的化学方程式。26. 如图是为了验证稀硫酸的化学性质所做的三个实验,回答下列问题。
(1)、AB段参加反应的物质是。(2)、图中的点表示铝条和盐酸恰好反应完。25. 装石灰水的试剂瓶瓶壁上通常有白色固体,要洗去这白色固体,可选用的试剂是。反应的化学方程式。26. 如图是为了验证稀硫酸的化学性质所做的三个实验,回答下列问题。 (1)、A实验最终能观察到的现象是。(2)、欲证明C实验后硫酸过量,可在试管中加入少量。27. 如图所示为小科总结了酸、碱、盐的反应规律,其中“—”表示相连的物质能发生反应,根据要求完成下列问题。
(1)、A实验最终能观察到的现象是。(2)、欲证明C实验后硫酸过量,可在试管中加入少量。27. 如图所示为小科总结了酸、碱、盐的反应规律,其中“—”表示相连的物质能发生反应,根据要求完成下列问题。 (1)、农业上利用硫酸铜和氢氧化钙反应制备波尔多液,该制备原理是符合图中反应规律(请填写图中的序号)。(2)、小科研究反应规律②时,发现有些反应需要加入指示剂才能够判断反应是否发生了(不考虑反应的放热)。下列符合要求的反应是 。A、Cu(OH)2和H2SO4 B、NaOH和HCl C、BaCl2和 Na2SO4(3)、某实验室有一瓶久置的氢氧化钠溶液,小科猜想可能与空气中二氧化碳发生反应生成碳酸钠。小科取样加入了一种试剂,检验后,确定猜想成立。其中加入的试剂发生的反应符合规律①。写出一种符合要求的试剂。
(1)、农业上利用硫酸铜和氢氧化钙反应制备波尔多液,该制备原理是符合图中反应规律(请填写图中的序号)。(2)、小科研究反应规律②时,发现有些反应需要加入指示剂才能够判断反应是否发生了(不考虑反应的放热)。下列符合要求的反应是 。A、Cu(OH)2和H2SO4 B、NaOH和HCl C、BaCl2和 Na2SO4(3)、某实验室有一瓶久置的氢氧化钠溶液,小科猜想可能与空气中二氧化碳发生反应生成碳酸钠。小科取样加入了一种试剂,检验后,确定猜想成立。其中加入的试剂发生的反应符合规律①。写出一种符合要求的试剂。三、实验探究题
-
28. 我国不少地方有端午吃“灰水粽"的习俗。所谓“灰水棕“是指用草木灰的浸出液浸泡糯米做成的粽子,清香软糯。小王对制作“灰水粽”的草木灰展开了如下探究:

[查阅资料]
①糯米中加入食用碱可起到中和微生物生成的酸、软化食物纤维等作用:
②草木灰中富含钾盐,主要成分是K2CO3 , 还含有少量K2SO4和KCl。
[实验探究]检验草木灰的成分,并测定草木灰中K2CO3的质量分数。
(1)、取适量草木灰于烧杯中,加足量水浸泡,过滤得到草木灰的浸出液:取少量浸出液于试管中,滴加几滴酚酞试液,观察到酚酞试液变色,则说明草木灰的浸出液呈碱性。(2)、小柯用图示装置测定草木灰中K2CO3的质量分数,邇过测定丙装置质量的增加量来计算K2CO3的质量(草木灰中其他成分遇稀盐酸不产生气体),实验过程中需持续缓缓通入空气,其作用除搅拌乙、丙中的反应物外,还可以。(3)、有同学认为通过丙装置质量增加量来计算K2CO3的质量结果会偏大,为了更精确的测量,该同学建议在乙、丙之间增加两个吸收装置,你认为装置中从左到右按顺序应盛放的两种试剂是_______。A、NaOH溶液 B、浓H2SO4 C、NaHCO3饱和溶液 D、酸化的硝酸银溶液29. 某班同学为验证酸的化学通性,做了五组实验。分析并回答问题。 (1)、A组试管中都产生H2 , 若要制得较纯的H2 , 选稀硫酸而不选盐酸的原因是;(2)、B组试管中实验现象相同,该现象是;(3)、上述五组实验中没有体现酸的通性的是(填序号)。30. 实验室中常需要使用硫酸。
(1)、A组试管中都产生H2 , 若要制得较纯的H2 , 选稀硫酸而不选盐酸的原因是;(2)、B组试管中实验现象相同,该现象是;(3)、上述五组实验中没有体现酸的通性的是(填序号)。30. 实验室中常需要使用硫酸。 (1)、在小纸片上涂上少量浓硫酸,放置一会后,可观察到。(2)、用温度计的液泡蘸取少量浓硫酸,放置在空气中一会儿,可观察到温度计显示温度升高,其原因是。(3)、浓硫酸稀释过程如图所示,b中盛放的物质是。31. 在“探究稀盐酸和稀硫酸的化学性质”实验中,小乐发现镁带与稀盐酸反应后的试管内出现了灰白色沉淀。
(1)、在小纸片上涂上少量浓硫酸,放置一会后,可观察到。(2)、用温度计的液泡蘸取少量浓硫酸,放置在空气中一会儿,可观察到温度计显示温度升高,其原因是。(3)、浓硫酸稀释过程如图所示,b中盛放的物质是。31. 在“探究稀盐酸和稀硫酸的化学性质”实验中,小乐发现镁带与稀盐酸反应后的试管内出现了灰白色沉淀。提出问题:灰白色沉淀是什么物质?
提出猜想:小乐在老师指导下,猜想灰白色沉淀是下列物质中的一种或几种:
①镁; ②氯化镁; ③氢氧化镁; ④碱式氯化镁[Mg(OH)Cl]。
老师肯定了小乐的猜想,并鼓励他继续进行实验探究。
实验探究:
步骤一:将上述镁带与稀盐酸反应后试管内的物质过滤,得到滤液和灰白色滤渣。
步骤二:取滤液于试管中,加入适量的氯化镁粉末,粉末全部溶解。
步骤三:取少量灰白色滤渣于试管中,加入适量稀盐酸,沉淀全部溶解,无其他现象。
步骤四:将剩余滤渣用蒸馏水充分洗涤。取洗涤后的滤渣于试管中,加入过量稀硝酸,滤渣全部溶解,再加入硝酸银溶液,有白色沉淀产生。
实验反思及结论:
(1)、从步骤二可知,灰白色沉淀不可能是氯化镁,因为滤液是氯化镁的(填“饱和”或“不饱和”)溶液。(2)、从步骤三可知,该沉淀中没有。(3)、步骤四中滤渣用蒸馏水充分洗涤是为了。(4)、根据实验探究可知,该反应产生的灰白色沉淀中一定含有。32. 某校化学兴趣小组在探究“酸碱盐的相关性质”时,做了如图一所示的两个实验,实验结束后,小组同学将两支试管中的废液同时倒入一个洁净的烧杯中(如图所示),观察到有气泡产生,为确认最终烧杯内溶液中溶质的成分,同学们进行了如下探究。
【查阅资料】Na2SO4溶液、NaCl溶液呈中性。
(1)、【提出猜想】猜想1:Na2SO4、NaCl;猜想2:Na2SO4、NaCl和;
猜想3:Na2SO4、NaCl和H2SO4;
猜想4:Na2SO4、NaCl、H2SO4和Na2CO3。
(2)、【交流讨论】小强同学认为猜想4一定是错误的,他的理由是(用化学方程式表示)。(3)、【进行实验】小明同学设计如下两个实验方案:实验步骤
实验现象
实验结论
方案一
取少量烧杯中的溶液于洁净的试管中,加入几滴紫色石蕊溶液
①
猜想3正确
方案二
取少量烧杯中的溶液于洁净的试管中,加入少量铁粉
②
请写出方案二中有关反应的化学方程式:③。
四、解答题
-
33. 某化学兴趣小组欲测定水垢样品(主要成分是碳酸钙、氢氧化镁和少量的水)中各成分的质量,利用如图所示装置进行实验(该装置气密性良好,A、C、D中所装药品足量,且完全反应)。已知:碱石灰是氧化钙和氢氧化钠的混合物;加热条件下,碳酸钙生成两种氧化物,氢氧化镁也易分解,反应的化学方程式为:=MgO+H2O↑

I.将质量为10g的样品装入装置B的玻璃管中,按图连接好装置,先打开弹簧夹通入空气,一段时间后,关闭弹簧夹,将装置C、D称重,然后给样品加热;
II.待样品完全反应,再打开弹簧夹通入空气,再熄灭酒精喷灯,直到玻璃管冷却;
III.实验完毕,再次称量装置C、D的质量,发现分别增加了2.0g和2.2g;
IV.根据实验所测数据计算该样品中碳酸钙、氢氧化镁和水的质量。请回答下列问题:
(1)、装置C中所装药品为 。(2)、装置A的作用是。(3)、装置D中发生反应的化学方程式为。(4)、根据实验所测数据,计算该水垢样品中碳酸钙的质量。(写出具体计算过程)34. 珍珠粉含有碳酸钙、蛋白质等成分。市场上出现假珍珠粉外观上与真珍珠粉差不多,肉眼往往无法辨别它们。(1)、为了寻找区分真假珍珠粉的方法,科学兴趣小组的同学进行了下列实验:实验一:分别取真假珍珠粉适量置于两支试管中,加一定量的稀盐酸并将产生的气体通入澄清石灰水中,发现现象,说明真假珍珠粉均含有碳酸钙。
实验二:分别取少量真假珍珠粉置于铁片上灼烧,发现真珍珠粉能闻到烧焦羽毛气味;假珍珠粉没有闻到烧焦羽毛气味,由此可得出结论:假珍珠粉中不含 。
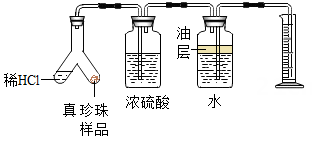
(2)、为了探究真珍珠粉中碳酸钙的含量,取5g真珍珠粉样品,分别置于如下图实验装置中(稀盐酸足量且真珍珠粉中只有碳酸钙与稀盐酸会反应生成气体)。①装置中浓硫酸的作用_____。
②当量筒中的液面不再上升时,量筒中水的体积为0.11升(实验前量筒未装水)。二氧化碳的密度取2克/升,根据测量结果,求该真珍珠粉样品中CaCO3的质量分数。
 35. 横亘在我省衢江、开化、常山的千里岗山脉的岩石以石灰岩为主,石灰石储量达 50 亿吨,是制造水泥、石灰、轻质碳酸钙的主要原料来源地。某兴趣小组的同学对一块从三衢山捡来的石灰石做纯度分析,进行了如图甲所示的实验:
35. 横亘在我省衢江、开化、常山的千里岗山脉的岩石以石灰岩为主,石灰石储量达 50 亿吨,是制造水泥、石灰、轻质碳酸钙的主要原料来源地。某兴趣小组的同学对一块从三衢山捡来的石灰石做纯度分析,进行了如图甲所示的实验: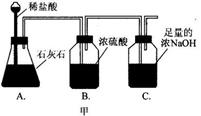
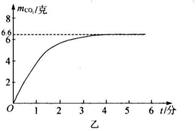
①用天平准确称取 20 克该石灰石放入 A 装置中,同时加入足量稀盐酸;②测量 C 装置中吸收的二氧化碳的质量,并据此绘成如图乙所示的曲线;③根据实验结果计算该石灰石的纯度。
请分析回答下列问题:
(1)、甲图中装置 B 的作用是。(2)、忽略空气中的二氧化碳及盐酸挥发对实验结果的影响,你认为由 C 装置测得的二氧化碳质量与反应产生的二氧化碳质量相等吗?。请分析原因:。(3)、根据实验数据,计算该石灰石中CaCO3 的质量分数。36. 黄铜是锌和铜的合金,可以用来制造机器零件及日常用品、为了测定某粉末状黄铜样品中锌的质量分数, 取 10g 这种样品放入烧杯中,再将 40g 稀盐酸分四次加入到该烧杯中,均充分反应,测得的实验数据如下表:
实验次数
1
2
3
4
稀盐酸的用量
10g
10g
10g
10g
剩余固体的质量
8.7g
7.4g
6.7g
6.7g
(1)、在第 次实验结束时样品中的锌就已完全反应。(2)、计算该黄铜样品中锌的质量分数。(3)、计算所用稀盐酸的溶质质量分数。37. 含CuCl2和HCl的150g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图。据图回答: (1)、整个反应过程中,离子个数不变。(2)、P点溶液中的溶质是。(3)、m1为多少?(要求写出具体的解题过程)
(1)、整个反应过程中,离子个数不变。(2)、P点溶液中的溶质是。(3)、m1为多少?(要求写出具体的解题过程)