八年级上册科学期末复习:物质的溶解与分离
试卷更新日期:2022-12-17 类型:复习试卷
一、单选题
-
1. 小宇将下列厨房中的物质放入足量的水中,充分搅拌,形成乳浊液的是( )A、食用油 B、白醋 C、白糖 D、面粉2. 医生常用生理盐水(溶质质量分数为0.9%)给患者输液。下列对生理盐水的理解不正确的是( )A、生理盐水中氯化钠是溶质,水是溶剂 B、生理盐水中氯化钠与水的质量比为9:1000 C、每输入100g生理盐水,进入患者体内的氯化钠质量为0.9g D、输液时,输液管中和输液瓶中生理盐水的溶质质量分数相同3. 在进行硝酸钾与氯化钠溶解性比较的实验时,下列哪些条件必须控制成相同( )
①温度;②溶质颗粒大小;③溶质质量;④溶剂质量;⑤溶剂种类
A、①②④ B、①④⑤ C、②③④ D、①②⑤4. 某同学在探究溶解能力的影响因素时,取两只相同的透明烧杯,分别倒入相同质量的冷水和热水,然后在冷水和热水中逐渐加入蔗糖,并使之充分溶解,直到不能继续溶解为止。其目的是探究溶解能力与( )A、溶剂种类的关系 B、温度的关系 C、溶质种类的关系 D、搅拌的关系5. 用温度计测量烧杯中的水温时,下列哪种物质加入水中会使温度计示数升高( )A、蔗糖 B、硝酸铵 C、氯化钠 D、氢氧化钠6. 下列关于溶液、悬浊液、乳浊液的说法正确的个数有( )①溶液一定是无色、均一、稳定、透明的液体;②同一种溶剂中可以同时有多种溶质;
③溶液是纯净物,而浊液是混合物;④植物油与水形成乳浊液,泥水是悬浊液;
⑤饱和溶波一定是浓溶液,不饱和溶液一定是稀溶液。
A、2 B、3 C、4 D、57. 概念图能清晰地反映概念之间的联系,如图表示溶液中部分概念的相互联系。下列说法错误的是 ( )
 A、表示均一稳定 B、表示溶剂 C、方法可为蒸发溶剂 D、方法可为增加溶质8. 下表是不同温度时硝酸钾的溶解度,下列有关说法正确的是( )
A、表示均一稳定 B、表示溶剂 C、方法可为蒸发溶剂 D、方法可为增加溶质8. 下表是不同温度时硝酸钾的溶解度,下列有关说法正确的是( )温度/℃
0
20
40
60
80
100
溶解度/克
13.3
31.6
63.9
110
169
246
A、硝酸钾的溶解度受温度影响明显,在一定范围溶解度随温度的升高而增大 B、20℃时,200克水中,硝酸钾的溶解度是63.2克 C、40℃时,100克硝酸钾饱和溶液中含有硝酸钾63.9克 D、100℃时水中溶解的硝酸钾一定比80℃时水中溶解的硝酸钾多9. 炎热的夏天,小柯打开雪碧瓶盖时,发现雪碧会自动喷出,喝了雪碧后又常常会打嗝。这说明影响气体在水中溶解度的因素是( )A、气体种类和容器体积 B、气体种类和温度,气体溶解度减小 C、气体种类和气压 D、温度和气压10. 氧气的溶解度随压强的变化如图所示,若图中t2℃对应的温度为30℃,则t1对应的温度可能是( ) A、大于30℃ B、等于40℃ C、小于30℃ D、任意温度均可11. 已知硫酸溶液密度大于1,且浓度越大、密度越大。某硫酸的质量分数为W,取等量的两份硫酸溶液分别进行下列操作:
A、大于30℃ B、等于40℃ C、小于30℃ D、任意温度均可11. 已知硫酸溶液密度大于1,且浓度越大、密度越大。某硫酸的质量分数为W,取等量的两份硫酸溶液分别进行下列操作:⑴蒸发溶液后恢复至室温,溶液质量减为原来一半,此时溶液的质量分数为W1
⑵蒸发溶液后恢复至室温,溶液体积减为原来一半,此时溶液的质量分数为W2
则下列关系正确的是( )
A、W1﹥W2 B、W1﹤W2 C、W1=W2 D、W2﹥2W12. 溶解度为Sg的某物质饱和溶液,跟水以1:4质量比混合后,溶液的质量分数为为( )A、 B、 C、 D、13. 实验室用固体氯化钠配制50g溶质质量分数为16%的氯化钠溶液。下列说法正确的是( )A、所需固体氯化钠的质量是8.0g B、固体氯化钠可以直接放在托盘天平的左盘上称量 C、溶解固体氯化钠时,用玻璃棒搅拌能增大氯化钠的溶解度 D、用量筒量取42mL水时,若仰视读数,会导致配制的溶液溶质质量分数偏大14. 水文化是存在于不同民族、国家和地区中关于水的相关文化,它包括人们对水的认识和感受、关于水的观念等。2022年3月22日是第30个世界水日,今年的主题是“珍惜地下水、珍视隐藏的资源”,下列对于水的认识不正确的是( )A、水是最常见的溶剂 B、水是由氢和氧组成的 C、含硫酸的工业废水要处理达标后才能排入河流 D、单一净化过程中,过滤是净化程度最高的15. 从混有少量硝酸钾的食盐晶体中提取较纯的食盐,可供选择的实验步骤有:①在较高的温度下制成该晶体的饱和溶液;②在常温下制成该晶体的饱和溶液;③升高溶液温度不断蒸发水分,直到大量固体析出;④降温至有较多量晶体析出;⑤过滤。正确的操作步骤是( )A、①④⑤ B、①④ C、②③ D、②③⑤16. 李时珍《本草纲目》中“烧酒”写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上,用器承取滴露。 其清如水,味极浓烈,盖酒露也”。这种方法是( ) A、过滤 B、蒸发 C、蒸馏 D、升华17. 鱼缸水泵是用于鱼缸中净水补氧的装置。在净水功能中,水由进水口经过海绵进入,再由出水口排出,海绵可以去除水中剩余的饲料颗粒、鱼体的排泄物、尸体等固体杂质,该功能类似于物质分离方法中的 ( )A、沉淀 B、过滤 C、结晶 D、蒸馏18. 如图所示为三种实验操作,下列说法正确的是( )
其清如水,味极浓烈,盖酒露也”。这种方法是( ) A、过滤 B、蒸发 C、蒸馏 D、升华17. 鱼缸水泵是用于鱼缸中净水补氧的装置。在净水功能中,水由进水口经过海绵进入,再由出水口排出,海绵可以去除水中剩余的饲料颗粒、鱼体的排泄物、尸体等固体杂质,该功能类似于物质分离方法中的 ( )A、沉淀 B、过滤 C、结晶 D、蒸馏18. 如图所示为三种实验操作,下列说法正确的是( ) A、进行如图甲所示的过滤操作,可从食盐溶液中获得食盐固体 B、进行如图乙所示的蒸发操作,当蒸发皿中出现较多固体时停止加热 C、进行如图丙所示的蒸馏操作,冷凝管管进出水的方向是a进b出 D、在粗盐提纯实验中,需要用到图示甲、乙、丙三种操作
A、进行如图甲所示的过滤操作,可从食盐溶液中获得食盐固体 B、进行如图乙所示的蒸发操作,当蒸发皿中出现较多固体时停止加热 C、进行如图丙所示的蒸馏操作,冷凝管管进出水的方向是a进b出 D、在粗盐提纯实验中,需要用到图示甲、乙、丙三种操作二、填空题
-
19. 给下列物质归类:①食盐水②钡餐③牛奶④肥皂水⑤泥水⑥色拉油和汽油混合⑦血液⑧色拉油与水混合。属于溶液的是 , 属于乳浊液的是 。(填序号)20. 20℃时,在盛有50g水的烧杯中加入15g固体X(不含杂质,不含结晶水),充分溶解后,逐渐升温,并测定不同温度时析出固体X的质量。测定结果记录如下表:
溶液的温度/℃
20
35
50
65
75
析出固体X的质量/g
10.4
8.0
5.0
0
0
若不考虑水蒸发对实验的影响,请回答下列问题。
(1)、35℃时,该溶液的质量是g;(2)、65℃时,该溶液 选填字母)。A、是饱和溶液 B、是不饱和溶液 C、一定是该溶质质量分数最大的溶液 D、无法判断是否饱和(3)、根据下表溶解度与溶解性的关系,可知X属于物质。溶解性
易溶
可溶
微溶
难溶(或不溶)
20℃溶解度(g)
>10
1~10
0.01~1
<0.01
21. 某同学在实验室做实验(当时气温为20℃),他用 量取100毫升水,用称取40克氯化钾,然后将100毫升水倒入装有氯化钾的烧杯中,用充分搅拌后,发现烧杯底部总是有不溶解的氯化钾,过滤后称得不溶氯化钾的质量为6克,则此时形成溶液的质量为 克,其中溶质是克,溶剂是克。实验中,氯化钾不能全部溶解,这一现象说明。22. 溶液与人们的生产生活密切相关。 (1)、将少量下列物质分别放入水中,充分搅拌,可以得到无色溶液的是 (填字母)。A、食盐 B、硫酸铜 C、面粉 D、食用油(2)、在盛有水的烧杯中加入下列某种物质,在形成溶液过程中,温度没有明显变化的是 (填字母)。A、氢氧化钠 B、硝酸铵 C、氯化钠(3)、将80克M物质加入50克水中,充分溶解,测得溶液的质量随温度的变化曲线如图所示,则A点时,该溶液的溶质质量分数为。23. 将纯净的氯化钠配制成溶液。20℃时,向 4 个盛有 200g 水的烧杯中,分别加入一定质量的氯化钠并充分溶解。4 组实验数据如下:
(1)、将少量下列物质分别放入水中,充分搅拌,可以得到无色溶液的是 (填字母)。A、食盐 B、硫酸铜 C、面粉 D、食用油(2)、在盛有水的烧杯中加入下列某种物质,在形成溶液过程中,温度没有明显变化的是 (填字母)。A、氢氧化钠 B、硝酸铵 C、氯化钠(3)、将80克M物质加入50克水中,充分溶解,测得溶液的质量随温度的变化曲线如图所示,则A点时,该溶液的溶质质量分数为。23. 将纯净的氯化钠配制成溶液。20℃时,向 4 个盛有 200g 水的烧杯中,分别加入一定质量的氯化钠并充分溶解。4 组实验数据如下:实验序号
①
②
③
④
加入氯化钠的质量/g
9
36
81
90
溶液质量/g
209
236
272
272
若将①中得到的溶液稀释成质量分数为 0.9%的生理盐水,需加水的质量是g. 关于上述实验的叙述正确的是(填序号).
a.①②所得溶液是不饱和溶液
b.③④所得溶液中,溶质的质量分数相等
c.20℃时,将④继续恒温蒸发 100g 水,过滤,得到质量为 36g 的固体
d.20℃时,200g 水中最多溶解氯化钠的质量为 72g.
24. 下表是氯化钾在不同温度时的溶解度。温度/℃
0
10
20
30
40
50
60
溶解度/g
27.6
31.0
34.0
37.0
x
42.6
45.5
小明为测定x的值,取4份40℃的水各50g,分别进行实验,并记录数据如下表。
实验编号
实验1
实验2
实验3
实验4
氯化钾质量/g
5
15
25
35
溶液质量/g
55
65
70
70
请回答下列问题。
(1)、要使实验2的溶液达到饱和,可采取的方法是。(2)、由实验可知,40℃时氯化钾的溶解度x为。25. 氯化钠和碳酸钠在不同温度时的溶解度如表所示。温度/℃
10
20
30
40
溶解度/g
氯化钠
35.8
36.0
36.3
36.6
碳酸钠
12.2
21.8
39.7
53.2
(1)、20℃时,氯化钠的溶解度为克。(2)、若氯化钠固体中含有少量碳酸钠时,为获得较纯净的氯化钠固体,应采用的方法是。(选填“蒸发溶剂”或“冷却热饱和溶液”)(3)、将10℃时氯化钠和碳酸钠的饱和溶液均升温至40℃,所得的两种溶液的溶质质量分数大小关系是:氯化钠碳酸钠(选填“>”、“<”或“=”)。26. 图甲、乙、丙三种固体物质的溶解度曲线,请回答下列问题. (1)、t1℃时,甲、乙、丙的溶解度由大到小的顺序是。(2)、P点的含义 。(3)、t3℃时,在150g水中加入100g甲,形成溶液的质量为 g。(4)、t2℃时,甲、乙、丙三种物质的饱和溶液升温至t3℃后,三种溶液的溶质质量分数由大到小的顺序是。27. 在农业上通常用12%的氯化钠溶液选种。实验室欲配制该质量分数的溶液60g,操作如图,请回答下列问题:
(1)、t1℃时,甲、乙、丙的溶解度由大到小的顺序是。(2)、P点的含义 。(3)、t3℃时,在150g水中加入100g甲,形成溶液的质量为 g。(4)、t2℃时,甲、乙、丙三种物质的饱和溶液升温至t3℃后,三种溶液的溶质质量分数由大到小的顺序是。27. 在农业上通常用12%的氯化钠溶液选种。实验室欲配制该质量分数的溶液60g,操作如图,请回答下列问题: (1)、图③中玻璃棒的作用是。(2)、配制溶液的正确操作顺序为④→②→→③(用序号和箭头表示)。(3)、操作②有错误,正确的操作是:。(4)、经检测,发现最后所配制的氯化钠溶液的溶质质量分数偏小,其原因可能是
(1)、图③中玻璃棒的作用是。(2)、配制溶液的正确操作顺序为④→②→→③(用序号和箭头表示)。(3)、操作②有错误,正确的操作是:。(4)、经检测,发现最后所配制的氯化钠溶液的溶质质量分数偏小,其原因可能是(填字母编号)。
A.所称的氯化钠中含杂质 B.使用量筒读数时俯视了
C.溶解氯化钠的烧杯事先用水湿润过 D.配制好的溶液在装瓶时有一部分洒出去了
28. 氯化钠、硝酸钾、氢氧化钙三种物质的溶解度曲线如图一与图二所示。请回答: (1)、要从含有少量硝酸钾的氯化钠溶液中,得到较纯净的氯化钠固体,可采用方法;(2)、在不改变溶质质量分数的情况下,把不饱和的氢氧化钙溶液变成饱和溶液的方法:;(3)、50℃时,分别向盛有10g水的两支试管中,加入等质量的氯化钠、硝酸钾两种固体物质,使其充分溶解,可观察到如图三所示的现象。A试管中溶解的物质是。若将温度都降到20℃,硝酸钾溶液中溶质的质量分数(填“>”、“<”或“=”)氯化钠溶液中溶质的质量分数。
(1)、要从含有少量硝酸钾的氯化钠溶液中,得到较纯净的氯化钠固体,可采用方法;(2)、在不改变溶质质量分数的情况下,把不饱和的氢氧化钙溶液变成饱和溶液的方法:;(3)、50℃时,分别向盛有10g水的两支试管中,加入等质量的氯化钠、硝酸钾两种固体物质,使其充分溶解,可观察到如图三所示的现象。A试管中溶解的物质是。若将温度都降到20℃,硝酸钾溶液中溶质的质量分数(填“>”、“<”或“=”)氯化钠溶液中溶质的质量分数。三、实验探究题
-
29. 兴趣小组利用家中的材料研究影响物质溶解性的因素,实验方案如下:
Ⅰ.称取一定质量的冰糖,研磨成粉末备用。
Ⅱ.按照下表进行实验,其中溶剂都为20克。(实验所需仪器略)
试管
1号
2号
3号
4号
实验温度
20℃
20℃
20℃
40℃
溶质种类
冰糖
冰糖
食盐
冰糖
溶剂种类
水
植物油
水
水
(1)、在实验中,使用粉状冰糖而不用块状冰糖,好处是。(2)、本验中,所研究影响溶解性的因素有。(3)、实验中是如何比较物质溶解性大小的?。30. 为了探究“影响固体溶解性的因素”,科学兴趣小组同学设计了如下五个实验。请你一起完成相关问题:实验组别
1
2
3
4
5
实验温度
20℃
20℃
20℃
20℃
60℃
溶剂种类
水
酒精
水
水
水
溶剂质量
20g
20g
10g
10g
10g
加入固体种类
硝酸钾
硝酸钾
硝酸钾
食盐
硝酸钾
加入固体质量
10g
10g
10g
10g
10g
剩余固体质量
g
10g
7.6g
6.4g
0g
(1)、将第1组实验中“剩余固体质量”补充完完整。(2)、从表中可以看出,影响固体溶解性的因素有。(填字母编号)A.温度 B.溶剂种类 C.溶剂质量 D.固体种类 E.固体质量
(3)、通过比较3、4两组实验,我们可以得到的结论是。31. 烧杯中盛有一定质量、温度为80 ℃、溶质为M的溶液,将其置于室温环境中,测定不同温度时析出固体M的质量。测定结果记录如下表。溶液的温度/℃
75
65
50
35
20
析出固体M的质量/g
0
0
2.0
4.5
8.4
若不考虑水蒸发对实验的影响,请回答下列问题。
(1)、65 ℃时,该溶液是否为饱和溶液?(填“是” “否”或“无法判断”)。(2)、将40 ℃时接近饱和的M溶液变成饱和溶液,下列方法中一定能达到目的的有(填序号)。①升温 ②降温 ③加溶质M ④加水 ⑤加另一种固体N ⑥恒温蒸发水 ⑦与40 ℃时M的饱和溶液混合(3)、20 ℃时,用固体粉末M和水配制100 g溶质质量分数为5% 的M溶液,必须用到的仪器有:托盘天平(带砝码盒)、烧杯、药匙、量筒(100 mL)、玻璃棒、。(4)、图2所示实验中,若加入物质b后,热水会突然沸腾,说明溶液的温度。继续向热水中加入相同质量的物质b,又看到沸腾现象,至烧杯中出现固体物质后,再继续加入相同质量的物质b,就看不到沸腾现象。请解释不再产生沸腾现象的原因。 32. 如图是配制50克质量分数为5%的氯化钠溶液的操作过程示意图。
32. 如图是配制50克质量分数为5%的氯化钠溶液的操作过程示意图。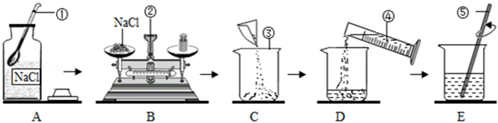 (1)、B操作,在称量中发现指针偏向右边,接下来的操作是 。(2)、E操作中玻璃棒的作用是 。(3)、如果配制过程中出现以下情况,可能导致所配溶液的溶质质量分数偏小的是 。A、 A、所用氯化钠药品不纯 B、配完后将溶液转移至试剂瓶时洒出了一些 C、量取水时仰视读数 D、将量好的水从量筒里倒入烧杯时,洒出一些水33. 在实验室中可用如图所示装置制取蒸馏水。请回答下列问题。
(1)、B操作,在称量中发现指针偏向右边,接下来的操作是 。(2)、E操作中玻璃棒的作用是 。(3)、如果配制过程中出现以下情况,可能导致所配溶液的溶质质量分数偏小的是 。A、 A、所用氯化钠药品不纯 B、配完后将溶液转移至试剂瓶时洒出了一些 C、量取水时仰视读数 D、将量好的水从量筒里倒入烧杯时,洒出一些水33. 在实验室中可用如图所示装置制取蒸馏水。请回答下列问题。 (1)、写出标有字母的仪器名称:A , B。(2)、请写出图中两处明显的错误。
(1)、写出标有字母的仪器名称:A , B。(2)、请写出图中两处明显的错误。①;
②。
(3)、实验时A中除加入少量自来水外,还需要加入少量的 , 其作用是。34. 如图所示是三种物质的溶解度曲线。请回答下列问题。 (1)、溶解度随温度升高而降低的是;30 ℃时溶解度最大的是。(2)、80 ℃时硝酸钠饱和溶液的溶质质量分数为。使硝酸钠不饱和溶液变为饱和溶液,可采取的措施有(写一种)。(3)、某硝酸钾固体中混有少量硫酸铈杂质,分离提纯硝酸钾的操作是:配成高温下的硝酸钾饱和溶液、、过滤、洗涤、干燥。(4)、30 ℃时,用等质量的硝酸钾、硝酸钠配制两种物质的饱和溶液需要水的质量:硝酸钾(填“>”“<”或“=”)硝酸钠。(5)、配制一定溶质质量分数的硝酸钾溶液,以下操作中会导致所配制溶液的溶质质量分数偏小的是 (填字母)。A、用量筒量取水时仰视读数 B、配制好的溶液向细口瓶中转移时溅出 C、硝酸钾固体中含有杂质 D、烧杯事先用水润洗过,内壁有水
(1)、溶解度随温度升高而降低的是;30 ℃时溶解度最大的是。(2)、80 ℃时硝酸钠饱和溶液的溶质质量分数为。使硝酸钠不饱和溶液变为饱和溶液,可采取的措施有(写一种)。(3)、某硝酸钾固体中混有少量硫酸铈杂质,分离提纯硝酸钾的操作是:配成高温下的硝酸钾饱和溶液、、过滤、洗涤、干燥。(4)、30 ℃时,用等质量的硝酸钾、硝酸钠配制两种物质的饱和溶液需要水的质量:硝酸钾(填“>”“<”或“=”)硝酸钠。(5)、配制一定溶质质量分数的硝酸钾溶液,以下操作中会导致所配制溶液的溶质质量分数偏小的是 (填字母)。A、用量筒量取水时仰视读数 B、配制好的溶液向细口瓶中转移时溅出 C、硝酸钾固体中含有杂质 D、烧杯事先用水润洗过,内壁有水四、解答题
-
35. 实验室有一瓶未开封的浓盐酸,部分标签如图所示。
 (1)、这瓶浓盐酸中溶液的质量为多少g?(2)、若用这瓶浓盐酸来配制200g溶质质量分数为10%的稀盐酸,需量取浓盐酸的体积是多少mL?水的体积是多少mL?36. 研究物质的溶解对于生产、生活有着重要意义。下表是碳酸钠的部分溶解度数据:
(1)、这瓶浓盐酸中溶液的质量为多少g?(2)、若用这瓶浓盐酸来配制200g溶质质量分数为10%的稀盐酸,需量取浓盐酸的体积是多少mL?水的体积是多少mL?36. 研究物质的溶解对于生产、生活有着重要意义。下表是碳酸钠的部分溶解度数据:温度/℃
20
30
40
50
60
80
100
溶解度/g
21.8
39.7
48.8
47.3
46.4
45.1
44.7
(1)、由表中数据可知,碳酸钠属于物质(填“易溶”、“可溶”、“微溶”或“难溶”)。(2)、由表中数据可知,碳酸钠的溶解度随温度升高而。(3)、小东同学进行了如图所示的实验,若使烧杯③中的溶液达到饱和,至少需再加入克碳酸钠,升温至60℃时,烧杯④中会出现现象。 37. 同学们你见过夏天能自制冷的罐装饮料吗?如图是“××牌”一摇冰功能饮料。
37. 同学们你见过夏天能自制冷的罐装饮料吗?如图是“××牌”一摇冰功能饮料。 (1)、“一摇冰”饮料在炎热的夏天解渴,其罐底的固体是 。A、氢氧化钠 B、硝酸铵 C、氯化钠(2)、罐身旋钮开关下方有一个特别提示:“……务必摇晃后倒置2分钟”,请分别解释为什么要摇晃和倒置。
(1)、“一摇冰”饮料在炎热的夏天解渴,其罐底的固体是 。A、氢氧化钠 B、硝酸铵 C、氯化钠(2)、罐身旋钮开关下方有一个特别提示:“……务必摇晃后倒置2分钟”,请分别解释为什么要摇晃和倒置。
