【备考2023】浙江省中考第一轮复习:物质转化与材料利用
试卷更新日期:2022-12-16 类型:一轮复习
一、单选题
-
1. 下列各组变化中,每一转化在一定条件下均能一步实现的是 (不考虑光合作用) ( )
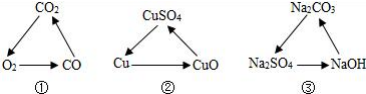 A、①③ B、②③ C、③ D、①②③2. 在化学反应 3S+6NaOH=2Na2S+Na2SO3+3H2O中,没有涉及到的物质类别是 ( )A、酸 B、碱 C、盐 D、氧化物3. 下列有关金属的说法中,错误的是 ( )A、铜质插头是利用铜的导电性 B、钨制灯丝是利用钨的熔点低 C、铝制成铝箔是利用铝的延展性 D、用铁锅炒菜时利用铁的导热性4. “对比法”是实验探究中常用的一种科学方法。分析以下铁钉生锈实验的设计,得出结论不正确的是 ( )
A、①③ B、②③ C、③ D、①②③2. 在化学反应 3S+6NaOH=2Na2S+Na2SO3+3H2O中,没有涉及到的物质类别是 ( )A、酸 B、碱 C、盐 D、氧化物3. 下列有关金属的说法中,错误的是 ( )A、铜质插头是利用铜的导电性 B、钨制灯丝是利用钨的熔点低 C、铝制成铝箔是利用铝的延展性 D、用铁锅炒菜时利用铁的导热性4. “对比法”是实验探究中常用的一种科学方法。分析以下铁钉生锈实验的设计,得出结论不正确的是 ( ) A、对比①②可以说明铁生锈一定要有氧气参加 B、对比②③可以说明铁生锈一定要有水参加 C、对比①③可以说明铁生锈一定要有水参加 D、对比①②③可以说明铁生锈必需水和氧气同时参加5. 在氯化亚铁、氯化铜和氯化镁的混合溶液中加入一定量的锌粉,反应停止后过滤,向滤液中插入洁净的 铁丝,铁丝表面无明显变化,下列分析正确的是 ( )A、滤液中一定有氯化镁,可能有氯化锌和氯化亚铁 B、滤液中一定有氯化镁和氯化锌,可能有氯化铜 C、滤渣中一定有铜和铁,可能有锌 D、滤渣中一定有铜,可能有铁和锌6. 如图所示,R是滑动变阻器,它的金属滑片垂直固定在等臂金属杠杆的中间且可以随杠杆左右转动。杠杆两端分别悬挂等质量、等体积的X金属球,此时杠杆平衡,再将X金属球同时分别浸没到等量等浓度的稀硫酸和硫酸铜溶液中,一段时间后,观察到灯泡变亮(不考虑浮力的影响),则X金属球不可能是( )
A、对比①②可以说明铁生锈一定要有氧气参加 B、对比②③可以说明铁生锈一定要有水参加 C、对比①③可以说明铁生锈一定要有水参加 D、对比①②③可以说明铁生锈必需水和氧气同时参加5. 在氯化亚铁、氯化铜和氯化镁的混合溶液中加入一定量的锌粉,反应停止后过滤,向滤液中插入洁净的 铁丝,铁丝表面无明显变化,下列分析正确的是 ( )A、滤液中一定有氯化镁,可能有氯化锌和氯化亚铁 B、滤液中一定有氯化镁和氯化锌,可能有氯化铜 C、滤渣中一定有铜和铁,可能有锌 D、滤渣中一定有铜,可能有铁和锌6. 如图所示,R是滑动变阻器,它的金属滑片垂直固定在等臂金属杠杆的中间且可以随杠杆左右转动。杠杆两端分别悬挂等质量、等体积的X金属球,此时杠杆平衡,再将X金属球同时分别浸没到等量等浓度的稀硫酸和硫酸铜溶液中,一段时间后,观察到灯泡变亮(不考虑浮力的影响),则X金属球不可能是( ) A、Mg B、Fe C、Zn D、Ag7. 用“
A、Mg B、Fe C、Zn D、Ag7. 用“ ”和“
”和“ ”表示不同元素的原子,下列微观示意图能表示化合物的是( ) A、
”表示不同元素的原子,下列微观示意图能表示化合物的是( ) A、 B、
B、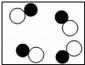 C、
C、 D、
D、 8. 如图所示,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列说法错误的是( )
8. 如图所示,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列说法错误的是( ) A、反应条件都需要加热 B、通过气体之前,都需要检验纯度 C、制铜时,实际消耗的CO、H2都比理论消耗的要多 D、实验中氢气和一氧化碳具有氧化性9. 3月22日,世界上第一颗使用磁系统收集大空垃圾的卫星发射升空。太空垃圾碎片中,不能与稀盐酸发生反应的材料是( )A、铜 B、锌 C、铝 D、镁10. 如图是小科制作的“纯净物检索表”, 其中 R 可以是下列选项中的 ( )
A、反应条件都需要加热 B、通过气体之前,都需要检验纯度 C、制铜时,实际消耗的CO、H2都比理论消耗的要多 D、实验中氢气和一氧化碳具有氧化性9. 3月22日,世界上第一颗使用磁系统收集大空垃圾的卫星发射升空。太空垃圾碎片中,不能与稀盐酸发生反应的材料是( )A、铜 B、锌 C、铝 D、镁10. 如图是小科制作的“纯净物检索表”, 其中 R 可以是下列选项中的 ( )1b 含多种元素........................ 2
2a 含两种元素........................ 3
2b 含两种以上元素.............. Q
3a 含氧元素............................. R
3b 不含氧元素........................ S
A、氯化钠 B、氧气 C、二氧化碳 D、碳酸钠11. 绿水青山就是金山银山,保护环境人人有责。下列是小科和同学周末在校园周边捡拾的垃圾, 不属于有机合成材料的是 ( )A、矿泉水瓶 B、塑料饭盒
B、塑料饭盒 C、易拉罐
C、易拉罐 D、垃圾袋
D、垃圾袋 12. 我国古代人发明了湿法炼铜,其主要过程是用稀硫酸将铜矿中的铜转变成可溶性的硫酸铜,再将铁放 入硫酸铜溶液中把铜置换出来, 有关湿法炼铜的说法正确的是 ( )A、湿法炼铜过程中发生的两个反应都是置换反应 B、铁在与硫酸铜溶液反应时失去电子变成铁离子 C、当溶液变为无色时说明硫酸铜已经反应完全 D、硫酸铜溶于水能电离出铜离子和硫酸根离子13. 将金属M放入盛有Cu(NO3)2溶液的烧杯中,充分反应后溶液呈无色。继续向烧杯中加入一定量的AgNO3溶液,待充分反应后过滤,得蓝色滤液和滤渣。根据实验现象分析,以下结论错误的是( )A、金属活动性顺序:M>Cu>Ag B、滤液中一定含有M的阳离子和Cu2+ C、滤渣中一定含有Ag和Cu D、向滤液中滴加稀盐酸,可能产生白色沉淀14. 我国古代将炉甘石( )、赤铜( )和木炭混合加热至800℃,得到一种外形似金子的锌铜合金(俗称黄铜)。下列说法正确的是( )A、 铜的化合价为+2价 B、黄铜熔点比铜与锌的熔点都低 C、合金的抗腐蚀性一般比其纯金属弱 D、合金至少含两种金属元素15. 如图为物质的转化关系,其中“→”表示某种物质可一步反应生成另一种物质,则下列各组物质按照甲、乙、丙的顺序符合对应“转化关系”的是( )
12. 我国古代人发明了湿法炼铜,其主要过程是用稀硫酸将铜矿中的铜转变成可溶性的硫酸铜,再将铁放 入硫酸铜溶液中把铜置换出来, 有关湿法炼铜的说法正确的是 ( )A、湿法炼铜过程中发生的两个反应都是置换反应 B、铁在与硫酸铜溶液反应时失去电子变成铁离子 C、当溶液变为无色时说明硫酸铜已经反应完全 D、硫酸铜溶于水能电离出铜离子和硫酸根离子13. 将金属M放入盛有Cu(NO3)2溶液的烧杯中,充分反应后溶液呈无色。继续向烧杯中加入一定量的AgNO3溶液,待充分反应后过滤,得蓝色滤液和滤渣。根据实验现象分析,以下结论错误的是( )A、金属活动性顺序:M>Cu>Ag B、滤液中一定含有M的阳离子和Cu2+ C、滤渣中一定含有Ag和Cu D、向滤液中滴加稀盐酸,可能产生白色沉淀14. 我国古代将炉甘石( )、赤铜( )和木炭混合加热至800℃,得到一种外形似金子的锌铜合金(俗称黄铜)。下列说法正确的是( )A、 铜的化合价为+2价 B、黄铜熔点比铜与锌的熔点都低 C、合金的抗腐蚀性一般比其纯金属弱 D、合金至少含两种金属元素15. 如图为物质的转化关系,其中“→”表示某种物质可一步反应生成另一种物质,则下列各组物质按照甲、乙、丙的顺序符合对应“转化关系”的是( ) A、C、CO、H2CO3 B、Zn、Cu、Ag C、CuO、Cu、Cu(NO3)2 D、NaOH、NaCl、NaNO3
A、C、CO、H2CO3 B、Zn、Cu、Ag C、CuO、Cu、Cu(NO3)2 D、NaOH、NaCl、NaNO3二、填空题
-
16. 将以下物质按要求选择填写(填序号):
a.加碘盐;b.冰水混合物;c.硫磺;d.硫酸铝钾晶体[KAl(SO4)2·12H2O];e.KClO3;
f.钢; g.稀硫酸 h.金刚石
混合物 单质
17. 今有两组物质:①冰、干冰、氧化铜、金刚石
②纯碱、烧碱、碳酸钙、氯化亚铁
各组中均有一种物质所属类别与另三种不同,请在下面的横线上填写出这种物质的化学式:
① ;②。
18. 如图为U盘的外观和内部结构示意图。 (1)、图中含有的金属材料是(填1种)。(2)、将铜加工成铜箔基板利用的铜的性质是。19. 如图是某科学老师设计的一氧化碳还原氧化铁的实验装置。
(1)、图中含有的金属材料是(填1种)。(2)、将铜加工成铜箔基板利用的铜的性质是。19. 如图是某科学老师设计的一氧化碳还原氧化铁的实验装置。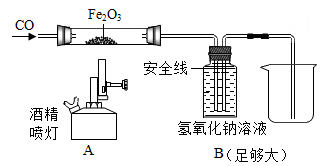 (1)、实验时先通CO,在B装置的液面下降到安全线之前,不能加热氧化铁,这是因为。(2)、反应结束后停止加热,继续通CO,此时B装置的作用是。20. 你注意过吗?家庭使用的铁制工具隔一段时间不用就变得锈迹斑斑,而广场上矗立的不锈钢雕塑,几经风霜雨雪总能保持原有的本色。(1)、铁与空气中的直接接触会导致铁制品的锈蚀。(2)、金属铝化学性质比铁更活泼,但是铝锅、饮料罐大量使用铝材料,这是因为它的表面易生成一层。21. 向硝酸银、硝酸铜、硝酸亚铁的混合溶液中加入一定质量的锌粉,反应停止后过滤,得滤渣A和滤液B,向滤渣A中加入稀盐酸,有气泡冒出,则滤渣A中一定有;滤液B中一定有的金属离子是;一定没有的金属离子是。22. 如图是某同学构建的关于氧气的部分知识网络,请你由图回答:
(1)、实验时先通CO,在B装置的液面下降到安全线之前,不能加热氧化铁,这是因为。(2)、反应结束后停止加热,继续通CO,此时B装置的作用是。20. 你注意过吗?家庭使用的铁制工具隔一段时间不用就变得锈迹斑斑,而广场上矗立的不锈钢雕塑,几经风霜雨雪总能保持原有的本色。(1)、铁与空气中的直接接触会导致铁制品的锈蚀。(2)、金属铝化学性质比铁更活泼,但是铝锅、饮料罐大量使用铝材料,这是因为它的表面易生成一层。21. 向硝酸银、硝酸铜、硝酸亚铁的混合溶液中加入一定质量的锌粉,反应停止后过滤,得滤渣A和滤液B,向滤渣A中加入稀盐酸,有气泡冒出,则滤渣A中一定有;滤液B中一定有的金属离子是;一定没有的金属离子是。22. 如图是某同学构建的关于氧气的部分知识网络,请你由图回答: (1)、写出实验室固液常温型制取氧气的化学方程式 ;(2)、写出知识网络图中属于氧化物的物质有。23. 沼气是有机物在一定的温度、湿度、酸碱度的条件下,通过微生物发酵作用产生的。沼气的主要成分是甲烷CH4 , 甲烷是一种可燃气体,浓度只有在5%~15%范围内,遇到明火会发生爆炸。请分析回答下列问题:(1)、沼气属于(填“单质”、“化合物”或“混合物”),甲烷属于 (填“无机物”或“有机物”)(2)、用二氧化锡制成的电阻Rx阻值随空气中甲烷气体浓度的增大而减小。利用电压为6V的电源,阻值为10Ω的定值电阻R0、电流表和电阻Rx制作成甲烷气体浓度检测仪,如图所示。当甲烷气体浓度增大时,电流表的示数将(填“变大”、“变小”或“不变”) 。
(1)、写出实验室固液常温型制取氧气的化学方程式 ;(2)、写出知识网络图中属于氧化物的物质有。23. 沼气是有机物在一定的温度、湿度、酸碱度的条件下,通过微生物发酵作用产生的。沼气的主要成分是甲烷CH4 , 甲烷是一种可燃气体,浓度只有在5%~15%范围内,遇到明火会发生爆炸。请分析回答下列问题:(1)、沼气属于(填“单质”、“化合物”或“混合物”),甲烷属于 (填“无机物”或“有机物”)(2)、用二氧化锡制成的电阻Rx阻值随空气中甲烷气体浓度的增大而减小。利用电压为6V的电源,阻值为10Ω的定值电阻R0、电流表和电阻Rx制作成甲烷气体浓度检测仪,如图所示。当甲烷气体浓度增大时,电流表的示数将(填“变大”、“变小”或“不变”) 。甲烷气体浓度%
0
20
40
60
80
100
Rx/Ω
25
20
15
10
7
5
 (3)、用该检测仪测某沼气池上方空气样品中甲烷气体浓度时,电流表的示数为0.2A。若该沼气池中的甲烷气体遇到明火,一般情况下(填“可能会”或“不会”)发生爆炸。24. 2020年11月24日,搭载“嫦娥五号"探测器的“长征五号"大型运载火箭成功发射升空,12月17日“嫦娥五号”返回器顺利返回。请回答下列问题。(1)、“长征五号"火箭用的整流罩的“蒙皮"面板厚度只有0.3毫米,在相同刚度下,火箭壳段的重量将减少10%以上。选用铝合金而不选用纯铝主要原因是铝合金硬度和强度(填“大于”或“小于")纯铝。(2)、“长征五号"的第一、 二子级火箭用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)做推进剂,化学方程式为C2H8N2+2N2O4=3N2+4H2O+2X,则X的化学式是。25. 碳捕捉技术”是通过一定的方法,将工业生产中产生的二氧化碳分离出来并加以利用.某校科研小组的同学设计用氢氧化钠溶液来“捕捉”二氧化碳,其基本过程如下(部分条件及物质未标出)。
(3)、用该检测仪测某沼气池上方空气样品中甲烷气体浓度时,电流表的示数为0.2A。若该沼气池中的甲烷气体遇到明火,一般情况下(填“可能会”或“不会”)发生爆炸。24. 2020年11月24日,搭载“嫦娥五号"探测器的“长征五号"大型运载火箭成功发射升空,12月17日“嫦娥五号”返回器顺利返回。请回答下列问题。(1)、“长征五号"火箭用的整流罩的“蒙皮"面板厚度只有0.3毫米,在相同刚度下,火箭壳段的重量将减少10%以上。选用铝合金而不选用纯铝主要原因是铝合金硬度和强度(填“大于”或“小于")纯铝。(2)、“长征五号"的第一、 二子级火箭用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)做推进剂,化学方程式为C2H8N2+2N2O4=3N2+4H2O+2X,则X的化学式是。25. 碳捕捉技术”是通过一定的方法,将工业生产中产生的二氧化碳分离出来并加以利用.某校科研小组的同学设计用氢氧化钠溶液来“捕捉”二氧化碳,其基本过程如下(部分条件及物质未标出)。
请回答下列有关问题:
(1)、“捕捉室”中发生反应的化学方程式为:。(2)、在整个“捕捉”过程中,可以循环利用的物质是。三、实验探究题
-
26. 已知某气体可能是氢气或一氧化碳气体,或者是氢气和一氧化碳的混合物。为验证该气体的成分,小科设计了下图所示的实验,实验中小科观察到玻璃管中黑色固体变红,澄清石灰水变浑浊的现象。请回答下列问题:
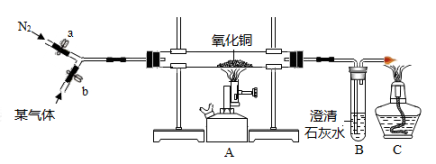 (1)、实验开始时,应先打开(选填“a”或“b”)通气体;(2)、根据装置中出现的实验现象,还无法确定气体的成分,还需要添加一组实验装置,请你写出该装置的位置和所需的药品。(3)、小科实验中若要对尾气中的可燃性气体进行回收再利用,C处酒精灯可换下列装置最为合理。
(1)、实验开始时,应先打开(选填“a”或“b”)通气体;(2)、根据装置中出现的实验现象,还无法确定气体的成分,还需要添加一组实验装置,请你写出该装置的位置和所需的药品。(3)、小科实验中若要对尾气中的可燃性气体进行回收再利用,C处酒精灯可换下列装置最为合理。 27. 某科学兴趣小组利用铜丝、铁丝、FeSO4溶液、CuSO4溶液、AgNO3溶液等实验药品,来探究铁、铜与银三种金属化学活动性,并设计了如图所示的实验方案:将铁丝与铜丝分别浸入盛有CuSO4溶液和AgNO3溶液的两支试管中,观察实验现象试回答下列问题:
27. 某科学兴趣小组利用铜丝、铁丝、FeSO4溶液、CuSO4溶液、AgNO3溶液等实验药品,来探究铁、铜与银三种金属化学活动性,并设计了如图所示的实验方案:将铁丝与铜丝分别浸入盛有CuSO4溶液和AgNO3溶液的两支试管中,观察实验现象试回答下列问题: (1)、若得到铁比铜活泼的结论,实验中观察到的现象是。(2)、本实验中取用的CuSO4溶液和AgNO3溶液的质量是否一定要相等? (选填“是”或“否”)。(3)、请你利用上述实验药品,设计另一种方案,来比较、铁、铜、银三种金属之间的化学活动性,并在答题卷图中标注所选的溶液及金属丝的名称。(标注即可,不用写具体方案)。28. 某化学兴趣小组的同学探究木炭还原氧化铜的实验,实验装置如图。实验时a中的固体由黑色变红色,b中的试管内产生气泡和白色沉淀。
(1)、若得到铁比铜活泼的结论,实验中观察到的现象是。(2)、本实验中取用的CuSO4溶液和AgNO3溶液的质量是否一定要相等? (选填“是”或“否”)。(3)、请你利用上述实验药品,设计另一种方案,来比较、铁、铜、银三种金属之间的化学活动性,并在答题卷图中标注所选的溶液及金属丝的名称。(标注即可,不用写具体方案)。28. 某化学兴趣小组的同学探究木炭还原氧化铜的实验,实验装置如图。实验时a中的固体由黑色变红色,b中的试管内产生气泡和白色沉淀。
【查阅资料】氧化亚铜(Cu2O)是红色固体,能与稀硫酸发生如下反应:Cu2O+H2SO4=Cu+CuSO4+H2O,铜离子在溶液中显蓝色。
【提出问题】已知实验后a中的红色固体含有单质铜,是否还含有氧化亚铜(Cu2O)呢?
【实验验证】取a中的红色固体少于量于试管中,加入稀硫酸溶液,试管中出现 (填现象), 证明固体中确实含有 Cu2O。
【提出问题】木炭还原氧化铜产生的气体时什么?
【设计实验】基于猜想3,根据CO和CO2的性质,兴趣小组同学设计了如下实验
 (1)、加热前要先通一段时间气体,原因是。(2)、有两种实验现象都能分别证明产生的气体中含有CO;
(1)、加热前要先通一段时间气体,原因是。(2)、有两种实验现象都能分别证明产生的气体中含有CO;① 且 F 装置中出现白色沉淀的现象;
②E 装置中出现 的现象。
29. 小黄对Ti、Mg、Cu的金属活动性顺序进行了如下探究。
金属
Ti
Mg
Cu
实验现象
产生气泡速度慢
产生气泡速度快
无明显现象
(1)、取大小相同的这三种金属薄片,分别投入等体积、等质量分数的足量稀盐酸中,观察到现象如表。结论:Ti、Mg、Cu三种金属的活动性由强到弱的顺序为。(2)、在实验过程中,小黄又发现镁条与稀盐酸反应过程中产生气体体积与反应时间有如上图所示关系,请分析:t2~t3时间内反应速度逐渐减慢的原因是(3)、请你设计其他方案来比较这三种金属的活动性:(可供选择的药品:Ti、Mg、Cu、TiCl2溶液、MgCl2溶液、溶液)(请画出实验装置图,并注明反应物)
 30. 为了探究铁钉锈蚀的条件,某同学设计的实验如图。一周后发现①中铁钉生锈, ②③中铁钉不生锈, ④中铁钉严重生锈,请回答下列问题:
30. 为了探究铁钉锈蚀的条件,某同学设计的实验如图。一周后发现①中铁钉生锈, ②③中铁钉不生锈, ④中铁钉严重生锈,请回答下列问题: (1)、①试管中铁钉锈蚀最严重的部分。(选填“甲”、“乙”、“丙”)(2)、要得到铁生锈需要与氧气接触的结论,应对比的实验组合是。(3)、对比①③试管中的现象,可知铁钉生锈需要与 接触。(4)、对比①和④试管, 可得出的实验结论是。
(1)、①试管中铁钉锈蚀最严重的部分。(选填“甲”、“乙”、“丙”)(2)、要得到铁生锈需要与氧气接触的结论,应对比的实验组合是。(3)、对比①③试管中的现象,可知铁钉生锈需要与 接触。(4)、对比①和④试管, 可得出的实验结论是。四、解答题
-
31. 为测定某赤铁矿石中氧化铁的质量分数,小乐用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的6.6g的气体用碱溶液完全吸收。回答下列问题:(1)、10g赤铁矿石样品与一氧化碳反应生成的气体是。(2)、上述气体用碱溶液吸收,选取的碱溶液可以是溶液。(3)、该赤铁矿石样品中氧化铁的质量分数?32. 北京冬奥,科技助梦,科学知识在其中扮演着重要角色。请回答下列问题:(1)、国产氢氧燃料电池豪华中巴在冬奥会投入使用。氢气作燃料能实现“零排放”的原因是 。(2)、冬奥会纪念钞是我国第一枚拥有完全自主知识产权的聚丙烯塑料钞。聚丙烯的化学式可表示为(C3H6)n,它属于 材料(选填“有机物”或“无机物”)。(3)、火炬“飞扬”的外壳由碳纤维复合材料制造而成,具有“轻、固、美”的特点,且在1000℃的温度下不会起泡、开裂。则下列特性与该材料上述特点无关的是 (选填序号)。A、密度小 B、硬度大 C、耐高温 D、导电性好(4)、冬奥会期间,送餐机器人格外引人关注。若送餐机器人以20W的功率在水平地面上以0.4m/s的速度匀速前进10s,则该机器人行进过程中受到地面对它的阻力为。33. 在学习了金属的化学性质后,科学老师布置了一项课外学习任务:调查化工颜料店出售的涂料添加剂“银粉”是什么金属?某学习小组通过调查,分别获得了“银粉”可能是银粉、铝粉、锌粉这三种不同结果。为了确定究竟是哪一种金属,学习小组同学将一小包“银粉”带回实验室,进行了如下实验和分析。
 (1)、取少量“银粉”于试管中,滴加适量盐酸,观察到产生,说明“银粉"一定不是银。(2)、为了进一步确定“银粉”是铝还是锌, 学习小组通过理论计算,获得两种金属分别与足量盐酸反应产生氢气的质量关系,并绘制成如图所示图像。在绘制锌的图像时,a点所对应的锌的质量m为多少? (通过计算回答)(3)、取1.8克“银粉”(杂质忽略不计)加入到50克稀盐酸中,恰好完全反应,生成氢气0.2 克。根据上图可知,“银粉”是 , 另请计算实验中所用稀盐酸的溶质质量分数?34. 还原铁粉是一种主要含单质铁灰色或黑色粉末,又称“双吸剂”,常用于食品保鲜。某课外兴趣小组对这还原性铁粉(含少量杂质,杂质既不溶于水也不溶于酸)产生了浓厚的兴趣,他们取六份样品,分别加稀硫酸反应。测得部分数据如表,请根据有关信息回答问题。
(1)、取少量“银粉”于试管中,滴加适量盐酸,观察到产生,说明“银粉"一定不是银。(2)、为了进一步确定“银粉”是铝还是锌, 学习小组通过理论计算,获得两种金属分别与足量盐酸反应产生氢气的质量关系,并绘制成如图所示图像。在绘制锌的图像时,a点所对应的锌的质量m为多少? (通过计算回答)(3)、取1.8克“银粉”(杂质忽略不计)加入到50克稀盐酸中,恰好完全反应,生成氢气0.2 克。根据上图可知,“银粉”是 , 另请计算实验中所用稀盐酸的溶质质量分数?34. 还原铁粉是一种主要含单质铁灰色或黑色粉末,又称“双吸剂”,常用于食品保鲜。某课外兴趣小组对这还原性铁粉(含少量杂质,杂质既不溶于水也不溶于酸)产生了浓厚的兴趣,他们取六份样品,分别加稀硫酸反应。测得部分数据如表,请根据有关信息回答问题。实验次数
1
3
4
5
6
取样品质量/g
31.0
31.0
31.0
31.0
31.0
取稀硫酸质量/g
30.0
90.0
120.0
150.0
180.0
产生气体质量/g
0
a
0.3
0.5
0.5
(1)、食品袋内放入“双吸剂“是为了吸收。(2)、a的数值为。(3)、列式计算实验中稀硫酸的溶质的质量分数(结果精确到0.1%) 。35. 构建知识网络是一种重要的学习方法.图为某同学绘制的铁的化学性质网络示意图。请分析回答下列问题: (1)、反应①中可用(填化学式)作还原剂;(2)、反应②导致每年有大量的钢铁锈蚀,为阻止该反应的发生,人们常采用在钢铁表面涂刷油漆 或镀上其它金属等方法。这两种方法的共同原理是阻止钢铁与接触;(3)、早在西汉时期,我国劳动人民就利用铁与硫酸铜溶液反应制取铜,称为“湿法炼铜”,即反应 ③,若用该方法制得铜16千克,理论上需要溶质质量分数为10%的硫酸铜溶液多少千克?
(1)、反应①中可用(填化学式)作还原剂;(2)、反应②导致每年有大量的钢铁锈蚀,为阻止该反应的发生,人们常采用在钢铁表面涂刷油漆 或镀上其它金属等方法。这两种方法的共同原理是阻止钢铁与接触;(3)、早在西汉时期,我国劳动人民就利用铁与硫酸铜溶液反应制取铜,称为“湿法炼铜”,即反应 ③,若用该方法制得铜16千克,理论上需要溶质质量分数为10%的硫酸铜溶液多少千克?五、综合说理题
-
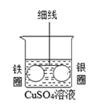
36. 如图所示,在细玻璃管两端固定铁圈和银圈,用细线在玻璃管中点悬挂起来,使之恰好水平平衡,然后小心地把装置浸入盛有适量硫酸铜溶液的烧杯中,放置一段时间后,可观察到什么现象?请用学过的知识对此现象作出合理的解释。