【备考2023】浙江省中考第一轮复习:微粒的模型与符号
试卷更新日期:2022-12-16 类型:一轮复习
一、单选题
-
1. 中国科学院首创室温制氢方案,其反应原理如图所示。下列说法错误的是( )
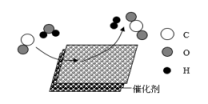 A、该反应的化学方程式是 B、该反应前后分子数目不变 C、该反应属于置换反应 D、反应物CO和都是氧化物
A、该反应的化学方程式是 B、该反应前后分子数目不变 C、该反应属于置换反应 D、反应物CO和都是氧化物 -
2. 预防感染“新冠肺炎”常用消毒剂的成分及其使用注意事项如表所示:
消毒剂类型
成分
使用注意事项
含氯消毒剂
84消毒液(有效成分NaClO)
不能与洁厕灵(含盐酸)混用
醇类消毒剂
医用酒精(C2H5OH含量为75%)
远离火源
过氧化物类消毒剂
过氧化氢(H2O2)消毒剂
见光或受热易分解,有腐蚀性、有灼伤危险
过氧乙酸(CH3COOOH)消毒剂
下列有关上述常用消毒剂的分析,错误的是( )
A、C2H5OH 具有可燃性 B、NaClO属于氧化物,Cl 的化合价为-1 价 C、过氧化氢消毒剂应放置于暗处密封保存 D、过氧乙酸消毒剂使用时谨防溅到皮肤上 -
3. 科学家发现的N(NO2)3是一种新型火箭燃料,关于N(NO2)3的说法正确的是( )A、N(NO2)3属于氧化物 B、N(NO2)3中含有3个氮原子和6个氧原子 C、N(NO2)3由氮、氧两个元素构成 D、N(NO2)3中氮元素的质量分数为40%
-
4. 构建化学基本观念是学好化学的基础,下列对化学基本观念的认识不正确的是( )A、元素观:过氧化氢是由氢元素和氧元素组成的 B、微粒观:保持氧气化学性质的最小微粒是氧分子 C、变化观:氢气在空气中燃烧生成水 D、守恒观:24g镁和32g氧气反应,生成56g氧化镁
-
5. 科学家发现,在一定的温度和压力下,石墨能转化为金刚石。下列说法中,不正确的是 ( )A、石墨与金刚石元素组成相同,结构不同 B、石墨转化为金刚石是化学变化 C、只含一种元素的物质是纯净物 D、石墨和金刚石化学性质相似
-
6. 下列物质的名称、俗名、化学式及类别中, 完全对应的是( )
物质的名称
俗名
化学式
类别
A
碳酸钠
纯碱、 苏打
NaCO3
盐
B
碳酸钙
生石灰
CaCO3
盐
C
氢氧化钙
熟石灰
CaO
金属氧化物
D
氢氧化钠
苛性钠、烧碱
NaOH
碱
A、A B、B C、C D、D -
7. 下面是四种制取ZnSO4的化学反应,对这四个化学反应理解错误的是( )
①Zn+ H2SO4=ZnSO4+H2↑
②ZnO+H2SO4=ZnSO4+H2O
③Zn(OH)2+H2SO4=ZnSO4+2H2O
④ZnCO3+H2SO4=ZnSO4+ H2O+CO2↑
A、反应①属于置换反应 B、反应②中锌元素的化合价不变 C、反应③实质是Zn2+和SO42-的反应 D、反应③④都是复分解反应 -
8. 在元素周期表上有一种元素是我们亚洲人发现的,它就是欽,读作“nǐ”,其部分信息如图所示。则下列有关说法正确的是( )
 A、欽属于金属元素 B、相对原子质量为113 C、原子的核电荷数为171 D、原子的核外电子数为284
A、欽属于金属元素 B、相对原子质量为113 C、原子的核电荷数为171 D、原子的核外电子数为284 -
9. 推理是学习科学的一种重要思维方法,下列推理合理的是( )A、同位素原子的质子数相同,氕和氘是氢的同位素,所以质子数一定相同 B、阳离子是带正电荷的粒子,则带正电荷的粒子一定是阳离子 C、中和反应有盐和水生成,则有盐和水生成的反应一定是中和反应 D、原子核由质子和中子构成,所以原子核中都含有质子和中子
-
10. 下列是表示气体微粒的示意图,图中“
 ”和“
”和“ ”分别表示不同元素的原子,其中表示单质的是( ) A、
”分别表示不同元素的原子,其中表示单质的是( ) A、 B、
B、 C、
C、 D、
D、
-
11. 如图为Fe元素的化合价和物质类别的二维图。下列说法正确的是( )
 A、物质C的化学式为Fe2O3 B、物质D的化学式为Fe(OH)3 C、物质A在氧气中燃烧生成物质B D、物质B比物质C的铁元素含量低
A、物质C的化学式为Fe2O3 B、物质D的化学式为Fe(OH)3 C、物质A在氧气中燃烧生成物质B D、物质B比物质C的铁元素含量低 -
12. 建立模型是学习科学的重要方法,下列不属于模型的是( )A、
 原子结构
B、
原子结构
B、 空气成分
C、
空气成分
C、 细胞结构
D、
细胞结构
D、 注意行人
注意行人
-
13. “绿色化学”能实现零排放(即反应物中的原子利用率达到100%)。CO和H2在一定条件下按照不同的比例可以合成不同的有机化工原料。根据零排放的要求,以CO和H2合成的有机物不可能是( )A、甲醇(CH3OH) B、乙醇(C2H6O) C、甲醛(CH2O) D、葡萄糖(C6H12O6)
-
14. 元素周期表是学习化学的重要工具,如图是元素周期表中的一格,下面从该图获取的信息中,正确的是( )
 A、该元素的原子序数为52 B、该元素属于非金属元素 C、该元素在地壳中的含量为52.00% D、该元素的原子核外有24个电子
A、该元素的原子序数为52 B、该元素属于非金属元素 C、该元素在地壳中的含量为52.00% D、该元素的原子核外有24个电子 -
15. 碳—14是碳的一种具放射性的同位素原子,其相对原子质量为14。如图为碳—14原子的结构示意图,由图可知碳—14原子( )
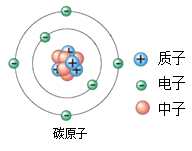 A、含有14个质子 B、含有6个中子 C、核电荷数为6 D、质子数和中子数相等
A、含有14个质子 B、含有6个中子 C、核电荷数为6 D、质子数和中子数相等
二、填空题
-
16. 小宁同学取了适量实验室制二氧化碳发生装置中的剩余溶液。逐滴滴加纯碱溶液,绘制产生沉淀的图象如甲图所示。
 (1)、请写出B点对应溶液的溶质:。(2)、乙图是甲图中O点到A点的反应前后装置内溶液中离子的变化模型图。
(1)、请写出B点对应溶液的溶质:。(2)、乙图是甲图中O点到A点的反应前后装置内溶液中离子的变化模型图。则“
 ”表示(写化学符号)
”表示(写化学符号) -
17. 被称为“工业用盐”的亚硝酸钠(NaNO2 )易被人误作为食盐(NaCl)放进食物,引发人体中毒。小金建议可以用硝酸银溶液作为指示剂来鉴别亚硝酸钠溶液和食盐溶液。
 表示溶液中由溶质电离产生的不同离子。(1)、当硝酸银溶液滴到食盐溶液中有白色沉淀产生(反应前后离子种类变化如图甲所示),请写出该 反应的化学方程式。(2)、向亚硝酸钠溶液中滴加硝酸银溶液, 无明显现象(滴加硝酸银溶液前后微观粒子种类变化如图乙 所示)。则
表示溶液中由溶质电离产生的不同离子。(1)、当硝酸银溶液滴到食盐溶液中有白色沉淀产生(反应前后离子种类变化如图甲所示),请写出该 反应的化学方程式。(2)、向亚硝酸钠溶液中滴加硝酸银溶液, 无明显现象(滴加硝酸银溶液前后微观粒子种类变化如图乙 所示)。则 表示 (填写离子符号)。
表示 (填写离子符号)。 
-
18. 现有①液氧②洁净的食盐水③铁粉④二氧化碳⑤冰水混合物⑥液态空气等六种物质,其中属于混合物的是(填序号下同);属于氧化物的是;含氧分子的有。
-
19. 有下列几种物质:a.盐酸、b.熟石灰、c.纯碱、d.食盐;请用化学式填空.(1)、用来清除铁锈的物质;(2)、常用降低土壤酸性的是;(3)、在日常生活中用做腌制食物的是;(4)、少量存于胃液中帮助消化的是;
-
20. 《奔跑吧兄弟》是一档热播的娱乐节目,其中涉及到许多科学知识。(1)、其中一期节目,队员用水枪将某无色溶液喷射到对方的“名牌”上,“名牌”立即变红色,若无色溶液为酚酞溶液,则事先浸泡“名牌”的溶液可能是 。A、白酒 B、柠檬酸 C、食盐溶液 D、纯碱溶液(2)、另一期节目,蓝色的“污水”中注入“神秘水”后立即变的澄清透明。无色的“神秘水”的主要成分是草酸,化学式为H2C2O4 , 其中C的化合价为。
-
21. 钢铁是目前产量最高、用途最广的金属。请回答下列问题:(1)、炼铁可以用CO将磁铁矿(Fe3O4)中铁还原出来,反应中CO与Fe3O4粒子数目比为;(2)、某钢铁厂每年消耗120万吨的焦炭(C),若加入的焦炭全部转化为CO2 , 则该钢铁厂每年排放CO2的质量为万吨。
-
22. 山茶油是一种绿色保健食品,被誉为东方橄榄油,主要成分是柠檬醛。使7.6克柠檬醛在氧气中完全燃烧,生成2.2克二氧化碳和7.2克水,则柠檬醛中一定含有元素。
-
23. 科学源于生活, 生活中蕴含着许多科学知识。请回答:(1)、食盐、食醋、 味精、纯碱等均是家庭中常见的物质, 为了使肉类和蔬菜不易腐败, 可选用进行腌制;(2)、合理使用食品添加剂,能够改善食品的品质,有助于食品防腐、保鲜。 但食品添加剂的生产和使用 有严格的规范,如过氧化钙就是禁止在食用面粉中添加的物质,该化合物中氧元素为-1价,则过氧化 钙的化学式是.
-
24.(1)、药品利巴韦林是治疗新冠病毒的药物之一,其分子式C8H12N405属于(选填“有机物” 或“无机物”)(2)、常用燃烧法测定有机物的组成,现使10g某有机物在足量氧气中充分燃烧,生成22gCO2和7.2gH2O,则该有机物中一定有的元素是.
-
25. 从古代到现代,材料的种类越来越多,用途也越来越广泛。(1)、钛合金是21世纪的重要材料,钛合金从分类上属于(选填“单质”、“化合物”或“混合物”)。(2)、在工业生产和日常生活中,玻璃是一种常见的非金属材料,普通玻璃的主要成分是CaSiO3 ,其中 Si的化合价为价。
三、实验探究题
-
26. 甲、乙两位同学查阅资料知:CH4 和CO两种气体均具有可燃性和还原性。
他们想对CH4的还原性进行研究。
(1)、[提出假设]他们对CH4还原CuO的产物提出了以下假设:假设1: Cu、 CO、CO2假设2: Cu、 CO、H2O
假设3: Cu、 CO2、 H2O 假设4: Cu、CO、CO2、H2O
其中哪个假设不合理 , 并写出原因:。
(2)、[进行实验]甲同学用以下装置进行定性检验(假设药品都是足量的)。已知:白色的无水硫酸铜粉末遇水变蓝,氢氧化钠溶液可以吸收CO2 , 浓硫酸可以吸收水蒸气。


为了尽可能多地检验出CH4还原CuO的产物,则装置正确的连接顺序是(填写字母,装置可重复使用):A→B→→D
(3)、乙同学用以下装置进行定量测定(假设药品都是足量的)。实验记录的数据如下。装置序号 M N P 实验前装置的质量 150 156.6 256.8 实验后装置的质量 145.6 159.3 259.0 
由以上数据可推测,假设合理。
-
27. Mg(OH)2是一种新型的阻燃剂,在温度达到380℃时分解吸收热量并释放出水,同时生成的氧化镁附着于可燃物的表面阻止了进一步燃烧。某同学用氨水在实验室模拟制取Mg(OH)2的过程:一定温度下﹐往一定量的氯化镁溶液中加入氨水(易挥发),生成 Mg(OH)2 , 再通过结晶、过滤,得到Mg(OH)2晶体。为探究获得较高Mg(OH)2转化率的条件,该同学进行下述对比实验,数据如下:
实验编号
氯化镁溶液浓度/(gL/-1)
反应温度/℃
Mg(OH)2转化率/%
A
20
30
27.06
B
40
30
56.77
C
40
40
69.64
D
40
60
54.30
E
60
60
50.60
(1)、实验B和C的目的是。(2)、有实验数据可知,能够得到最多Mg(OH)2的条件是(填浓度和温度)。(3)、在氯化镁溶液浓度都是40g/L的情况下,60℃时 Mg(OH)2转化率比40℃时低的原因是。 -
28. 现有三只烧杯,分别盛有稀盐酸、稀硫酸、碳酸钠溶液中的一种,并向其中滴加了酚酞溶液或石蕊溶液,结果如下图所示。
 (1)、B溶液呈(选填“酸性”、“碱性”、或“中性”)(2)、取A中溶液于试管中,加入氧化铁,溶液由无色变为黄色。则黄色溶液中含有的金属阳离子为 (填写离子符号)。
(1)、B溶液呈(选填“酸性”、“碱性”、或“中性”)(2)、取A中溶液于试管中,加入氧化铁,溶液由无色变为黄色。则黄色溶液中含有的金属阳离子为 (填写离子符号)。 -
29. 人类为揭示原子结构的奥秘,经历了漫长的探究过程。原子结构的认识发展史简单归纳如下:
 (1)、卢瑟福核式结构模型,是基于“用带正电的α粒子轰击金属箔”的实验提出的。根据实验现象(如图),不能获得的结论是 ;(填字母)
(1)、卢瑟福核式结构模型,是基于“用带正电的α粒子轰击金属箔”的实验提出的。根据实验现象(如图),不能获得的结论是 ;(填字母) A、原子核体积很小 B、原子核质量较大 C、原子核带正电荷 D、核外电子带负电荷(2)、如图乙,α粒子通过荧光屏会引起闪光。荧光屏设计成360°环绕,是因为卢瑟福在实验前认为α粒子可能穿过金箔,也可能。
A、原子核体积很小 B、原子核质量较大 C、原子核带正电荷 D、核外电子带负电荷(2)、如图乙,α粒子通过荧光屏会引起闪光。荧光屏设计成360°环绕,是因为卢瑟福在实验前认为α粒子可能穿过金箔,也可能。 (3)、1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有微粒从氮原子中被击出,而α粒子留在了氮原子中,将氮原子变成了氧原子。从现代观点看,被击出的微粒一定含有。(提示:α粒子由2个质子和2个中子构成)
(3)、1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有微粒从氮原子中被击出,而α粒子留在了氮原子中,将氮原子变成了氧原子。从现代观点看,被击出的微粒一定含有。(提示:α粒子由2个质子和2个中子构成) -
30. 质量守恒定律的发现,对科学发展作出了重要贡献。
【验证质量守恒定律】
(1)、实验小组分别选取以下三组药品,通过称量比较各组物质在密闭容器内混合前后的总质量,不.能.达到目的的有 ;A、二氧化碳和澄清石灰水 B、铜和稀盐酸 C、白磷和空气(2)、【运用质量守恒定律】在一密闭容器内有 4 种物质 A、B、C、D,它们在一定条件下发生化学反应。其中 A、B、C 的微观示意图和反应前后各物质的质量如下表所示。
物质
A
B
C
D
 氢原子
氢原子 氧原子
氧原子 碳原子
碳原子微观示意图



反应前质量/g
100
1
1
46
反应后质量/g
4
89
55
x
x 值为;
(3)、图中属于氧化物的有 (填字母代号);(4)、若 D 的相对分子质量为 46,则该物质的化学式是。
四、综合说理题
-
31. 对于同一种元素的不同原子而言,质子数是唯一确定的,但中子数却可能不同。质子数相同而中子数不同的原子,互称同位素。所有原子都有同位素。

资料一:氢有氕、氘、氚三种同位素,它们在元素周期表中处于同一个位置,化学性质与核外电子数有关,其原子结构如图所示。
资料二:氢的三种同位素可以分别表示为1H、2H、3H,它们都会与氧反应生成水,生成物叫做轻水1H2O、重水²H2O及超重水3H2O,它们的化学性质相同。
资料三:同位素构成的物质中,物理性质可能不同。在标准状况下,轻水的密度是1.0g/cm3 , 重水的密度却是1.105g/cm3。
请分析资料,结合水的微观结构解释“轻水”和“重水”性质异同的原因。
五、解答题
-
32. 某钢铁厂高炉炼铁的主要原料是焦炭、赤铁矿(主要成分是Fe2O3)、空气等, 主要反应过程 如下所示:
 (1)、A 的化学式是。(2)、该钢铁厂年生产生铁5×106吨(生铁中铁的质量分数为96%),则需要含铁的质量分数为60%的赤铁矿石多少吨?
(1)、A 的化学式是。(2)、该钢铁厂年生产生铁5×106吨(生铁中铁的质量分数为96%),则需要含铁的质量分数为60%的赤铁矿石多少吨? -
33. 钴(Co)的化学性质与铁相似,但钴在常温下对水和空气都比较稳定。
 (1)、如图是含钴物质的化合价——物质类价图。其中物质a的化学式是 , R处对应的物质类别是。(2)、下列预测钴的化学性质合理的是 。A、Co能在O2中燃烧 B、常温时钴易与H2O反应 C、Co能与稀H2SO4反应 D、CoCl3溶液中的杂质MgCl2可加入钴粉除去(3)、已知CoSO4易溶于水,利用复分解反应原理,写出一种生成CoSO4反应的化学方程式。
(1)、如图是含钴物质的化合价——物质类价图。其中物质a的化学式是 , R处对应的物质类别是。(2)、下列预测钴的化学性质合理的是 。A、Co能在O2中燃烧 B、常温时钴易与H2O反应 C、Co能与稀H2SO4反应 D、CoCl3溶液中的杂质MgCl2可加入钴粉除去(3)、已知CoSO4易溶于水,利用复分解反应原理,写出一种生成CoSO4反应的化学方程式。 -
34. 我国自主研发的“液态太阳燃料合成项目”技术路线如图甲所示,其中将二氧化碳和氢气高效转化为液体燃料甲醇(CH3OH)的微观示意如图乙所示。回答问题:
 (1)、据图甲所示的技术路线,写出获得氢气的化学方程式是。甲醇制取过程中能量转化是太阳能→电能→能。(2)、在图乙所示的微观示意中,二氧化碳和氢气先转化为、氢和氧等中间产物,然后再进一步作用生成甲醇和水。
(1)、据图甲所示的技术路线,写出获得氢气的化学方程式是。甲醇制取过程中能量转化是太阳能→电能→能。(2)、在图乙所示的微观示意中,二氧化碳和氢气先转化为、氢和氧等中间产物,然后再进一步作用生成甲醇和水。 -
35. 生活中科学之美、科学之趣随处可见。下图是某厂商设计的T恤,T恤上有趣的图案是邻二溴苯(C6H4Br2)分子的结构简式。
 (1)、邻二溴苯属于(填“有机物”或“无机物”)。(2)、邻二溴苯分子中碳、氢、溴三种原子个数比为。(3)、236g邻二溴苯中含溴元素多少克?
(1)、邻二溴苯属于(填“有机物”或“无机物”)。(2)、邻二溴苯分子中碳、氢、溴三种原子个数比为。(3)、236g邻二溴苯中含溴元素多少克? -
36. 为测定CuCl2和FeCl2组成的混合溶液中FeCl2的质量分数进行如下实验:
①取200g混合溶液加入足量的AgNO3溶液,经过滤洗涤、干燥、称量得到143.5gAgCl固体;
②另取原混合溶液各200g与含有杂质的废铁反应(杂质不溶于水,也不参与反应),共做了五组实验,其实验数据如下表。
实验组别
一
二
三
四
五
混合溶液质量/g
200
200
200
200
200
铁屑质量/g
6
9
12
15
18
析出铜的质量/g
6.4
9.6
m
16
16
请分析计算:
(1)、表中第三组实验的m值为。(2)、第组实验恰好完全反应。(3)、铁屑中铁的质量分数为多少?(计算结果精确到0.1%)(4)、原混合溶液中FeCl2的质量分数为多少?(计算结果精确到0.1%)
