【备考2023】浙江省中考第一轮复习:水和水的溶液
试卷更新日期:2022-12-16 类型:一轮复习
一、单选题
-
1. 已知硫酸溶液密度大于1,且浓度越大、密度越大。某硫酸的质量分数为W,取等量的两份硫酸溶液分别进行下列操作:
⑴蒸发溶液后恢复至室温,溶液质量减为原来一半,此时溶液的质量分数为W1
⑵蒸发溶液后恢复至室温,溶液体积减为原来一半,此时溶液的质量分数为W2
则下列关系正确的是( )
A、W1﹥W2 B、W1﹤W2 C、W1=W2 D、W2﹥2W2. 水文化是存在于不同民族、国家和地区中关于水的相关文化,它包括人们对水的认识和感受、关于水的观念等。2022年3月22日是第30个世界水日,今年的主题是“珍惜地下水、珍视隐藏的资源”,下列对于水的认识不正确的是( )A、水是最常见的溶剂 B、水是由氢和氧组成的 C、含硫酸的工业废水要处理达标后才能排入河流 D、单一净化过程中,过滤是净化程度最高的3. 用下图所示的密闭实验装置,能够使气球膨胀,过一段时间又恢复到原状的一组固体和液体是( ) A、固体:硝酸铵;液体:水 B、固体:生石灰;液体:水 C、固体:碳酸钠;液体:稀盐酸 D、固体:氯化钠;液体:水4. 炎热的夏天,小柯打开雪碧瓶盖时,发现雪碧会自动喷出,喝了雪碧后又常常会打嗝。这说明影响气体在水中溶解度的因素是( )A、气体种类和容器体积 B、气体种类和温度,气体溶解度减小 C、气体种类和气压 D、温度和气压5. 下列关于溶液、悬浊液、乳浊液的说法正确的个数有( )
A、固体:硝酸铵;液体:水 B、固体:生石灰;液体:水 C、固体:碳酸钠;液体:稀盐酸 D、固体:氯化钠;液体:水4. 炎热的夏天,小柯打开雪碧瓶盖时,发现雪碧会自动喷出,喝了雪碧后又常常会打嗝。这说明影响气体在水中溶解度的因素是( )A、气体种类和容器体积 B、气体种类和温度,气体溶解度减小 C、气体种类和气压 D、温度和气压5. 下列关于溶液、悬浊液、乳浊液的说法正确的个数有( )①溶液一定是无色、均一、稳定、透明的液体;②同一种溶剂中可以同时有多种溶质;
③溶液是纯净物,而浊液是混合物;④植物油与水形成乳浊液,泥水是悬浊液;
⑤饱和溶波一定是浓溶液,不饱和溶液一定是稀溶液。
A、2 B、3 C、4 D、56. 氧气的溶解度随压强的变化如图所示,若图中t2℃对应的温度为30℃,则t1对应的温度可能是( ) A、大于30℃ B、等于40℃ C、小于30℃ D、任意温度均可7. 溶解度为Sg的某物质饱和溶液,跟水以1:4质量比混合后,溶液的质量分数为为( )A、 B、 C、 D、8. 在分别盛有100g水的烧杯中分别加入KNO3固体充分溶解(如图所示),已知40℃时KNO3的溶解度为63.9g,60℃时KNO3的溶解度为110g。下列说法错误的是( )
A、大于30℃ B、等于40℃ C、小于30℃ D、任意温度均可7. 溶解度为Sg的某物质饱和溶液,跟水以1:4质量比混合后,溶液的质量分数为为( )A、 B、 C、 D、8. 在分别盛有100g水的烧杯中分别加入KNO3固体充分溶解(如图所示),已知40℃时KNO3的溶解度为63.9g,60℃时KNO3的溶解度为110g。下列说法错误的是( ) A、甲、乙、丙均为饱和溶液 B、甲、乙溶液的溶质质量分数相等 C、将丙溶液降温到40℃,析出46.1gKNO3固体 D、溶液质量的大小关系为甲<乙=丙9. 分类是根据研究对象的共性和差异,按一定的标准将研究对象区分为若干个不同种类的科学方法。下列分类的标准与其结果对应的是( )A、依据大气温度在水平方向上的变化特点,将大气分成5层 B、根据分散在液体中的不溶性物质的状态不同,将浊液分为悬浊液和乳浊液 C、依据地球上的水体是否含盐将其分为海洋水和陆地水 D、若物质的溶解度超过10g,则其属于易溶物质,溶解度在1﹣10g之间的是可溶物质10. 下表是不同温度时硝酸钾的溶解度,下列有关说法正确的是( )
A、甲、乙、丙均为饱和溶液 B、甲、乙溶液的溶质质量分数相等 C、将丙溶液降温到40℃,析出46.1gKNO3固体 D、溶液质量的大小关系为甲<乙=丙9. 分类是根据研究对象的共性和差异,按一定的标准将研究对象区分为若干个不同种类的科学方法。下列分类的标准与其结果对应的是( )A、依据大气温度在水平方向上的变化特点,将大气分成5层 B、根据分散在液体中的不溶性物质的状态不同,将浊液分为悬浊液和乳浊液 C、依据地球上的水体是否含盐将其分为海洋水和陆地水 D、若物质的溶解度超过10g,则其属于易溶物质,溶解度在1﹣10g之间的是可溶物质10. 下表是不同温度时硝酸钾的溶解度,下列有关说法正确的是( )温度/℃
0
20
40
60
80
100
溶解度/克
13.3
31.6
63.9
110
169
246
A、硝酸钾的溶解度受温度影响明显,在一定范围溶解度随温度的升高而增大 B、20℃时,200克水中,硝酸钾的溶解度是63.2克 C、40℃时,100克硝酸钾饱和溶液中含有硝酸钾63.9克 D、100℃时水中溶解的硝酸钾一定比80℃时水中溶解的硝酸钾多11. 某实验小组用如图所示装置完成电解水的实验并收集产生的气体(U型管中预先加入了少量氢氧化钠,氢气气的密度比空气小),下列说法不正确的是( )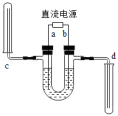 A、a是电源的负极 B、d管中的气体先收集的气体可以用带火星的木条检验 C、U型管中加入少量氢氧化钠的目的是增强导电性 D、该实验说明水分子中含有氢分子和氧分子12. 如图所示是A、B、C三种物质的溶解度曲线,下列分析正确的是( )
A、a是电源的负极 B、d管中的气体先收集的气体可以用带火星的木条检验 C、U型管中加入少量氢氧化钠的目的是增强导电性 D、该实验说明水分子中含有氢分子和氧分子12. 如图所示是A、B、C三种物质的溶解度曲线,下列分析正确的是( ) A、A物质的溶解度大于B物质的溶解度 B、20℃时A,C两物质的饱和溶液溶质质量分数相等 C、50℃时把50gA放入50g水中能得到A的饱和溶液,其溶质与溶液的质量比为1:2 D、20℃时A,B,C三种物质的饱和溶液升温到50℃时,三种溶液的溶质质量分数的大小关系是B>A=C13. 小宇将下列厨房中的物质放入足量的水中,充分搅拌,形成乳浊液的是( )A、食用油 B、白醋 C、白糖 D、面粉14. 室温下,向一杯不饱和的食盐溶液中逐渐加入食盐,下列图像中符合变化规律的是( )A、
A、A物质的溶解度大于B物质的溶解度 B、20℃时A,C两物质的饱和溶液溶质质量分数相等 C、50℃时把50gA放入50g水中能得到A的饱和溶液,其溶质与溶液的质量比为1:2 D、20℃时A,B,C三种物质的饱和溶液升温到50℃时,三种溶液的溶质质量分数的大小关系是B>A=C13. 小宇将下列厨房中的物质放入足量的水中,充分搅拌,形成乳浊液的是( )A、食用油 B、白醋 C、白糖 D、面粉14. 室温下,向一杯不饱和的食盐溶液中逐渐加入食盐,下列图像中符合变化规律的是( )A、 B、
B、 C、
C、 D、
D、 15. 下列关于水资源的叙述中,正确的是( )A、我国水资源丰富,按人口平均居世界第二位 B、通常说的水资源主要指陆地上的淡水资源 C、世界上水资源除沙漠地区以外,其他分布是比较均匀的 D、河流水、湖泊淡水及浅层地下水占陆地上淡水资源储量的大部分16. 如图是张强同学自制的简易电解水装置的一部分,下列有关说法正确的是( )
15. 下列关于水资源的叙述中,正确的是( )A、我国水资源丰富,按人口平均居世界第二位 B、通常说的水资源主要指陆地上的淡水资源 C、世界上水资源除沙漠地区以外,其他分布是比较均匀的 D、河流水、湖泊淡水及浅层地下水占陆地上淡水资源储量的大部分16. 如图是张强同学自制的简易电解水装置的一部分,下列有关说法正确的是( ) A、连接B的是电源的正极 B、这个实验证明水是由氢气和氧气组成的 C、试管A中得到的是氧气 D、试管B中的气体能使带火星的木条复燃
A、连接B的是电源的正极 B、这个实验证明水是由氢气和氧气组成的 C、试管A中得到的是氧气 D、试管B中的气体能使带火星的木条复燃二、填空题
-
17. 将纯净的氯化钠配制成溶液。20℃时,向 4 个盛有 200g 水的烧杯中,分别加入一定质量的氯化钠并充分溶解。4 组实验数据如下:
实验序号
①
②
③
④
加入氯化钠的质量/g
9
36
81
90
溶液质量/g
209
236
272
272
若将①中得到的溶液稀释成质量分数为 0.9%的生理盐水,需加水的质量是g. 关于上述实验的叙述正确的是(填序号).
a.①②所得溶液是不饱和溶液
b.③④所得溶液中,溶质的质量分数相等
c.20℃时,将④继续恒温蒸发 100g 水,过滤,得到质量为 36g 的固体
d.20℃时,200g 水中最多溶解氯化钠的质量为 72g.
18. 右图为某同学进行电解水实验的装置图,据此回答: (1)、图中B端为电源的(填“正”或“负”)极。(2)、验证C试管中收集的气体的方法是。19. 如图是电解水的简易装置和电解水生成气体体积与时间的关系图。回答下列问题。
(1)、图中B端为电源的(填“正”或“负”)极。(2)、验证C试管中收集的气体的方法是。19. 如图是电解水的简易装置和电解水生成气体体积与时间的关系图。回答下列问题。 (1)、若甲试管生成A气体,则b应该接直流电源的极。(2)、把带火星的木条放入B气体中,能看到的现象是 , 说明B气体具有的化学性质是性。(3)、实验中得到的氢气和氧气的体积比略大于2: 1的原因可能是。20. 图甲、乙、丙三种固体物质的溶解度曲线,请回答下列问题.
(1)、若甲试管生成A气体,则b应该接直流电源的极。(2)、把带火星的木条放入B气体中,能看到的现象是 , 说明B气体具有的化学性质是性。(3)、实验中得到的氢气和氧气的体积比略大于2: 1的原因可能是。20. 图甲、乙、丙三种固体物质的溶解度曲线,请回答下列问题. (1)、t1℃时,甲、乙、丙的溶解度由大到小的顺序是。(2)、P点的含义 。(3)、t3℃时,在150g水中加入100g甲,形成溶液的质量为 g。(4)、t2℃时,甲、乙、丙三种物质的饱和溶液升温至t3℃后,三种溶液的溶质质量分数由大到小的顺序是。21. t℃时,100g某硝酸钾溶液在恒温条件下经过如图所示的变化。
(1)、t1℃时,甲、乙、丙的溶解度由大到小的顺序是。(2)、P点的含义 。(3)、t3℃时,在150g水中加入100g甲,形成溶液的质量为 g。(4)、t2℃时,甲、乙、丙三种物质的饱和溶液升温至t3℃后,三种溶液的溶质质量分数由大到小的顺序是。21. t℃时,100g某硝酸钾溶液在恒温条件下经过如图所示的变化。 (1)、甲烧杯中的溶液是 溶液(选填“饱和”或“不饱和”)。(2)、甲、乙、丙、丁四个烧杯中溶液的溶质质量分数一定相等的是 。(3)、t℃时该物质的溶解度为 g。22. 给下列物质归类:①食盐水②钡餐③牛奶④肥皂水⑤泥水⑥色拉油和汽油混合⑦血液⑧色拉油与水混合。属于溶液的是 , 属于乳浊液的是 。(填序号)23. 没有水,就没有生机勃勃的地球。科学小组为了探究水的组成,他们用如图所示电解水的装置进实验,回答下列问题:
(1)、甲烧杯中的溶液是 溶液(选填“饱和”或“不饱和”)。(2)、甲、乙、丙、丁四个烧杯中溶液的溶质质量分数一定相等的是 。(3)、t℃时该物质的溶解度为 g。22. 给下列物质归类:①食盐水②钡餐③牛奶④肥皂水⑤泥水⑥色拉油和汽油混合⑦血液⑧色拉油与水混合。属于溶液的是 , 属于乳浊液的是 。(填序号)23. 没有水,就没有生机勃勃的地球。科学小组为了探究水的组成,他们用如图所示电解水的装置进实验,回答下列问题: (1)、检验C试管中的气体的方法是;(2)、写出水电解的文字表示式:;(3)、这个实验说明:水是由组成;(4)、如图ABC能表示水电解过程的微观变化,过程的正确顺序是。
(1)、检验C试管中的气体的方法是;(2)、写出水电解的文字表示式:;(3)、这个实验说明:水是由组成;(4)、如图ABC能表示水电解过程的微观变化,过程的正确顺序是。 24. 氯化钠、硝酸钾、氢氧化钙三种物质的溶解度曲线如图一与图二所示。请回答:
24. 氯化钠、硝酸钾、氢氧化钙三种物质的溶解度曲线如图一与图二所示。请回答: (1)、要从含有少量硝酸钾的氯化钠溶液中,得到较纯净的氯化钠固体,可采用方法;(2)、在不改变溶质质量分数的情况下,把不饱和的氢氧化钙溶液变成饱和溶液的方法:;(3)、50℃时,分别向盛有10g水的两支试管中,加入等质量的氯化钠、硝酸钾两种固体物质,使其充分溶解,可观察到如图三所示的现象。A试管中溶解的物质是。若将温度都降到20℃,硝酸钾溶液中溶质的质量分数(填“>”、“<”或“=”)氯化钠溶液中溶质的质量分数。25. 小科同学在t℃下用某固体溶质的溶液做恒温蒸发结晶实验,如图所示,请回答下列问题:
(1)、要从含有少量硝酸钾的氯化钠溶液中,得到较纯净的氯化钠固体,可采用方法;(2)、在不改变溶质质量分数的情况下,把不饱和的氢氧化钙溶液变成饱和溶液的方法:;(3)、50℃时,分别向盛有10g水的两支试管中,加入等质量的氯化钠、硝酸钾两种固体物质,使其充分溶解,可观察到如图三所示的现象。A试管中溶解的物质是。若将温度都降到20℃,硝酸钾溶液中溶质的质量分数(填“>”、“<”或“=”)氯化钠溶液中溶质的质量分数。25. 小科同学在t℃下用某固体溶质的溶液做恒温蒸发结晶实验,如图所示,请回答下列问题: (1)、乙中的溶液属于溶液(填“饱和"或“不饱和");(2)、该固体溶质在t℃时的溶解度为;(3)、甲、乙、丙、丁中溶液溶质质量分数的大小关系是。26. 氯化钠和碳酸钠在不同温度时的溶解度如表所示。
(1)、乙中的溶液属于溶液(填“饱和"或“不饱和");(2)、该固体溶质在t℃时的溶解度为;(3)、甲、乙、丙、丁中溶液溶质质量分数的大小关系是。26. 氯化钠和碳酸钠在不同温度时的溶解度如表所示。温度/℃
10
20
30
40
溶解度/g
氯化钠
35.8
36.0
36.3
36.6
碳酸钠
12.2
21.8
39.7
53.2
(1)、20℃时,氯化钠的溶解度为克。(2)、若氯化钠固体中含有少量碳酸钠时,为获得较纯净的氯化钠固体,应采用的方法是。(选填“蒸发溶剂”或“冷却热饱和溶液”)(3)、将10℃时氯化钠和碳酸钠的饱和溶液均升温至40℃,所得的两种溶液的溶质质量分数大小关系是:氯化钠碳酸钠(选填“>”、“<”或“=”)。三、实验探究题
-
27. 烧杯中盛有一定质量、温度为80 ℃、溶质为M的溶液,将其置于室温环境中,测定不同温度时析出固体M的质量。测定结果记录如下表。
溶液的温度/℃
75
65
50
35
20
析出固体M的质量/g
0
0
2.0
4.5
8.4
若不考虑水蒸发对实验的影响,请回答下列问题。
(1)、65 ℃时,该溶液是否为饱和溶液?(填“是” “否”或“无法判断”)。(2)、将40 ℃时接近饱和的M溶液变成饱和溶液,下列方法中一定能达到目的的有(填序号)。①升温 ②降温 ③加溶质M ④加水 ⑤加另一种固体N ⑥恒温蒸发水 ⑦与40 ℃时M的饱和溶液混合(3)、20 ℃时,用固体粉末M和水配制100 g溶质质量分数为5% 的M溶液,必须用到的仪器有:托盘天平(带砝码盒)、烧杯、药匙、量筒(100 mL)、玻璃棒、。(4)、图2所示实验中,若加入物质b后,热水会突然沸腾,说明溶液的温度。继续向热水中加入相同质量的物质b,又看到沸腾现象,至烧杯中出现固体物质后,再继续加入相同质量的物质b,就看不到沸腾现象。请解释不再产生沸腾现象的原因。 28. 某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配50g质量分数为5%的氯化钠溶液。下图是同学们做粗盐提纯实验的操作示意图。
28. 某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配50g质量分数为5%的氯化钠溶液。下图是同学们做粗盐提纯实验的操作示意图。 (1)、粗盐提纯的操作顺序为(填选项) 、称量精盐并计算产率;A、①⑤③⑥②④ B、①⑤②③⑥④ C、①②③⑤⑥④ D、①⑤②⑥③④(2)、请找出上述操作中的一处错误。(3)、用已调平的天平称取提纯后的氯化钠固体时,发现指针偏左,接下来的操作是;(4)、经检测,配置好的溶液溶质质量分数偏大,其原因可能有 (填选项)。A、氯化钠固体仍然不纯 B、称量时所用砝码生锈 C、量取水时,仰视读数 D、将水倒入烧杯时,有少量水溅出29. 在“探究稀盐酸和稀硫酸的化学性质”实验中,小乐发现镁带与稀盐酸反应后的试管内出现了灰白色沉淀。
(1)、粗盐提纯的操作顺序为(填选项) 、称量精盐并计算产率;A、①⑤③⑥②④ B、①⑤②③⑥④ C、①②③⑤⑥④ D、①⑤②⑥③④(2)、请找出上述操作中的一处错误。(3)、用已调平的天平称取提纯后的氯化钠固体时,发现指针偏左,接下来的操作是;(4)、经检测,配置好的溶液溶质质量分数偏大,其原因可能有 (填选项)。A、氯化钠固体仍然不纯 B、称量时所用砝码生锈 C、量取水时,仰视读数 D、将水倒入烧杯时,有少量水溅出29. 在“探究稀盐酸和稀硫酸的化学性质”实验中,小乐发现镁带与稀盐酸反应后的试管内出现了灰白色沉淀。提出问题:灰白色沉淀是什么物质?
提出猜想:小乐在老师指导下,猜想灰白色沉淀是下列物质中的一种或几种:
①镁; ②氯化镁; ③氢氧化镁; ④碱式氯化镁[Mg(OH)Cl]。
老师肯定了小乐的猜想,并鼓励他继续进行实验探究。
实验探究:
步骤一:将上述镁带与稀盐酸反应后试管内的物质过滤,得到滤液和灰白色滤渣。
步骤二:取滤液于试管中,加入适量的氯化镁粉末,粉末全部溶解。
步骤三:取少量灰白色滤渣于试管中,加入适量稀盐酸,沉淀全部溶解,无其他现象。
步骤四:将剩余滤渣用蒸馏水充分洗涤。取洗涤后的滤渣于试管中,加入过量稀硝酸,滤渣全部溶解,再加入硝酸银溶液,有白色沉淀产生。
实验反思及结论:
(1)、从步骤二可知,灰白色沉淀不可能是氯化镁,因为滤液是氯化镁的(填“饱和”或“不饱和”)溶液。(2)、从步骤三可知,该沉淀中没有。(3)、步骤四中滤渣用蒸馏水充分洗涤是为了。(4)、根据实验探究可知,该反应产生的灰白色沉淀中一定含有。30. 如图是配制50克质量分数为5%的氯化钠溶液的操作过程示意图。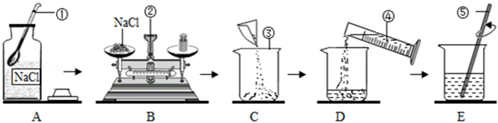 (1)、B操作,在称量中发现指针偏向右边,接下来的操作是 。(2)、E操作中玻璃棒的作用是 。(3)、如果配制过程中出现以下情况,可能导致所配溶液的溶质质量分数偏小的是 。A、 A、所用氯化钠药品不纯 B、配完后将溶液转移至试剂瓶时洒出了一些 C、量取水时仰视读数 D、将量好的水从量筒里倒入烧杯时,洒出一些水31. 某科学兴趣小组的同学做粗盐(含有不溶性杂质)提纯实验,并用所得精盐配制50克5%的氯化钠溶液,请回答下列问题:
(1)、B操作,在称量中发现指针偏向右边,接下来的操作是 。(2)、E操作中玻璃棒的作用是 。(3)、如果配制过程中出现以下情况,可能导致所配溶液的溶质质量分数偏小的是 。A、 A、所用氯化钠药品不纯 B、配完后将溶液转移至试剂瓶时洒出了一些 C、量取水时仰视读数 D、将量好的水从量筒里倒入烧杯时,洒出一些水31. 某科学兴趣小组的同学做粗盐(含有不溶性杂质)提纯实验,并用所得精盐配制50克5%的氯化钠溶液,请回答下列问题:实验一:粗盐提纯实验
 (1)、粗盐提纯实验的操作顺序为;(填序号)(2)、写出以上操作中出现的错误;(写出一条即可)(3)、操作④中用玻璃棒搅拌的作用是;(4)、粗盐提纯实验的最后称量精盐并计算产率。若此实验精盐的产率偏高(产率=所得晶体的质量÷所取样品的质量×100%),则可能的原因是 ;(填字母);A、过滤时滤纸有破损 B、蒸发时有固体溅出 C、溶解含泥沙的粗食盐时,加入的水量不足 D、所得的氯化钠晶体没有烘干,带有水分 E、过滤后滤纸是湿的,纸上含有溶液中的食盐(5)、实验二:用提纯得到的精盐配制50克5%的氯化钠溶液。
(1)、粗盐提纯实验的操作顺序为;(填序号)(2)、写出以上操作中出现的错误;(写出一条即可)(3)、操作④中用玻璃棒搅拌的作用是;(4)、粗盐提纯实验的最后称量精盐并计算产率。若此实验精盐的产率偏高(产率=所得晶体的质量÷所取样品的质量×100%),则可能的原因是 ;(填字母);A、过滤时滤纸有破损 B、蒸发时有固体溅出 C、溶解含泥沙的粗食盐时,加入的水量不足 D、所得的氯化钠晶体没有烘干,带有水分 E、过滤后滤纸是湿的,纸上含有溶液中的食盐(5)、实验二:用提纯得到的精盐配制50克5%的氯化钠溶液。称量氯化钠时,若发现天平指针向左偏,则应怎么处理?;
(6)、经检测,所配制的氯化钠溶液的溶质质量分数偏小,其可能原因是 (填字母)。A、所用的氯化钠固体中含有杂质 B、称量时砝码忘垫质量相同的纸片 C、量取水时,仰视读数 D、将水倒入烧杯时,有少量水溅出 E、将氯化钠固体倒入烧杯时,还有部分氯化钠固体粘在纸上 F、将配制好的溶液转移进试剂瓶时,有溶液洒落四、解答题
-
32. 小茗同学将200g质量分数为20%的硝酸钾溶液做如图操作,请通过计算回答以下问题:
 (1)、往甲杯溶液加入5g硝酸钾固体,完全溶解后,溶液的溶质质量分数为多少?(结果保留到0.1%)(2)、若将乙杯溶液稀释为溶质质量分数为5%的硝酸钾溶液,则需加水多少克?33. 下表为硫酸密度与硫酸溶液中的溶质的质量分数对照表(20℃)有一物块A,其体积为500cm3 , 密度为1.30g/cm3。一只容器中盛有某硫酸溶液5千克,将物块A放入该溶液中静止后如图所示,此时物块A有2/15的体积露出液面。
(1)、往甲杯溶液加入5g硝酸钾固体,完全溶解后,溶液的溶质质量分数为多少?(结果保留到0.1%)(2)、若将乙杯溶液稀释为溶质质量分数为5%的硝酸钾溶液,则需加水多少克?33. 下表为硫酸密度与硫酸溶液中的溶质的质量分数对照表(20℃)有一物块A,其体积为500cm3 , 密度为1.30g/cm3。一只容器中盛有某硫酸溶液5千克,将物块A放入该溶液中静止后如图所示,此时物块A有2/15的体积露出液面。
密度(g/mL)
1.01
1.07
1.14
1.22
1.30
1.40
1.50
1.61
1.73
1.81
1.84
质量分数(%)
1
10
20
30
40
50
60
70
80
90
98
(1)、求物块A静止时受到的浮力大小?(2)、求这种硫酸溶液的溶质质量分数是多少?(3)、要使物块A全部浸入溶液中,至少需要往容器中加水多少千克?(容器足够大,加水后溶液不溢出。)34. 工业上侯氏制碱法得到的纯碱产品中常含有少量的氯化钠杂质,化验员要对每批次的纯碱产品进行检验。实验中取30g纯碱样品,平均分成五份(每等分6克)依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应后都进行称量,得到的实验数据如下表:(假定反应产生气体全部逸出,其它气体的挥发忽略不计)第一次
第二次
第三次
第四次
第五次
加入纯碱样品的质量/g
6
6
6
6
6
电子天平的示数/g
163.8
167.6
171.4
177.4
183.4
(1)、第二次加入纯碱样品充分反应后,连同第一次实验共生成二氧化碳克;第四次加入纯碱样品时,是否还能发生化学反应?。
(2)、计算纯碱样品中碳酸钠的质量分数。(计算结果精确到0.1%)(3)、计算盐酸溶质质量分数(计算结果精确到0.1%)35. 黄铜是锌和铜的合金,为了测定某粉末状黄铜样品中锌的质量分数,取该合金样品30g放入烧杯中,然后将200g稀硫酸平均分四份依次加入该烧杯中,每次均充分反应,实验数据如下:
请计算:
(1)、稀硫酸的质量分数?(2)、第二次加入稀硫酸充分反应后,所得溶液中溶质质量分数为多少?(精确到0.1%)36. 自热火锅是近年来的网红食品,使用时只需要将自热包放在水中就可实现给火锅加热。自热包中的主要成分是:氧化钙,铝粉,铁粉,碳酸钠,硅藻泥,活性炭等。央视曝光自热火锅加热时会释放氢气,建议不要再较小密闭的空间使用,以免发生爆炸事故。小明涉及了一下装置测量自热火锅使用时产生氢气的量。将一个火锅自热包的1/10加入到A装置中,先通足量的氮气,然后加入足量的水样品反应结束后,再次通入氮气,通气结束后测得D装置增重9g。回答下列问题: (1)、装置 B 的作用为 ;装置 E 的作用为。(2)、已知氢气在空气中体积比达到4%-75.6%时,遇明火会发生爆炸,标准大气压下氢气的密度是0.089g/L,那么在一个体积为10m3的密闭空间力吃自热火锅,房间内气压为标准大气压,可能发生爆炸吗?通过计算说明。(3)、小华认为央视新闻有一定的科学性,是小明的检测结果偏小了,请你写出检测结果偏小的理由。
(1)、装置 B 的作用为 ;装置 E 的作用为。(2)、已知氢气在空气中体积比达到4%-75.6%时,遇明火会发生爆炸,标准大气压下氢气的密度是0.089g/L,那么在一个体积为10m3的密闭空间力吃自热火锅,房间内气压为标准大气压,可能发生爆炸吗?通过计算说明。(3)、小华认为央视新闻有一定的科学性,是小明的检测结果偏小了,请你写出检测结果偏小的理由。五、综合说理题
-
37. 西湖龙井茶素有“绿茶皇后”之称,具有独特的功效及作用。冲泡龙井茶很有讲究,方法多种多样,“上投法是其中一种,具体过程如下:

⒈往玻璃杯中倒入85"C左右的沸水后,再放入少许龙井茶叶。
⒉等待龙井茶叶一片一片慢慢下沉。
⒊龙井茶叶在茶杯中慢慢舒展,上 下沉浮。.
⒋静待片刻,龙井茶叶溶出茶汤后,汤明色绿,茶香四溢,即可品尝。
请结合所学知识,解释此泡茶过程中的现象。