山东省泰安市新泰市2022-2023学年九年级上学期期中化学试题
试卷更新日期:2022-12-15 类型:期中考试
一、单选题
-
1. 海洋是重要的资源,利用海水可以得到许多产品.①海水“晒盐”;②海水“制碱”;③海水“淡化”;④从海水中提取镁.其中主要利用化学变化的是( )A、全部 B、①②④ C、只有② D、只有②④2. 生活中属于溶液的是( )A、草莓酱 B、蒸馏水 C、生理盐水 D、玉米糊3. 下列物质名称与化学式对应关系错误的是( )A、烧碱—NaOH B、纯碱—Na2CO3 C、小苏打—NaHCO3 D、熟石灰—CaO4. 动手实验是学习化学的必要途径,如图所示的实验操作中,正确的是( )A、
 稀释浓硫酸
B、
稀释浓硫酸
B、 测定溶液pH
C、
测定溶液pH
C、 检查装置气密性
D、
检查装置气密性
D、 称量固体
5. 下图是物质X溶于水中发生解离的微观示意图,其中能说明X是一种酸的是( )A、
称量固体
5. 下图是物质X溶于水中发生解离的微观示意图,其中能说明X是一种酸的是( )A、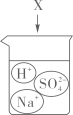 B、
B、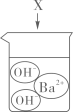 C、
C、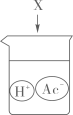 D、
D、 6. 下列溶液在空气中敞口久置,因发生化学变化导致溶液质量减小的是( )A、浓盐酸 B、浓硫酸 C、石灰水 D、烧碱溶液7. 下列说法中正确的是( )A、不慎将氢氧化钠沾到皮肤上,要用大量的水冲洗,再涂上硼酸溶液 B、为了方便学习,可将实验室剩余的药品带回家做实验 C、蚊虫叮咬后涂抹NaOH溶液减轻痛痒 D、发现家里燃气泄漏,立即打开排气扇8. 实验是学习化学的重要途径。在实验探究过程中要认真观察并记录实验现象,下列实验现象描述正确的是( )A、打开浓盐酸的瓶盖,看到瓶口有白烟冒出 B、将铁钉放入稀盐酸,有气体产生,溶液变为浅绿色 C、将二氧化碳通入氢氧化钠溶液产生白色沉淀 D、将溶有二氧化碳的石蕊试液加热煮沸,溶液由红色变为无色9. 如图图示为生活中常见物质的pH,下列说法正确的是( )
6. 下列溶液在空气中敞口久置,因发生化学变化导致溶液质量减小的是( )A、浓盐酸 B、浓硫酸 C、石灰水 D、烧碱溶液7. 下列说法中正确的是( )A、不慎将氢氧化钠沾到皮肤上,要用大量的水冲洗,再涂上硼酸溶液 B、为了方便学习,可将实验室剩余的药品带回家做实验 C、蚊虫叮咬后涂抹NaOH溶液减轻痛痒 D、发现家里燃气泄漏,立即打开排气扇8. 实验是学习化学的重要途径。在实验探究过程中要认真观察并记录实验现象,下列实验现象描述正确的是( )A、打开浓盐酸的瓶盖,看到瓶口有白烟冒出 B、将铁钉放入稀盐酸,有气体产生,溶液变为浅绿色 C、将二氧化碳通入氢氧化钠溶液产生白色沉淀 D、将溶有二氧化碳的石蕊试液加热煮沸,溶液由红色变为无色9. 如图图示为生活中常见物质的pH,下列说法正确的是( ) A、柠檬汁的酸性比纯鲜牛奶的酸性弱 B、肥皂水可以使紫色石蕊溶液变蓝 C、厕所清洁剂与厨房清洁剂混用,清洁效果更好 D、厕所清洁剂不会腐蚀大理石地面10. 氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图如下。下列说法错误的是( )
A、柠檬汁的酸性比纯鲜牛奶的酸性弱 B、肥皂水可以使紫色石蕊溶液变蓝 C、厕所清洁剂与厨房清洁剂混用,清洁效果更好 D、厕所清洁剂不会腐蚀大理石地面10. 氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图如下。下列说法错误的是( )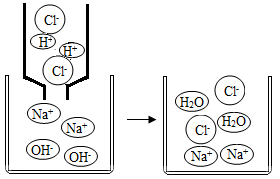 A、盐酸中存在的微粒有水分子和氯化氢分子 B、该反应的微观实质是H+和OH-结合生成水分子 C、Na+和Cl-在该反应过程中没有被消耗 D、恰好完全反应时,溶液呈中性11. 下列变化不能通过一步反应就实现的是( )A、Cu→CuO B、Fe2O3→FeSO4 C、Na2CO3→CaCO3 D、CaO→Ca(OH)212. 工业上将过氧化氢转化为固态的过碳酸钠晶体(2Na2CO3·3H2O2),该晶体具有碳酸钠和过氧化氢的双重性质。接触下列物质不会使过碳酸钠失效的是( )A、氯化钠 B、氯化钡 C、二氧化锰 D、盐酸13. 如图所示,装置气密性良好,弹簧夹处于关闭状态。挤压胶头滴管加入液体,稍后打开弹簧夹,能使气球a明显鼓起的是( )
A、盐酸中存在的微粒有水分子和氯化氢分子 B、该反应的微观实质是H+和OH-结合生成水分子 C、Na+和Cl-在该反应过程中没有被消耗 D、恰好完全反应时,溶液呈中性11. 下列变化不能通过一步反应就实现的是( )A、Cu→CuO B、Fe2O3→FeSO4 C、Na2CO3→CaCO3 D、CaO→Ca(OH)212. 工业上将过氧化氢转化为固态的过碳酸钠晶体(2Na2CO3·3H2O2),该晶体具有碳酸钠和过氧化氢的双重性质。接触下列物质不会使过碳酸钠失效的是( )A、氯化钠 B、氯化钡 C、二氧化锰 D、盐酸13. 如图所示,装置气密性良好,弹簧夹处于关闭状态。挤压胶头滴管加入液体,稍后打开弹簧夹,能使气球a明显鼓起的是( )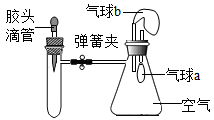
试管内物质
滴管内物质
A
氢氧化钠固体
水
B
二氧化碳气体
氢氧化钠溶液
C
氯化钡溶液
稀硫酸
D
铁片
稀盐酸
A、A B、B C、C D、D14. 打开保险柜,同学们发现一瓶无色透明的液体。对其中可能存在的离子组合,推测合理的是( )A、Cu2+、Na+、OH-、Cl- B、Ba2+、K+、、 C、K+、Mg2+、、Cl- D、Na+、Ca2+、、15. 下列各组溶液混合后,能发生化学反应且溶液总质量不变的是( )A、氢氧化钠溶液和稀硫酸 B、硫酸铜溶液和氯化钡溶液 C、氢氧化钾溶液和氯化钠溶液 D、碳酸钠溶液和稀盐酸16. 小强同学为了区别稀盐酸和稀硫酸,设计了如图所示的四组实验方案(两支试管中分别盛有这两种溶液),其中能达到实验目的是( )A、 B、
B、 C、
C、 D、
D、 17. 某校化学小组在利用硫酸和氢氧化钠两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图所示。下列说法正确的是( )
17. 某校化学小组在利用硫酸和氢氧化钠两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图所示。下列说法正确的是( ) A、图中c点所示溶液呈碱性 B、图中a点所示溶液中,含有的溶质是Na2SO4和H2SO4 C、该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸溶液的烧杯中 D、由c点到d点的变化过程中没有发生化学反应18. 归纳推理是化学学习中常用的思维方法,下列推理正确的是( )A、碱溶液能使酚酞溶液变红,那么能使酚酞溶液变红的溶液一定是碱溶液 B、中和反应都生成盐和水,生成盐和水的不一定是中和反应 C、复分解反应有沉淀、气体或水生成,则有沉淀、气体或水生成的反应都是复分解反应 D、碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐19. 除去下列各物质中含有的少量杂质,所选用的试剂或操作方法能达到目的的是( )
A、图中c点所示溶液呈碱性 B、图中a点所示溶液中,含有的溶质是Na2SO4和H2SO4 C、该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸溶液的烧杯中 D、由c点到d点的变化过程中没有发生化学反应18. 归纳推理是化学学习中常用的思维方法,下列推理正确的是( )A、碱溶液能使酚酞溶液变红,那么能使酚酞溶液变红的溶液一定是碱溶液 B、中和反应都生成盐和水,生成盐和水的不一定是中和反应 C、复分解反应有沉淀、气体或水生成,则有沉淀、气体或水生成的反应都是复分解反应 D、碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐19. 除去下列各物质中含有的少量杂质,所选用的试剂或操作方法能达到目的的是( )选项
物质(杂质)
所用试剂或操作方法
A
CO2(H2O)
将混合气体通过足量的氢氧化钠溶液
B
KCl溶液(K2SO4)
加入适量的Ba(NO3)2溶液,过滤
C
NaOH溶液(Na2CO3)
加入过量的CaCl2溶液,过滤
D
CaCl2溶液(盐酸)
加入过量的CaCO3 , 过滤
A、A B、B C、C D、D20. 下列四个图像的变化趋势,能正确描述对应操作的是( )A、 某温度下,将一定量不饱和的氯化钠溶液恒温蒸发
B、
某温度下,将一定量不饱和的氯化钠溶液恒温蒸发
B、 将浓盐酸敞口放置在空气中
C、
将浓盐酸敞口放置在空气中
C、 高温煅烧一定质量的石灰石
D、
高温煅烧一定质量的石灰石
D、 向pH=13的氢氧化钠溶液中不断加入水
向pH=13的氢氧化钠溶液中不断加入水
二、填空题
-
21. 请你用所学知识,完成下列问题。(1)、生活处处有化学。
①自制饮料时,为了使冰糖尽快溶解,可采用的方法之一是。
②洁厕剂中的稀盐酸可用来除锈,反应的化学方程式为。
③区分食醋(酸性)和酱油,除品尝外,还可选用厨房中的来鉴别。
(2)、2022年3月,王亚平在天宫课堂实验中将油和水混合振荡,得到了不分层的油水混合物,生活中通过洗洁精的现象也可以得到油水混合物。(3)、如图是a、b、c三种固体物质的溶解度曲线,回答下列问题:
①在℃时,a、c两种物质的溶解度相等。
②在t2℃时,向盛有30ga物质的烧杯中加入50g水,充分溶解后,所得溶液的质量为 g。
③若a物质中混有少量b物质,最好采用(填“降温结晶”或“蒸发结晶”)的方法提纯a。
④将t2℃时,a、b、c三种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数由大到小的顺序为。
22. 归纳是学习的重要方法,小红在复习酸和碱的性质时,归纳出下列酸和碱的性质。 (1)、根据图1回答下列问题。
(1)、根据图1回答下列问题。①若X遇稀硫酸变红色,则X为。
②稀硫酸与BaCl2溶液反应的化学方程式是。
③稀硫酸与CuO反应的现象为。
(2)、根据图2回答下列问题。①二氧化碳和一氧化碳都是非金属氧化物,二氧化碳能和氢氧化钠反应,一氧化碳却不能,造成此性质差异的微观原因是。
②小明将氢氧化钠溶液加入硫酸铜溶液中,看到的现象是: , 发生的化学方程式 , 体现了图2中的性质(填序号“①”“②”、“③”或“④”)
三、综合题
-
23. 海洋是巨大的资源宝库。“筑梦”学习小组模拟化工厂生产流程,利用海水制取纯碱和金属镁,设计方案如图所示。请回答下列问题。
 (1)、流程I为海水晒盐的过程。结晶池中析出晶体后的母液是氯化钠的(填“饱和”或“不饱和”)溶液。(2)、流程II为除去粗盐水中的CaC2、MgCl2和Na2SO4、和杂质。加入下列3种过量试剂的顺序依次可以是____(填字母序号);A、Na2CO3、NaOH、BaCl2 B、BaCl2、Na2CO3、NaOH C、NaOH、BaCl2、Na2CO3(3)、流程III为海水“制碱”。制取小苏打(碳酸氢钠)通入的气体X的化学式为;在该流程中,是先向饱和食盐水中通入过量的氨气,然后再通入过量的二氧化碳,先通入过量氨气的目的是。(4)、流程IV为海水提镁。氢氧化镁和盐酸反应的化学方程式为。海水中本来就有氯化镁,不直接将海水进行电解来制取金属镁,而是经过了加石灰乳、盐酸等过程,目的是。24. “粗盐中难溶性杂质的去除”和“一定溶质质量分数的氯化钠溶液的配制”是两个重要的化学实验。
(1)、流程I为海水晒盐的过程。结晶池中析出晶体后的母液是氯化钠的(填“饱和”或“不饱和”)溶液。(2)、流程II为除去粗盐水中的CaC2、MgCl2和Na2SO4、和杂质。加入下列3种过量试剂的顺序依次可以是____(填字母序号);A、Na2CO3、NaOH、BaCl2 B、BaCl2、Na2CO3、NaOH C、NaOH、BaCl2、Na2CO3(3)、流程III为海水“制碱”。制取小苏打(碳酸氢钠)通入的气体X的化学式为;在该流程中,是先向饱和食盐水中通入过量的氨气,然后再通入过量的二氧化碳,先通入过量氨气的目的是。(4)、流程IV为海水提镁。氢氧化镁和盐酸反应的化学方程式为。海水中本来就有氯化镁,不直接将海水进行电解来制取金属镁,而是经过了加石灰乳、盐酸等过程,目的是。24. “粗盐中难溶性杂质的去除”和“一定溶质质量分数的氯化钠溶液的配制”是两个重要的化学实验。 (1)、粗盐中难溶性杂质去除的主要操作顺序为(填序号)。C中玻璃棒搅拌的作用是。(2)、用提纯得到的精盐配制100g溶质质量分数为6%的氯化钠溶液。
(1)、粗盐中难溶性杂质去除的主要操作顺序为(填序号)。C中玻璃棒搅拌的作用是。(2)、用提纯得到的精盐配制100g溶质质量分数为6%的氯化钠溶液。①该实验中量取的水的体积应选用量筒的规格为。
A.10mL B.50mL C.100mL
②在称量精盐过程中发现天平指针向左偏转,接下来的操作是(填序号)。
A.向右移动游码 B.减少精盐 C.增加砝码
(3)、配制完成后经检测发现所得溶液溶质质量分数小于6%,可能的原因是(填序号)。①量取水时仰视读数 ②转移固体时损失 ③量好的水转移时洒出 ④配好的溶液洒出一部分
25. 现实验室有一瓶久置的NaOH溶液,为检验其是否变质并确定溶液中的溶质是什么,某兴趣小组同学设计实验并进行验证。(1)、请你用化学方程式写出NaOH溶液变质的原因:(2)、【提出问题】待测液中的溶质是什么?【查阅资料】氯化钙溶液呈中性。
【作出猜想】
猜想一:NaOH,猜想二:Na2CO3 , 猜想三:
(3)、【设计方案】实验方案(一):取少量待测溶液于试管中,向其中滴加无色酚酞溶液,若溶液变红,则说明该待测溶液没有变质,猜想一正确。
请你判断该方案是否合理 , 理由是
实验方案(二):取少量待测溶液于试管中,先向其中加入足量的澄清石灰水,再加入无色酚酞,若观察到先有白色沉淀产生,后溶液变红的现象,则说明猜想三正确。
请你写出发生的方程式。小刘同学提出异议,原因是。
实验方案(三):取少量待测溶液于试管中,先向其中加入足量的CaCl2溶液,再加入无色酚酞,若观察到的现象,则说明猜想三正确。
【实验结论】该溶液为部分变质的NaOH溶液。
(4)、【反思交流】CO2与NaOH溶液反应没有明显现象,除了选用试剂验证产物碳酸钠的存在能证明两者发生反应外,是否有其他办法证明两者反应呢?甲同学用下图所示装置探究二氧化碳能否与氢氧化钠发生反应。他向盛满二氧化碳的软塑料瓶中倒入10%的氢氧化钠溶液50mL,迅速拧紧瓶盖振荡,观察到软塑料瓶变瘪。由此得出结论:二氧化碳能与氢氧化钠发生反应。乙同学认为甲同学的实验方案不严谨,他建议补做一个对比实验:将甲同学实验中的氢氧化钠溶液换成 , 实验步骤与甲同学完全相同,对比两个实验的现象得出结论。

四、计算题
