四川省绵阳市2022-2023学年高一上学期学生学业发展指导(期中)测试化学试题
试卷更新日期:2022-12-14 类型:期中考试
一、单选题
-
1. 化学与生活密切相关。下列叙述错误的是( )A、电影放映机到银幕间形成光柱是由于气溶胶存在 B、节日焰火的五彩缤纷来自某些金属元素的焰色 C、维生素C能将还原为使人体更易吸收 D、漂白粉与盐酸可混合使用以提高杀菌消毒效果2. 下列过程中,未发生氧化还原反应的是( )A、燃气灶燃烧天然气炒菜 B、盐酸滴在大理石灶台上产生气泡 C、漂白粉敞放在空气中变质 D、留有水滴的铁锅出现红棕色斑迹3. 当光束通过下列物质时,会出现丁达尔效应的是( )
①Fe(OH)3胶体 ②水 ③蔗糖溶液 ④FeCl3溶液 ⑤云、雾
A、①② B、③④ C、①⑤ D、④⑤4. 下列各组离子能在水溶液中大量共存的是( )A、 B、 C、 D、5. 下列物质中,不能由单质直接化合生成的是( )A、 B、 C、 D、6. 在野外工作时,可用氢化钙来制氢气,发生的反应为 , 已知氢化钙中钙元素的化合价为+2,关于该反应的下列说法中错误的是( )A、既不是置换反应,又不是复分解反应 B、CaH2是还原剂,H2O中的氢部分被还原 C、H2既是氧化产物,又是还原产物 D、要得到44.8 L氢气需要氢化钙8.4 g7. 下列关于钠的说法错误的是( )A、钠的密度比水小,比煤油大 B、钠失火时,应该用沙土盖灭 C、钠与水反应的离子方程式为Na+H2O=Na++OH-+H2↑ D、取用钠时,所需用品一般有小刀、镊子、滤纸、玻璃片8. 分类是认识和研究物质及其变化的一种常用的科学方法。下列物质分类的正确组合是( )选项
混合物
碱
酸
碱性氧化物
酸性氧化物
A
氨水
烧碱
HNO3
CaO
CO2
B
空气
纯碱
H2SO4
MgO
P2O5
C
胆矾
熟石灰
NaHSO4
Na2O2
SO2
D
液氯
氢氧化铁
HclO
K2O
CO
A、A B、B C、C D、D9. NA为阿伏加德罗常数的值,下列叙述正确的是( )A、1.12 LH2中含有的氢原子数为0.1NA B、标准状况下,11.2 LCl2含有的分子数为0.5NA C、常温下,0.5 mol/LCaCl2溶液中含有的离子数为1.5NA D、7.8 g的Na2O2与H2O完全反应时转移的电子数为0.2NA10. 下列反应的离子方程式正确的是( )A、铁屑与稀硫酸反应: B、除去溶液中少量的 C、将碳酸钡固体加入稀盐酸中: D、氯化铜溶液中滴入澄清的石灰水:11. 黑火药是我国古代四大发明之一,已知黑火药的爆炸反应为:下列说法正确的是( )
A、被氧化的元素是碳 B、每生成 , 反应中转移电子 C、氧化剂只有 D、还原产物与氧化产物体积之比为1:312. 某学习小组设计下图所示实验来比较碳酸钠和碳酸氢钠的热稳定性,装置中盛装药品错误的是( )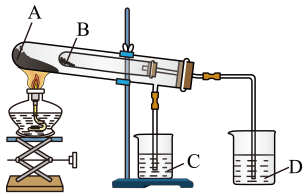 A、Na2CO3 B、NaHCO3 C、澄清石灰水 D、NaOH溶液13. 咖啡含有咖啡因(化学式为C8H10N4O2)。常温下,如果一杯体积为250 mL的咖啡中含有咖啡因0.194 g,则关于这种咖啡因溶液的下列说法中,正确的是( )A、可用0.194 g咖啡颗粒溶于250 mL水得到 B、其中咖啡因的物质的量浓度为0.04 mol/L C、所含咖啡因的分子数为6.02×1020 D、所含氢原子的数目为6.02×102414. 某白色粉末可能含有Ba(NO3)2、CaCl2、K2CO3、Na2SO4 , 现进行以下实验:
A、Na2CO3 B、NaHCO3 C、澄清石灰水 D、NaOH溶液13. 咖啡含有咖啡因(化学式为C8H10N4O2)。常温下,如果一杯体积为250 mL的咖啡中含有咖啡因0.194 g,则关于这种咖啡因溶液的下列说法中,正确的是( )A、可用0.194 g咖啡颗粒溶于250 mL水得到 B、其中咖啡因的物质的量浓度为0.04 mol/L C、所含咖啡因的分子数为6.02×1020 D、所含氢原子的数目为6.02×102414. 某白色粉末可能含有Ba(NO3)2、CaCl2、K2CO3、Na2SO4 , 现进行以下实验:①将部分粉末加入水中,振荡,有白色沉淀生成;
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生
③取少量②的溶液滴入AgNO3溶液,有白色沉淀生成。
根据上述实验现象,下列说法错误的是( )
A、原白色粉末中一定含有CaCl2、K2CO3 B、原白色粉末中可能含有Ba(NO3)2 C、原白色粉末中一定没有Na2SO4 D、②中发生的离子反应一定只有CaCO3+2H+=Ca2++H2O+CO2↑二、填空题
-
15. 生产、生活中处处有化学,利用所学化学知识回答下列问题。(1)、在潜水艇和消防员的呼吸面具中,与二氧化碳反应的化学方程式为;从氧化剂和还原剂的角度分析,在这个反应中的作用是(2)、铝盐,铁盐可以作净水剂,的电离方程式是;将饱和溶液滴入沸水制得的胶体中,分散剂是。该分散系区别于其他分散系的本质特征是。(3)、金属钠着火时不能用水灭火,原因是。(4)、阅读下列科普短文并填空。
84消毒液①和医用酒精②是人们生活中常用的消毒剂,84消毒液的名称源于北京某医院在1984年研制成功的一种高效含氯消毒液。它可用③与溶液④反应制得,其主要成分为⑤、⑥,是无色或淡黄色液体,人们主要利用84消毒液中的氧化性进行消毒。医用酒精中,乙醇的体积分数通常为75%。过高浓度的乙醇⑦溶液会使病毒表面的蛋白质⑧迅速凝结,形成一层保护膜,减弱消毒效果。过低浓度的乙醇溶液不能使蛋白质变性,同样不能获得很好的消毒效果。
在上述短文标有序号的物质中,属于混合物的是(填序号,下同);属于电解质的是。用上述方法制备84消毒液时,发生反应的离子方程式为
三、综合题
-
16. 现有W、X、Y、Z四种元素,W的单质可以在Z的单质中燃烧,产生苍白色火焰,生成WZ气体;Y的单质在气体X2中燃烧生成淡黄色的Y2X2固体。回答下列问题:(1)、W、X、Y、Z四种元素中,金属元素的符号为 , 其原子的最外层上有个电子。(2)、Y2X2与W2X反应的化学方程式为 , 从物质类别来看,该反应所涉及的四种物质可以分为哪两类? 。(3)、将一小块Y的单质放入W2X中,可观察到一系列有趣的现象。从固体熔为光亮的小球并浮于液面上,可以推断出Y单质的性质是。(4)、Z的单质溶于W2X中,所得溶液中存在的分子有 , 溶液受光照后pH逐渐减小,其原因用化学方程式表示为。17. 某同学用如图装置制取Cl2并探究其性质,回答下列问题:
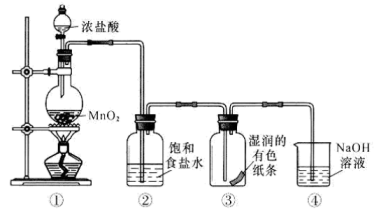 (1)、装置①用于制取Cl2 , 反应的化学方程式是。(2)、装置②的作用是 , 装置③中的现象是。(3)、装置④的作用是 , 如果溶液温度较高,可能发生反应。该反应中,被氧化的Cl原子和被还原的Cl原子的物质的量之比为 , 每生成1 mol的NaClO3 , 转移电子的物质的量为。(4)、工业上利用下列反应原理检查氯气管道是否漏气,用双线桥标出电子转移的情况。。3Cl2+8NH3=6NH4Cl+N2(5)、某运输液氯的槽罐车发生泄漏,如果当时你在现场,你应该往哪里撤离?。(填“高坡上”或“低洼处”)。消防官兵赶到现场后。立即向弥漫氯气的空中喷洒石灰水,写出有关物质之间发生反应的化学方程式:。18. 我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。如图为联合制碱法的主要过程(部分物质已略去)
(1)、装置①用于制取Cl2 , 反应的化学方程式是。(2)、装置②的作用是 , 装置③中的现象是。(3)、装置④的作用是 , 如果溶液温度较高,可能发生反应。该反应中,被氧化的Cl原子和被还原的Cl原子的物质的量之比为 , 每生成1 mol的NaClO3 , 转移电子的物质的量为。(4)、工业上利用下列反应原理检查氯气管道是否漏气,用双线桥标出电子转移的情况。。3Cl2+8NH3=6NH4Cl+N2(5)、某运输液氯的槽罐车发生泄漏,如果当时你在现场,你应该往哪里撤离?。(填“高坡上”或“低洼处”)。消防官兵赶到现场后。立即向弥漫氯气的空中喷洒石灰水,写出有关物质之间发生反应的化学方程式:。18. 我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。如图为联合制碱法的主要过程(部分物质已略去)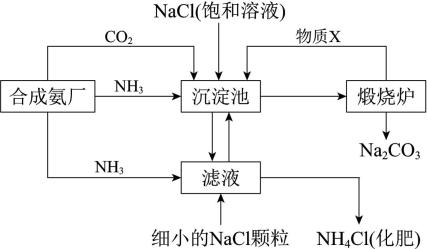
已知:i.NH3溶于水生成碱,与酸反应生成盐,如NH3+HNO3=NH4NO3
ⅱ.有关物质的溶解度如下表:
物质
NaCl
NH4HCO3
NaHCO3
NH4Cl
20℃溶解度/g
36.0
21.7
9.6
37.2
回答下列问题:
(1)、“沉淀池”中发生了化合反应和复分解反应,其化学方程式为:NH3+CO2+H2O=NH4HCO3﹑(2)、下列说法正确的是____(填序号字母)A、“沉淀池”中有NaHCO3析出,因为该条件下NaHCO3的溶解度最小 B、“滤液”中主要含有NaCl、Na2CO3和NH4Cl C、设计循环的目的是提高原料的利用率(3)、“煅烧炉”中发生的是分解反应,化学方程式为物质X是(填化学式)(4)、某小组同学探究Na2CO3与盐酸的反应。取1.06 g Na2CO3固体加水溶解后,配成100 mL溶液,则Na2CO3的物质的量浓度为;向其中滴加稀盐酸,开始无气泡,继续滴加,产生气泡,反应的离子方程式为:、。19. 某种胃药的有效成分为碳酸钙,测定每片中碳酸钙含量的操作如下(设药片中的其他成分不与盐酸或氢氧化钠反应)①加入稀盐酸
②配制稀盐酸和氢氧化钠溶液
③取一粒药片(药片质量相同,均为),研碎后加入蒸馏水
④以酚酞为指示剂,用溶液中和过量的稀盐酸,记录所消耗溶液的体积V
请回答下列问题:
(1)、测定过程的正确操作顺序为(填序号)。上述第②步操作要配制溶液,所需固体的质量为g(2)、若某次实验需重复测定4次。实验室现有四种规格的容量瓶,则配制稀盐酸应选用的容量瓶规格最好为 , 理由是。(3)、下列情况中,会使所配溶液浓度偏高的是____(填字母)。A、转移时,没有洗涤烧杯和玻璃棒 B、定容时,眼睛俯视刻度线 C、摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切(4)、某同学4次测定所消耗的溶液的体积如下:测定次序
第一次
第二次
第三次
第四次
11.90
12.10
12.00
12.00
根据这位同学的实验数据,操作④中和的过量稀盐酸中的物质的量为 , 由此计算出药片中碳酸钙的质量分数为。
-