辽宁省重点高中沈阳市郊联体2022-2023学年高一上学期期中考试化学试题
试卷更新日期:2022-12-14 类型:期中考试
一、单选题
-
1. 化学与生活密切相关,学好化学有助于提高生活质量,下列说法错误的是( )A、面包师用苏打发泡剂烘焙面包 B、夏日的傍晚常常看到万丈霞光穿云而过的美景与胶体的性质有关 C、“84消毒液”的有效成分为NaClO,具有杀菌、消毒的作用 D、铁粉常用作食品包装袋中的抗氧化剂2. 当光束通过下列分散系时,能观察到丁达尔效应的是( )A、NaCl溶液 B、蔗糖溶液 C、CuSO4溶液 D、淀粉溶液3. 金属钡进行焰色试验时,呈现的颜色是( )A、黄色 B、黄绿色 C、紫色 D、紫红色4. 在强碱性溶液中不能大量共存的离子组是( )A、Ba2+、Na+、NO、Cl- B、K+、Na+、CO、S2- C、NH、Cu2+、Cl-、NO D、K+、Na+、NO、SO5. 关于同温同压下等体积的N2O(气体)和CO2的叙述,其中正确的是( )
①质量相同 ②所含碳原子数与氮原子数相等 ③所含分子数相等
A、①②③ B、②③ C、①② D、①③6. 分类是一种重要的方法,下列有关物质的分类说法正确的是( )A、NO是非金属氧化物,也是酸性氧化物 B、Na2O、Al2O3是金属氧化物,也是碱性氧化物 C、漂白粉、漂粉精、84消毒液都是混合物 D、稀硫酸、石墨、熔融CaO均能导电,属于电解质7. 根据下列反应:(1)2Fe3++2I-=2Fe2++I2;(2)Br2+2Fe2+=2Br-+2Fe3+ , 判断离子的还原性由强到弱的顺序是( )A、Br->I->Fe2+ B、I->Fe2+>Br- C、Fe2+>I->Br- D、Br->Fe2+>I-8. 下列酸碱盐之间的转化不能一步完成的是 ( )A、Fe(OH)3→Fe2(SO4)3 B、BaSO4→Ba(NO3)2 C、Na2CO3→NaOH D、H2SO4→CuSO49. 下列离子方程式中正确的是( )A、向石灰乳中通入氯气制备漂白粉:Cl2+2OH-=Cl-+ClO-+H2O B、氯化铁溶液腐蚀印刷电路铜板:2Fe3++3Cu=2Fe+3Cu2+ C、碳酸氢钠与硫酸氢钠溶液反应: +H+=H2O+CO2↑ D、氧化铝与氢氧化钠溶液:Al3++3OH-=Al(OH)3↓10. 下列说法错误的是( )A、赤铁矿的主要成分是Fe3O4 B、目前我国流通的硬币是由合金材料制造的 C、铝制品在生活中非常普遍,这是因为表面覆盖着氧化膜,对内部金属起保护作用 D、由镍、铁、碳、钴组成的合金可以制造喷气式飞机的发动机叶片,能承受1100℃的高温11. 如图所示,在A处通入未经干燥的氯气,当关闭B阀时,C处的红布条看不到明显现象:当打开B阀后,C处的红布条逐渐褪色:则D瓶中盛放的溶液可能是( )①饱和NaCl溶液
②NaOH溶液
③H2O
④浓硫酸
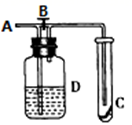 A、①② B、①③ C、②④ D、③④12. 在NaCl、MgCl2和MgSO4三种盐配成的混合溶液中,若Na+的浓度为0.1 mol/L,Mg2+的浓度为0.25 mol/L,Cl-的浓度为0.2 mol/L, 则SO42-的物质的量浓度为( )A、0.5 mol/L B、0.2 mol/L C、0.45 mol/L D、0.25 mol/L13. 下列实验装置正确且能达到实验目的的是( )
A、①② B、①③ C、②④ D、③④12. 在NaCl、MgCl2和MgSO4三种盐配成的混合溶液中,若Na+的浓度为0.1 mol/L,Mg2+的浓度为0.25 mol/L,Cl-的浓度为0.2 mol/L, 则SO42-的物质的量浓度为( )A、0.5 mol/L B、0.2 mol/L C、0.45 mol/L D、0.25 mol/L13. 下列实验装置正确且能达到实验目的的是( )



A.验证碳酸氢钠的热稳定性
B.检验过氧化钠与水反应的产物之一
C.除氯气中的氯化氢气体
D.测新制氯水的pH值
A、A B、B C、C D、D14. 现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应,已知Na2SO3可被K2Cr2O7氧化为Na2SO4 , 则元素Cr在还原产物中的化合价为( )A、+2 B、+3 C、+4 D、+515. 如图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系。下列说法正确的是( ) A、铁与高温水蒸气的反应可实现上述转化① B、FeO是一种黑色粉末,不稳定,在空气中受热,迅速发生转化②生成红棕色粉末 C、加热Fe(OH)3发生转化⑥,加水溶解可实现转化③ D、由图可预测:高铁酸盐(FeO)具有强氧化性,可用于消毒
A、铁与高温水蒸气的反应可实现上述转化① B、FeO是一种黑色粉末,不稳定,在空气中受热,迅速发生转化②生成红棕色粉末 C、加热Fe(OH)3发生转化⑥,加水溶解可实现转化③ D、由图可预测:高铁酸盐(FeO)具有强氧化性,可用于消毒二、计算题
-
16. 设NA为阿伏加德罗常数的值,根据所学知识,回答下列问题。(1)、1.6gCH4含有的电子数是个。(2)、标准状况下,含有6.02×1023个氧原子的CO2质量是g,体积是L。(3)、同温同压下,体积比为3:2的H2和CO,它们的物质的量之比为 , 质量之比为(填最简整数比)。(4)、已知ag某气体中含分子数为b,则该气体的摩尔质量为。(5)、VLFe2(SO4)3溶液中含Fe3+ag,则溶液中SO的物质的量浓度为。
三、综合题
-
17. 为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。(1)、往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色:A , B。(2)、写出上述过程中有关反应的化学方程式:Fe2O3→A , A→B。(3)、向B溶液中逐滴加入NaOH得到C,此过程中可观察到的现象是。(4)、将A的饱和溶液滴入沸水中并不断加热,可制得胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为。18. 实验室利用如图装置制备KClO,并探究其性质。据图回答下列问题:
 (1)、盛放浓盐酸的仪器名称是 , A中发生反应的离子方程式为。(2)、B中盛放的试剂是 , 其作用是。(3)、制备KClO的反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是。(4)、E的作用是 , 下列不能代替E中NaOH溶液的是(填正确答案标号)。
(1)、盛放浓盐酸的仪器名称是 , A中发生反应的离子方程式为。(2)、B中盛放的试剂是 , 其作用是。(3)、制备KClO的反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是。(4)、E的作用是 , 下列不能代替E中NaOH溶液的是(填正确答案标号)。A.H2SO4溶液|B.NaCl溶液 C.FeCl2溶液|D.KI溶液
19. 实验室某浓盐酸试剂瓶上的部分标签如图所示,某同学欲用上述浓盐酸和蒸馏水配置480mL。物质的量浓度为0.3mol/L的稀盐酸,回答下列问题 (1)、该浓盐酸中HCl的物质的量浓度为mol/L。(2)、该学生需要量取mL上述浓盐酸进行配制。(3)、配制过程中,除需要使用烧杯、量筒、玻璃棒外,还需要使用的仪器(填名称)。(4)、配制时,其正确的操作顺序是(要求用字母表示,每个字母只能用一次)。
(1)、该浓盐酸中HCl的物质的量浓度为mol/L。(2)、该学生需要量取mL上述浓盐酸进行配制。(3)、配制过程中,除需要使用烧杯、量筒、玻璃棒外,还需要使用的仪器(填名称)。(4)、配制时,其正确的操作顺序是(要求用字母表示,每个字母只能用一次)。A.用少量蒸馏水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量蒸馏水的烧
杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入mL的容量瓶中
D.将容量瓶塞紧,颠倒摇匀
E.改用胶头滴管向容量瓶中滴加蒸馏水,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直至液面接近刻度线1-2cm处
(5)、在配制过程中,下列实验操作会引起的误差是(填“变大”、“变小”、“无影响”)。①移液前,容量瓶内有少量水。
②定容时俯视刻度线。
③摇匀后静置,发现液面下降低于刻度线,继续加水至与刻度线相切。
-