湖南省邵阳市武冈市2022-2023学年高二上学期期中考试化学试题
试卷更新日期:2022-12-14 类型:期中考试
一、单选题
-
1. 化学与生活密切相关,下列有关说法错误的是( )A、肥皂水显碱性,可用作蚊虫叮咬处的清洗剂 B、用氯化钠作pH调节剂 C、利用明矾溶液可清除铜镜表面的铜锈 D、牙膏中添加氟化物用于预防龋齿2. 下列物质属于弱电解质的是( )A、 B、 C、 D、HCl3. 在0.1mol·L-1的HCN溶液中存在如下电离平衡HCNH++CN- , 对该平衡,下列叙述正确的是( )A、加热,平衡正向移动,电离常数变大 B、加水,平衡正向移动,电离常数变大 C、滴加少量0.1mol·L-1HCl溶液,溶液中c(H+)减少 D、加入少量NaCN固体,平衡正向移动4. 下列有关化学反应方向及其判据的说法中错误的是( )A、1mol在不同状态时的嫡值: B、反应 能否自发进行与温度有关 C、分解和HClO分解均是自发过程,故这两个反应的和的变化相同 D、常温下,反应能自发进行,则该反应的5. 某化学反应的能量变化如图所示,下列说法错误的是 ( )
 A、该反应可能不需要加热就能够发生 B、该反应断键吸收的总能量大于成键释放的总能量 C、该反应可能是化合反应,也可能是分解反应 D、该反应的化学方程式可能为 2Na+2H2O =2NaOH+2H2↑6. 下列各式中,没有符合题意表示物质在溶液中的电离过程的是( )A、HCOH++CO B、H2CO32H++CO C、NH4 HCO3=NH+HCO D、NH3·H2ONH+OH-7. 关于有效碰撞理论,下列说法错误的是( )A、相同条件下活化分子百分数越多,有效碰撞次数越多,反应速率越快 B、一般情况下,正、逆反应的活化能越小反应速率越快 C、增大压强提高活化分子百分数,反应速率增大 D、催化剂降低反应所需活化能,提高活化分子百分数反应速率增大8. 已知在25℃、101kPa下,1gC8H18燃烧生成CO2和H2O(l)时放出48.40kJ的热量,表示上述反应的热化学方程式正确的是( )A、 ΔH=-48.40 kJ·mol-1 B、 ΔH=-5 518 kJ·mol-1 C、 ΔH=+5 518 kJ·mol-1 D、 ΔH=-48.40 kJ·mol-19. 下列水解化学方程式或离子方程式正确的是( )A、CH3COO-+H2OCH3COOH+OH- B、NH+H2ONH4OH+H+ C、S2-+2H2OH2S+2OH- D、NaCl+H2ONaOH+HCl10. 2021年12月9日,神舟十三号乘组航天员翟志刚、王亚平、叶光富在中国空间站进行太空授课。王亚平利用泡腾片演示了微重力环境下液体表面张力的实验。某维C泡腾片具有抗氧化、防衰老的功效,含有维生素C、柠檬酸、碳酸氢钠、乳糖、山梨糖醇等,遇水有大量气体生成。硝酸铵是运载火箭推进剂的成分之一,下列说法正确的是( )A、硝酸铵固体及其水溶液均可以导电 B、适当加热硝酸铵溶液,溶液酸性减弱 C、其水溶液显酸性,原理是: D、氮气是硝酸铵在一定条件下分解的产物之一,其电子式为
A、该反应可能不需要加热就能够发生 B、该反应断键吸收的总能量大于成键释放的总能量 C、该反应可能是化合反应,也可能是分解反应 D、该反应的化学方程式可能为 2Na+2H2O =2NaOH+2H2↑6. 下列各式中,没有符合题意表示物质在溶液中的电离过程的是( )A、HCOH++CO B、H2CO32H++CO C、NH4 HCO3=NH+HCO D、NH3·H2ONH+OH-7. 关于有效碰撞理论,下列说法错误的是( )A、相同条件下活化分子百分数越多,有效碰撞次数越多,反应速率越快 B、一般情况下,正、逆反应的活化能越小反应速率越快 C、增大压强提高活化分子百分数,反应速率增大 D、催化剂降低反应所需活化能,提高活化分子百分数反应速率增大8. 已知在25℃、101kPa下,1gC8H18燃烧生成CO2和H2O(l)时放出48.40kJ的热量,表示上述反应的热化学方程式正确的是( )A、 ΔH=-48.40 kJ·mol-1 B、 ΔH=-5 518 kJ·mol-1 C、 ΔH=+5 518 kJ·mol-1 D、 ΔH=-48.40 kJ·mol-19. 下列水解化学方程式或离子方程式正确的是( )A、CH3COO-+H2OCH3COOH+OH- B、NH+H2ONH4OH+H+ C、S2-+2H2OH2S+2OH- D、NaCl+H2ONaOH+HCl10. 2021年12月9日,神舟十三号乘组航天员翟志刚、王亚平、叶光富在中国空间站进行太空授课。王亚平利用泡腾片演示了微重力环境下液体表面张力的实验。某维C泡腾片具有抗氧化、防衰老的功效,含有维生素C、柠檬酸、碳酸氢钠、乳糖、山梨糖醇等,遇水有大量气体生成。硝酸铵是运载火箭推进剂的成分之一,下列说法正确的是( )A、硝酸铵固体及其水溶液均可以导电 B、适当加热硝酸铵溶液,溶液酸性减弱 C、其水溶液显酸性,原理是: D、氮气是硝酸铵在一定条件下分解的产物之一,其电子式为 11. 在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)zC(g),平衡时测得A的浓度为0.5 mol∙L−1 , 保持温度不变,将容器的容积扩大到原来的5倍,再达到平衡时,测得A的浓度降低为0.11 mol∙L−1。下列有关判断正确的是( )A、x+y<z B、平衡向正反应方向移动 C、B的转化率增大 D、C的体积分数下降12. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、的溶液中:、、、 B、溶液中:、、、 C、使甲基橙变红的溶液中:、、、 D、由水电离出的的溶液中:、、、13. 在一定温度下的容积不变的密闭容器中发生反应:22SO3(g)。下列不能说明反应达到平衡状态的是( )A、各物质的浓度不再变化 B、混合物的密度不再变化 C、SO2的体积分数不再变化 D、气体的压强不再变化14. 下列事实不能用勒夏特列原理解释的是( )A、由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 B、红棕色的NO2加压后颜色先变深后变浅 C、向氯水中加CaCO3后,溶液漂白性增强 D、在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去15. 反应:A(g)+3B(g)2C(g)+2D(g),在4种不同情况下的反应速率分别为:①v(A)=0.5 mol·L-1·s-1;②v(B)=0.45 mol·L-1·s-1;③v(C)=0.3 mol·L-1·s-1;④v(D)=0.45 mol·L-1·s-1;下列有关反应速率的比较中正确的是( )A、①>②>③>④ B、①<②=③<④ C、①>④>②=③ D、①<②<③<④16. 已知反应N2O4(g) 2NO2(g) △H=+57kJ/mol,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
11. 在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)zC(g),平衡时测得A的浓度为0.5 mol∙L−1 , 保持温度不变,将容器的容积扩大到原来的5倍,再达到平衡时,测得A的浓度降低为0.11 mol∙L−1。下列有关判断正确的是( )A、x+y<z B、平衡向正反应方向移动 C、B的转化率增大 D、C的体积分数下降12. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、的溶液中:、、、 B、溶液中:、、、 C、使甲基橙变红的溶液中:、、、 D、由水电离出的的溶液中:、、、13. 在一定温度下的容积不变的密闭容器中发生反应:22SO3(g)。下列不能说明反应达到平衡状态的是( )A、各物质的浓度不再变化 B、混合物的密度不再变化 C、SO2的体积分数不再变化 D、气体的压强不再变化14. 下列事实不能用勒夏特列原理解释的是( )A、由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 B、红棕色的NO2加压后颜色先变深后变浅 C、向氯水中加CaCO3后,溶液漂白性增强 D、在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去15. 反应:A(g)+3B(g)2C(g)+2D(g),在4种不同情况下的反应速率分别为:①v(A)=0.5 mol·L-1·s-1;②v(B)=0.45 mol·L-1·s-1;③v(C)=0.3 mol·L-1·s-1;④v(D)=0.45 mol·L-1·s-1;下列有关反应速率的比较中正确的是( )A、①>②>③>④ B、①<②=③<④ C、①>④>②=③ D、①<②<③<④16. 已知反应N2O4(g) 2NO2(g) △H=+57kJ/mol,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( ) A、A,C两点气体的平均相对分子质量:A>C B、A,C两点气体的颜色:A深,C浅 C、由状态B到状态A,可以用加热的方法 D、A,C两点的反应速率:A>C
A、A,C两点气体的平均相对分子质量:A>C B、A,C两点气体的颜色:A深,C浅 C、由状态B到状态A,可以用加热的方法 D、A,C两点的反应速率:A>C二、综合题
-
17. 在2L密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)2NH3(g)ΔH<0。(1)、该反应是(填“吸热”或“放热”)反应;(2)、当反应达到平衡时,N2和H2的浓度比是;N2和H2的转化率之比是;(3)、若平衡时体系中H2的浓度为2mol/L,则N2的转化率是 , 该温度下平衡常数K=;(4)、当达到平衡时,充入氩气,并保持压强不变,平衡将(填“正向”“逆向”或“不”)移动;(5)、若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度(填“大于”“小于”或“等于”)原来的2倍。18. 图1实验装置用于测定锌与稀硫酸反应的速率。
 (1)、检查图1装置气密性的操作方法是。(2)、分别取2 g颗粒大小相同的锌粒分别与体积均为40 mL的1 mol·L-1硫酸、4 mol·L-1硫酸反应,收集25 mL H2时所需时间后者比前者。填“长”或“短”(3)、某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:
(1)、检查图1装置气密性的操作方法是。(2)、分别取2 g颗粒大小相同的锌粒分别与体积均为40 mL的1 mol·L-1硫酸、4 mol·L-1硫酸反应,收集25 mL H2时所需时间后者比前者。填“长”或“短”(3)、某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:
a. 在多孔塑料袋中装入锌粒;
b. 在锥形瓶中加入40 mL的1 mol·L-1硫酸;
c. 塞好橡胶塞,时立即用秒表计时;
d. 注射器内每增加5mL气体时读取一次秒表。
(4)、实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是 , 反应进行一定时间后速率逐渐减慢,原因是。(5)、测得产生H2的体积与反应时间的关系曲线如图3所示,t1~t2时间段氢气体积略有减小的原因是;在64 s内用H+浓度表示的平均反应速率v(H+) = (此时,溶液体积仍为40 mL,气体摩尔体积为25 L·mol-1)。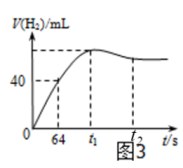 19. 按要求填空(1)、在25℃,101 kPa下,氢气在1.00mol氧气中完全燃烧,生成2.00mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学方程式为。(2)、某反应A(g)+B(g)= C(g)+D(g)过程中的能量变化如图所示,回答问题。
19. 按要求填空(1)、在25℃,101 kPa下,氢气在1.00mol氧气中完全燃烧,生成2.00mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学方程式为。(2)、某反应A(g)+B(g)= C(g)+D(g)过程中的能量变化如图所示,回答问题。
①该反应是(填“吸热”或“放热”)反应,反应的ΔH= kJ· mol-1(用含E1、E2的代数式表示)。
②该反应过程中,断裂旧化学键吸收的总能量(填“>”“ <”或“=”)形成新化学键释放的总能量
(3)、由金红石(TiO2)制取单质Ti的步骤为:已知:Ⅰ.
Ⅱ.
Ⅲ.
①的。
②若已知2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2
则Q1Q2(填“>”、“<”或“=”)。
20. 稀强酸、稀强碱反应生成1mol水时放出57.3 kJ的热。(1)、实验室中可用稀盐酸和氢氧化钠稀溶液反应来测定中和热。请写出能表示该反应中和热的热化学方程式;(2)、分别取40 mL 0.50 mol/L盐酸与40 mL 0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。假设盐酸和氢氧化钠溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c = 4.18 J/(g·℃)。实验时,测得反应前盐酸与NaOH溶液的平均温度为21.5℃,反应后混合溶液的温度为24.9℃。则实验测得的中和热△H=(保留1位小数)(3)、如果用含1 mol CH3COOH的稀醋酸与足量稀氢氧化钠溶液反应,反应放出的热57.3 kJ(填“大于”、“小于”或“等于”); 理由是。(4)、25℃时,用50mL0.5mol/L盐酸与50mL0.55mol/LNaOH溶液反应测定中和热,下列说法正确的是。(填字母序号)
a.可用如图所示装置测定中和热
b.若将环形玻璃搅拌棒换成铜丝,测定的△H偏低
c.若2种溶液的体积均改为60mL,测定的△H偏高
d.若将盐酸改为醋酸,测定的△H偏高